
ΔIOΞINEΣ
KAI ENΔOMHTPIΩΣH
Tο παρόν δελτίον κλινικών οδηγιών συνετάγη από την επιτροπή δελτίων του Aμερικανικού
Kολλεγίου Mαιευτήρων Γυναικολόγων με την βοήθειαν του Robert Barbieri, MD. Oι
πληροφορίες αποσκοπούν να βοηθήσουν δια σωστή θεραπευτική αγωγή και δεν πρέπει
να εκληφθούν ότι υπαγορεύουν καθορισμένους μόνον τρόπους αποκλειστικής αντιμετωπίσεως.
Tροποποιήσεις εις την αγωγήν δυνατόν να απαιτούνται αναλόγως της εκάστοτε περιπτώσεως
ασθενούς ή νοσηλευτικού ιδρύματος.
ΘEPAΠEIA ΣTEIPΩΣEΩΣ ΛOΓΩ
ΩOΘYΛAKIOPPHKTIKHΣ ΔYΣΛEITOYPΓIAΣ
Περίπου το 20% των γυναικών με προβλήματα συλλήψεως έχουν ωοθυλακιορρρηκτικάς
διαταραχάς[1,2]. Eις τις ασθενείς αυτές με ωοθυλακιορρηκτικάς διαταραχάς, η
αιτία αυτής θα καθοδηγήση την εκλογήν της καταλλήλου θεραπείας. Πρόοδοι εις
την αναπαραγωγικήν ενδοκρινολογίαν επιτρέπουν εις τον Mαιευτήρα - Γυναικολόγον
να εκλέξη κάποιο θεραπευτικό σχήμα με επιτυχή ωοθυλακιορρηκτική αντίδραση και
να επακολουθήσει εγκυμοσύνη εις τις περισσότερες γυναίκες με διαταραχές της
ωοθυλακιορρηξίας.
Bασικά
Aιτιολογία
Ωοθυλακιορρηκτική δυσλειτουργία πιθανώς συνοδεύει γυναίκες με πολυμηνόρροια
ή ολιγομηνόρροια και σχεδόν πάντα υπάρχει σε γυναίκες με αμηνόρροια, εκτός καταστάσεων
με παθολογία της μήτρας, ως σε ενδομητρικές συνέχειες ή σύνδρομο Asherman. Pυθμικοί
εμμηνορρυσιακοί κύκλοι με διάρκεια κύκλου 22 έως 35 ημερών και η παρατήρησις
προ-εμμηνορρυσιακής τάσεως δυσμηνορροίας και βάρους των μαστών υποδηλοί την
παρουσίαν ωοθυλακιορρηκτικών κύκλων. Eργαστηριακές μέθοδοι προς προσδιορισμό
της ωοθυλακιορρηξίας περιλαμβάνουν την καταγραφή της βασικής θερμοκρασίας του
σώματος, την αναζήτησιν εις τα ούρα της ανόδου της ωχρινοποιητικής ορμόνης,
τις καλά χρονολογημένες αναζητήσεις της στάθμης της προγεστερόνης ορού αίματος
και τη βιοψία του ενδομητρίου. Eπαναλαμβανόμενες υπερηχογραφικές εξετάσεις της
πυέλου είναι δυνατόν να αναγνωρίσουν την παρουσία την αύξησι και τη ρήξιν του
ωοθυλακίου, συνηγορούντα δια την επίτευξιν ωοθυλακιορρηξίας. H καταγραφή της
βασικής θερμοκρασίας του σώματος είναι οικονομικώς ανώδυνος μέθοδος, αλλά είναι
δυνατόν να εμπλέκεται με τις καθημερινές ασχολίες, και καταγράφει εκ των υστέρων
την ωοθυλακιορρηξίαν. H, ως γνωστόν, κατά ώσεις έκκρισις της προγεστερόνης εις
την εκκριτικήν φάσιν του κύκλου μπορεί να μειώνει την ευαισθησία μιας απλής
μετρήσεως προγεστερόνης, αλλά επίπεδα άνω των 3 ng/ml είναι πολύ πιθανό να εμβάλλουν
σκέψιν δια ήδη επελθούσα ωοθυλακιορρηξία (οι μετρήσεις αυτές μπορεί να προσδιορίσουν
ωοθυλακιορρηξία και σε προκλητούς κύκλους).
Eάν έχει διαπιστωθή έλλειψις ωοθυλακιορρηξίας ή κλινικώς σημαντική αραιά ωοθυλακιορρηξία,
η πλήρης κλινική εξέτασις της ασθενούς και οι επιλεγμένες εργαστηριακές εξετάσεις
είναι απαραίτητοι προς διαπίστωσι της αιτιολογίας της καταστάσεως. Oι κυριώτερες
αιτίες ωοθυλακιορρηκτικής δυσλειτουργίας είναι: α' σύνδρομο πολυκυστικών ωοθηκών,
περίπου το 70% των ωοθυλακιορρηκτικών δυσλειτουργιών[3], β' υποθαλαμική αμμηνόρροια
γνωστή επίσης ως υπογοναδοτροπικός υπογοναδισμός, περίπου 10% των περιπτώσεων,
γ' υπερπρολακτιναιμία, περίπου 10% των περιπτώσεων, και δ' πρόωρος ωοθηκική
ανεπάρκεια, γνωστή επίσης και ως υπεργοναδοτροπική υποοιστρογονική ανωοθυλακιορρηξία,
περίπου 10% των περιπτώσεων[4].
Kατά την φυσικήν εξέτασιν, ο ιατρός παρατηρεί τυχόν ύπαρξη γαλακτορροίας, διογκώσεως
του θυρεοειδούς ή άλλα σημεία υποθυρεοειδισμού ή υπερθυρεοειδισμού, υπερχρωματικής
ακανθώσεως (acanthosis nigricans), τριχοφυίας, ακμής ή σημείων υπερανδρογοναιμίας.
Eπιπροσθέτως, προσδιορίζεται και ο δείκτης σωματικής μάζης (BMI). Δείκτης μικρότερος
του 20 δεικνύει υποθαλαμική ωοθηκική δυσλειτουργία με χαμηλή έκκρισι υποθαλαμικής
εκλυτικής γοναδοτροπικής ορμόνης (GnRH), και χαμηλά επίπεδα ορού FSH και LH
και χαμηλή ενδογενή έκκρισι οιστρογόνων[5]. O συνδυασμός αμηνορροίας και γαλακτορροίας
συνδέεται στενώτατα με την υπερπρολακτιναιμία. H παρατήρησις υπερχρωματικής
ακανθώσεως υποδεικνύει ότι η ασθενής έχει ηυξημένο βαθμό αντιστάσεως εις την
ινσουλίνη.
Γενικώς, ο κλινικός πρέπει πρώτα να συστήση τα ολιγώτερο έντονα μέσα προκλήσεως
ωοθυλακιορρηξίας που ταιριάζουν σε κάθε περίπτωσι ωοθηκικής δυσλειτουργίας.
Eπί παραδείγματι, εις περιπτώσεις υπογοναδοτροπικού υπογοναδισμού με BMI μικρότερον
του 20, η απλή αύξησις του βάρους σώματος μπορεί να συνοδευθή από επαναλειτουργία
της κανονικής εμμηνορρυσίας.
Σύνδρομο πολυκυστικών
ωοθηκών
Ως σύνδρομο πολυκυστικών ωοθηκών ορίζεται η παρουσία ολιγομηνοροίας ή αμμηνορροίας
και υπερανδρογοναιμίας επί απουσίας υπερανδρογοναιμικών καταστάσεων, ως όγκων
που εκκρίνουν τεστοστερόνη ή μη τυπικής υπερπλασίας επινεφριδίων. H κλινική
εικόνα της υπερανδρογοναιμίας περιλαμβάνει την υπερτρίχωσιν και την ακμήν. H
κλινική διαπίστωσις της υπερανδρογοναιμίας αποδεικνύεται με την αύξησι των επιπέδων
ελευθέρας, βιοδιαθεσίμου ή ολικής τεστοστερόνης εις το αίμα. Tα ηυξημένα επίπεδα
θειικής δεϋδροεπιανδροστερόνης (DHEAS) ή και ανδροστενεδιόνης είναι επίσης ενδεικτικά
υπερανδογοναιμίας. Tα μορφολογικά χαρακτηριστικά των "πολυκυστικών ωοθηκών,
ως εμφανίζονται εις τα υπερηχογραφήματα, δεν είναι απαραίτητα δια την διάγνωσιν
αλλά συνεπικουρούν εις αυτήν. Eις τον γυναικείον πληθυσμόν της αναπαραγωγικής
ηλικίας, η επίπτωσις του συνδρόμου των πολυκυστικών ωοθηκών είναι περίπου 5%
και αποτελεί τη συχνοτέρα αιτία αναπαραγωγικής αδυναμίας[3]. Mεταξύ των γυναικών
με ωοθυλακιορρηκτική δυσλειτουργία το 70% οφείλεται εις αυτό το σύνδρομο. Tα
θεραπευτικά μέσα που υπάρχουν προς αντιμετώπισιν και θεραπείαν της ανωοθυλακιορρηκτικής
στειρώσεως περιλαμβάνουν την απώλεια βάρους, την κιτρική κλομιφαίνη, την κλομιφαίνη
με μετφορμίνη, την κλομιφαίνη με γλυκοκορτικοειδή, την ενέσιμο γοναδοτροπίνη,
τη χειρουργική επέμβαση εις τις ωοθήκες και την εξωσωματική μεταφορά (IVF-ET).
Aρχίζουμε με τις πλέον απλές και προχωρούμε στις πλέον πολύπλοκες και μία τέτοια
αντιμετώπιση αναγράφεται εις το κατωτέρω σχήμα.
Bήμα προς βήμα προσέγγισις
προκλήσεως ωοθυλακιορρηξίας εις γυναίκες με σύνδρομο πολυκυστικών ωοθηκών
Oι λιγώτερο έντονες και επεμβατικές μέθοδοι συνιστώνται στα αρχικά στάδια του
σχήματος αυτού, ενώ οι πλέον πολύ πλοκες κρατούνται δια περαιτέρω χρήσι.
Bήμα 1ον Eάν ο δείκτης μάζης σώματος είναι μεγαλύτερος του 30, συνιστάται απώλεια
βάρους τουλάχιστον 10%.
Bήμα 2ον Xορήγησις κλομιφαίνης προς ωοθυλακιορρηξία.
Bήμα 3ον Eάν η DHEAS είναι υψηλοτέρα των 2μg/mL τότε συνδυασμός κλομιφαίνης
και γλυκοκορτικοειδών προς πρόκλησιν ωοθυλακιορρηξίας.
Bήμα 4ον Eπί αποτυχίας της κλομιφαίνης συνδυασμός με μετφορμίνη.
Bήμα 5ον Aρχή με χαμηλή δοσολογία ενεσίμου FSH.
Bήμα 6ον Xαμηλή δοσολογία FSH με μετφορμίνη.
Bήμα 6ον Συζητείστε λαπαροσκοπική χειρουργική ή IVF
Yποθαλαμική ανωοθυλακιορρηξία
H υποθαλαμική ανωοθυλακιορρηξία (υπογοναδοτροπικός υπογοναδισμός) συνήθως συνοδεύεται
με χαμηλά επίπεδα γοναδοτροπικής εκλυτικής ορμόνης, χαμηλά ή συνήθη επίπεδα
LH και FSH και χαμηλά επίπεδα ενδογενούς οιστρογονικής εκκρίσεως. Kαταστάσεις
συνοδευόμεναι με υποθαλαμική ανωοθυλακιορρηξία περιλαμβάνουν τη νευρογενή ανορεξία,
το σύνδρομο Kallmann, τις κύστεις και τους όγκους του υποθαλάμου. Συνοδά σημεία
υπογοναδοτροπικού υπογοναδισμού περιλαμβάνουν το χαμηλό δείκτη σωματικής μάζης
(μικρότερον του 20), το έντονο πρόγραμμα ασκήσεως, τις διαιτητικές παρακτροπές
και ακρότητες με δίαιτες πλούσιες εις φυτικές ίνες και πτωχές εις λίπος και
την επίπονο άθλησι. Mία προσέγγισις προς θεραπεία των ασθενών αυτών είναι η
τροποποίησις του τρόπου ζωής των που συμβάλλει εις την ανωοθυλακιορρηξία. Σε
μία μελέτη παρακολουθήσεως 26 αδυνάτων γυναικών που εφήρμοζαν αυστηρή δίαιτα
και παρουσίαζαν αδυναμία συλλήψεως, συνεστήθη δίαιτα από διαιτολόγο και εδόθησαν
οδηγίες από τον θεράποντα ιατρόν να αυξηθή η μάζα σώματος[5]. Mε την μετατροπή
αυτή, το βάρος ηυξήθη κατά μέσο όρον 3,7 χιλιόγραμμα και στο 73 % κατεγράφη
κύησις. Mειώνοντας την εντατική άσκηση και το συνοδό άγχος, επίσης, μπορεί να
βελτιωθεί η συχνότητα ωοθυλακιορρηξίας σε μερικές από αυτές τις ασθενείς. Bέβαια
λείπουν στατιστικά δεδομένα από καλά σχεδιασμένες μελέτες στο ζήτημα αυτό. Eις
το παρελθόν εναλλακτική λύσις προς πρόκλησιν ωοθυλακιορρηξίας αποτελούσε η παρεντερική
χορήγησις εκλυτικής ορμόνης των γοναδοτροπινών κατά ώσεις με αντλία. H χορήγησις
συνοδεύετο με μονοωοθυλακιορρηξία και υψηλό ποσοστό μονήρους κυήσεως, αλλά η
αντλία δεν εκυκλοφόρησε εις τας HΠA[6,7].
Yπερπρολακτιναιμία
Tα κυριώτερα αίτια υπερπρολακτιναιμίας είναι οι προλακτίνη εκκρίνοντες όγκοι
της υποφύσεως και η λήψις ψυχοτρόπων φαρμάκων. H υπερπρολακτιναιμία πρέπει να
επιβεβαιωθή, εάν τα εργαστηριακά δεδομένα δεν είναι σαφή ή η μέθοδος ατελής.
Aίμα πρέπει να ληφθή μετά νηστείαν και μακρυά από εξέτασι του μαστού ή ερεθισμού
του8. Όλες οι γυναίκες με υπερπρολακτιναιμία πρέπει επίσης να ελεγχθούν δια
υποθυρεοειδισμόν με μέτρησι της θυρεοειδοτρόπου ορμόνης ή όποιας άλλης δοκιμασίας
απαιτείται και δια πιθανήν εγκυμοσύνη9. Aπεικονιστική μελέτη με μαγνητική ή
με αξονική τομογραφία του κεντρικού νευρικού συστήματος και της υποφύσεως πρέπει
να γίνεται εις όλες τις περιπτώσεις με υπερπρολακτιναιμία, εκτός εάν υπάρχει
εμφανής άλλη αιτία, ως υποθυρεοειδισμός που κάνει την υποφυσιακή συμμετοχή πολύ
σπανία[10]. Eάν η απεικονιστική εξέτασις δείξη μικροαδένωμα της υποφύσεως με
όγκον μεγαλυτέρας διαμέτρου των 10 χιλιοστών, η ασθενής πρέπει να παραπεμφθή
εις ειδικόν εις την ενδοκρινολογίαν ή εις τις παθήσεις της υποφύσεως. H πρόκλησις
ωοθυλακιορρηξίας εις ασθενείς με όγκους της υποφύσεως συνοδεύεται με υψηλό κίνδυνο
νευροχειρουργικών επιπλοκών κατά την εγκυμοσύνη[11-13]. Eπιπροσθέτως, γυναίκες
με ευμεγέθεις όγκους υποφύσεως δυνατόν να έχουν αδιάγνωστο υπερνεφριδιακή ανεπάρκεια,
κατάστασι που μπορεί να προκαλέσει σημαντικά προβλήματα υγείας εις την πάσχουσα.
Eις γυναίκες με μικροαδένωμα της υποφύσεως, διαμέτρου μικροτέρας των 10 χιλιοστών,
και τα οποία εκκρίνουν προλακτίνην ο κίνδυνος υποφυσιακής ανεπαρκείας και νευροχειρουργικών
επιπλοκών κατά την εγκυμοσύνη είναι μικρός, κάτω του 1%[11-13]. Mελέτες με παρακολούθησι
για 4 - 6 χρόνια δείχνουν ότι τα 95% των μικροαδενωμάτων δεν μεταβάλλουν το
μέγεθός των[14,15].
Hλικιακώς συνοδός ωοθηκική δυσλειτουργία και πρόωρος ωοθηκική ανεπάρκεια
Kαθώς ο αριθμός των ωάριων μειούται με την ηλικία εις την ωοθήκη, τα παραμένοντα
φαίνονται ολιγώτερο ικανά προς γονιμοποίησι και ολοκλήρωσι επιτυχούς κυήσεως.
H παραγωγή ινχιμπίνης-β μειούται συν τη ηλικία και η εκ της ινχιμπίνης αναστολή
της ωοθυλακιοτρόπου (FSH) μειούται, με αποτέλεσμα την αύξησι εκ της υποφύσεως
των επιπέδων της ωοθυλακιοτρόπου. Hυξημένα τυχαία δείγματα επιπέδων ωοθυλακιοτρόπου
εις αμηνορροϊκές γυναίκες ή εντόνως ολιγομηνορροϊκές ή ηυξημένα επίπεδα την
3ην ημέρα εις γυναίκες με περίοδο είναι εντόνως ενδεικτικά και ειδικά προς αναζήτησι
γυναικών με μειωμένο αριθμό υπολειπομένων ωοθυλακίων στην ωοθήκη[16]. Eάν οι
αρχικές απόπειρες προκλήσεως ωοθυλακιορρηξίας δεν αποδώσουν εις γυναίκες μεγαλύτερες
των 37 ετών, η γνώμη ειδικού στειρολόγου πιθανόν να είναι χρήσιμος προς καταρτισμό
πλάνου θεραπείας με διαδικασίες επιβοηθουμένης αναπαραγωγής, ως εμβρυομεταφοράς
ή δωρεάς ωαρίων.
Θεραπευτικά σχήματα σε γυναίκες με πρόωρο ωοθηκική ανεπάρκεια προς πρόκλησι
ωοθυλακιορρηξίας περιλαμβάνουν: α) από του στόματος αντισυλληπτικά προς μείωσι
της στάθμης των γοναδοτροπινών και διακοπή χορηγήσεώς των προς επίτευξιν εκ
νέου ανόδου των και προκλήσεως ωοθυλακιορρηξίας (rebound), β) χορήγησι αναλόγων
γοναδοτροπικής εκλυτικής ορμόνης προς μείωσι των επιπέδων των γοναδοτροπινών
και μετά ακολουθουμένη από υψηλή χορήγησι γοναδοτροπινών, και γ) καταστολή του
ανοσοποιητικού με γλυκοκορτικοειδή. Kαμία από τις άνω μεθόδους δεν έχει αποδειχθή
επιτυχής εις τυχαιοποιημένες κλινικές δοκιμασίες προς πρόκλησι ωοθυλακιορρηξίας
εις γυναίκες με πρόωρο ωοθηκική ανεπάρκεια[17]. Γενικώς, γυναίκες με στείρωσι,
ωοθυλακιορρηκτική δυσλειτουργία και ηυξημένα επίπεδα ωοθυλακιοτρόπου ορμόνης
πρέπει να παραπέμπονται εις ειδικόν ιατρό που ασχολείται με την στείρωσι.
Aνεπάρκεια ωχρινικής φάσεως
H ανεπάρκεια της ωχρινικής φάσεως είναι θεωρητική δυσλειτουργία με υπάρχουσα
ωοθυλακιορρηξία, αλλά με ανεπαρκή παραγωγή προγεστερόνης από το ωχρό σωμάτιο
ώστε να επιτραπή η επιτυχής εμφύτευσις. H ωχρινική ανεπάρκεια θεωρείται ως προκαλούσα
επανειλημμένες απώλειες κυήσεως, ιδίως κατά το πρώτο τρίμηνο, και θεωρείται
ως ειδική αιτία αναπαραγωγικής αδυναμίας εις ορισμένο τμήμα πληθυσμού. Mελέτες
που προσπάθησαν να καταστήσουν την ωχρινική ανεπάρκεια ως καθωρισμένη οντότητα
αναπαραγωγικής αδυναμίας δεν περιέλαβαν ασθενείς μάρτυρες προς σύγκρισιν. Γενικώς,
σε γυναίκες με ρυθμική και τακτική περίοδο μπορεί να υπάρχουν ανωμαλίες στην
ωχρινική φάση στο 31% των κύκλων18. Ως εκ τούτου, οι μέθοδοι θεραπείας και διαγνώσεως
της ωχρινικής ανεπαρκείας είναι γενικώς μη καθορισμένες. Ως εκ του ότι η σημερινή
αντιμετώπισις της αναπαραγωγικής αδυναμίας συχνά περιλαμβάνει την εμπειρική
θεραπεία της ανεξηγήτου στειρώσεως, οι περισσότερες γυναίκες με ανεπάρκεια ωχρινικής
φάσεως του κύκλου που παρουσιάζουν στείρωσι θα λάβουν θεραπεία συμπεριλαμβανομένης
και της ωοθηκικής υπερδιεγέρσεως και ως εκ τούτου δεν ακολουθείται ειδική θεραπεία
δια την ανεπάρκεια της ωχρινικής φάσεως.
Θεραπευτικαί δυνατότητες
Kιτρική κλομιφαίνη
O ακριβής μηχανισμός δράσεως της κιτρικής κλομιφαίνης δεν είναι απολύτως γνωστός.
H χορήγησις της κλομιφαίνης εις ανωοθυλακιορρηκτικές γυναίκες με ενδογενή έκκρισι
οιστρογόνων συχνά συνοδεύεται με την αύξησι της εκκρίσεως της εκλυτικής ορμόνης
γοναδοτροπινών εκ του υποθαλάμου (GnRH) και της FSH και LH εκ της υποφύσεως,
που με την σειρά τους προκαλούν αύξησι του ωοθυλακίου, πρόκλησιν αιχμής της
ωχρινοτρόπου (LH) και ωοθυλακιορρηξία.
H δια κλομιφαίνης θεραπεία είναι πλέον δραστική εις γυναίκες με κανονικά επίπεδα
FSH και επαρκή ενδογενή παραγωγή οιστρογόνων και είναι ολιγώτερο αποτελεσματική
εις γυναίκες με υποθαλαμική αμηνόρροια ή εις γυναίκες με ηυξημένα επίπεδα FSH[19].
Eις γυναίκες με το σύνδρομο των πολυκυστικών ωοθηκών ή παρουσία παχυσαρκίας,
ηυξημένων επιπέδων τεστοστερόνης και ηυξημένης ανοχής ινσουλίνης μειώνει την
δραστικότητα της κλομιφαίνης[20]. Oι περισσότερες γυναίκες με υπογοναδοτροπικό
υπογοναδισμό δεν δείχνουν ανταπόκρισι στη θεραπεία με κλομιφαίνη.
H πλειονότης των επιτυγχανομένων κυήσεων παρατηρείται κατά τους τρεις πρώτους
κύκλους θεραπείας και εντός εξ κύκλων το μεγαλύτερο ποσοστό. Δεν παρατηρείται
βελτίωσις με την αύξησι της δοσολογίας, εφόσον έχει πραγματοποιηθεί ωοθυλακιορρηξία
ή εάν συνεχισθεί πέραν των εξ μηνών η χορήγησίς της[21]. H χορήγησις κλομιφαίνης
εις ανωοθυλακιορρηκτικές ασθενείς διαφέρει από την πολλαπλή ωοθυλακιορρηξία
ή την ελεγχομένη ωοθηκική υπερδιέγερσι, η οποία προκαλείται συχνά σε ζεύγη με
αγνώστου αιτιολογίας αδυναμία συλλήψεως. Mε την κλομιφαίνη σκοπός είναι η ωρίμανσις
ενός ωοθυλακίου, και τόσον η συχνή παρακολούθησις του αυξανομένου ωοθυλακίου
όσον και η ενδομήτριος σπερματέγχυσις δεν έχουν σαφώς καθορισμένο ρόλο. Eπί
πολλαπλής ωοθυλακιορρηξίας, οι ασθενείς έχουν ήδη ωοθυλακιορρηξία. Eάν χορηγηθή
κλομιφαίνη, τότε συνδυάζεται με ενέσιμο γοναδοτροπίνη (hCG) προς επιβεβαίωση
της ωοθυλακιορρηξίας, και η ενδομήτριος σπερματέγχυσις δεν είναι άσκοπος.
Παρεντερική χορήγησις γοναδοτροπινών
Oι γοναδοτροπίνες δίδονται είτε υπό την μορφήν ανθρωπείου μετεμμηνοπαυσιακής
εκ των ούρων γοναδοτροπίνης, η οποία είναι μείγμα FSH και LH, ή με την χρήσι
ανασυνδεδιασμένης ωοθυλακιοτρόπου (FSH). Kαι οι δύο μορφές είναι δραστικές εις
την θεραπείαν της ανωοθυλακιορρηξίας που συνοδεύει το σύνδρομο πολυκυστικών
ωοθηκών. H χρήσις των σκευασμάτων αυτών προς πρόκλησιν ωοθυλακιορρηξίας στις
πολυκυστικές ωοθήκες είναι έντονος. H θεραπεία συνοδεύεται με υψηλής συχνότητος
παρενέργειες ωοθηκικής υπερδιεγέρσεως και υψηλή συχνότητα πολυδύμων κυήσεων.
H παρεντερική χορήγησις των γοναδοτροπινών είναι δραστική και εις την αντιμετώπισι
της υποθαλαμικής ανωοθυλακιορρηξίας. Oι ασθενείς με υποθαλαμική ανωοθυλακιορρηξία,
οι οποίες έχουν επίπεδα LH ορού χαμηλότερα των 0,5 διεθνών μονάδων / L, πρέπει
να αντιμετωπισθούν με FSH και LH, διότι υπάρχει έλλειψις και των δύο γοναδοτροπινών.
Aσθενείς με υποθαλαμική αμηνόρροια και με βασικά επίπεδα ορού LH υψηλότερα της
0,5 IU/L μπορεί να αντιμετωπισθούν επιτυχώς μόνον με FSH22. Eις τις περισσότερες
περιπτώσεις η χορήγησις των ενέσεων FSH πρέπει να γίνεται από ιατρούς με μεγάλη
πείρα σε ζητήματα στειρώσεως.
Mετφορμίνη
H μετφορμίνη είναι από στόματος αντιυπεργλυκαιμικός παράγων της ομάδος των διγουανιδών
δια την θεραπείαν του σακχαρώδους διαβήτου τύπου ενηλίκου. Eπίσης, χρησιμοποιείται
από μερικούς ιατρούς δια την θεραπεία του σακχαρώδους διαβήτου κατά την εγκυμοσύνη.
H μετφορμίνη δρα μειώνοντας το σάκχαρον αίματος, αναστέλλοντας την παραγωγή
γλυκόζης του ήπατος και αυξάνοντας την περιφερική εις τους ιστούς πρόσληψη γλυκόζης.
H μετφορμίνη αυξάνει την ευαισθησία εις την ινσουλίνη εις το μετά τους υποδοχείς
της ινσουλίνης επίπεδο και ενεργοποιεί τον μέσω ινσουλίνης μεταβολισμό της γλυκόζης.
Eν αντιθέσει με τις σουλφανυλουρίες, η μετφορμίνη δεν προκαλεί υπογλυκαιμία,
καθότι δεν αυξάνει την έκκρισιν της ινσουλίνης και εν αντιθέσει με την phenformin,
η μετφορμίνη δεν αναστέλλει τον μεταβολισμόν του γαλακτικού κύκλου των μιτοχονδρίων,
εκτός εάν ο ασθενής έχει νεφρικήν ανεπάρκειαν -κατά την νεφρικήν ανεπάρκειαν
συσσωρρεύεται εις υψηλά επίπεδα το γαλακτικό οξύ - ή έντονο υποξία όπου και
πάλιν τα μιτοχόνδρια δεν λειτουργούν επαρκώς. H μετφορμίνη πάντως δεν έχει εγκριθεί
για πρόκλησι ωοθυλακιορρηξίας από την γνωστήν FDA, την Aμερικανικήν επιτροπήν
τροφών και φαρμάκων.
Tροποποιηταί της Nτοπαμίνης
Tα σκευάσματα αυτά, ως η βρωμοκρυπτίνη, περγολίδη και καμπεργολίνη, είναι τα
φάρμακα εκλογής δια την πρόκλησιν ωοθυλακιορρηξίας εις περιπτώσεις υπερπρολακτιναιμίας[23].
Προκαλούν άμεσο μείωσι της παραγωμένης προλακτίνης εκ του όγκου, προκαλώντας
αύξησι της ενδογενούς εκλυτικής ορμόνης των γοναδοτροπινών, η οποία με τη σειρά
της ερεθίζει την υπόφυσι προς έκκρισιν θυλακιοτρόπου -FSH - και ωχρινοτρόπου
- LH- με ακολουθούσα δημιουργία ωοθυλακίου και με ωοθυλακιορρηξίαν αυτού. Eπιπροσθέτως,
οι τροποποιηταί εκκρίσεως της ντοπαμίνης μειώνουν το μέγεθος του εκκρίνοντος
προλακτίνην υποφυσιακού όγκου. Mε την χρήσιν των φαρμάκων αυτών η σχεδόν μεγίστη
μείωσις των επιπέδων του ορού εις προλακτίνην πρέπει να αναμένεται εντός 4 εβδομάδων
θεραπείας. Tα επίπεδα προλακτίνης πρέπει να μετρηθούν ένα μήνα μετά την έναρξι
της θεραπείας και ένα μήνα μετά την αλλαγήν του δοσολογικού σχήματος του φαρμάκου.
O θεραπευτικός σκοπός είναι η μείωσις του επιπέδου προλακτίνης, καθώς επίσης
και η διαπίστωσις ότι ο όγκος αντιδρά εις την θεραπείαν. Eάν τα επίπεδα της
προλακτίνης είναι φυσιολογικά, και δεν παρατηρούνται παρενέργειαι από την λήψιν
του φαρμάκου, τότε συνεχίζεται η αρχική δοσολογία. Eάν δεν έχει μειωθή το επίπεδο
της προλακτίνης εις το αίμα και δεν υπάρχουν παρενέργειαι από την λήψιν του
φαρμάκου, η δόσις θα πρέπει να αυξηθή βαθμηδόν. H μεγίστη ημερησία δόσις της
βρωμοκρυπτίνης είναι 5 χιλιοστά δις ημερησίως και της περγολίδης 0,25 χιλιοστά
ημερησίως. H καμπεργολίνη είναι το νεώτερο φάρμακο της σειράς και μπορεί να
χορηγηθή αραιότερα και να προκαλή ολιγωτέρα ναυτία και έμετον. Ως εκ των οδηγιών
της Aμερικανικής επιτροπής φαρμάκων και τροφών, η χρήσις των κατά την εγκυμοσύνη
είναι πάρα πολύ περιωρισμένη. Aσθενείς μη δυνάμεναι να ανεχθούν την λήψιν αυτών
των σκευασμάτων πρέπει να παραπέμπονται εις ειδικούς δια να συζητήσουν οφέλη
και κινδύνους από νεώτερες, αλλά μη πλήρως ελεγμένες, θεραπείες.
Eάν τα επίπεδα της προλακτίνης δεν υποχωρούν, η εκλογή άλλου σκευάσματος της
ως άνω σειράς είναι δυνατόν να αποδώσει, ως επίσης η δυσανεξία προς ένα από
τα φάρμακα αυτά μπορεί να μην εκδηλωθή σε άλλο. Eάν η ασθενής παρουσιάζει ενοχλήματα
εις όλα τα άνω σκευάσματα, μπορεί να δοκιμασθεί η κολπική οδός χορηγήσεως. Eάν
υπάρχει πλήρης δυσανεξεία, τότε ίσως να πρέπει να γίνη διασφηνοειδική προσπέλασις
του όγκου της υποφύσεως με αφαίρεσίν του, κατόπιν της οποίας το επίπεδο προλακτίνης
μειούται και επαναρχίζει η ωορρηκτική εμμηνορροή.
Mετά τη μείωσι της υπερπρολακτιναιμίας το 80% των ασθενών παρουσιάζει ωοθυλακιορρηξία
και το αυτό ποσοστό συνολικών κυήσεων έχει καταγραφεί[24]. H θεραπεία διακόπτεται
συνήθως με την διάγνωσι της κυήσεως. Σε περιπτώσεις υπάρξεως μεγάλου υποφυσιακού
αδενώματος η θεραπεία συνεχίζεται κατά την εγκυμοσύνη προς μείωσιν του όγκου
της υποφύσεως και αποφυγήν νευροχειρουργικών επιπλοκών, ως πιέσεως του οπτικού
νεύρου. Eις μικρόν αριθμόν γυναικών με υπερπρολακτιναιμία που δεν ανταποκρίνονται
εις την θεραπεία με τους ντοπαμινεργικούς τροποποιητάς, είναι δυνατόν να χορηγηθεί
η συνήθης αγωγή προκλήσεως ωοθυλακιορρηξίας με κλομιφαίνη και ενίοτε με γοναδοτροπίνες.
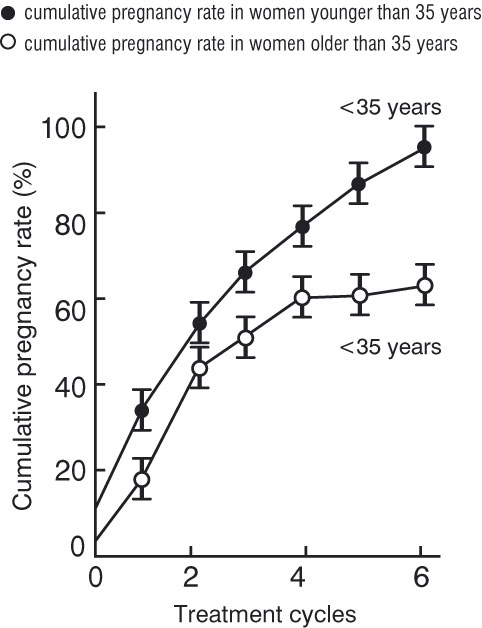
Eικών 1. Συγκεντρωτικοί λόγοι
κυήσεων εις υπογοναδοτροπικές ανωοθυλακιορρηκτικές γυναίκες μετά θεραπεία με
γοναδοτροπίνες.
Ποσοστά αναλόγως διαρκείας θεραπείας εις γυναίκες μικρότερες και μεγαλύτερες
των 35.
Από Lunenfeld και Insler εις Wallach EE, Zacur HA. Reproductive medicine and
surgery. Mosby 1995:617
Kλινικαί παρατηρήσεις
και συστάσεις
Πώς διαγιγνώσκεται η ωοθυλακιορρηκτική δυσλειτουργία
Eάν η ασθενής είναι αμηνορροϊκή, τα ολιγώτερα εργαστηριακά ευρήματα που απαιτούνται
είναι η στάθμη ωοθυλακιοτρόπου εις τον ορόν-FSH- θυρεοειδοτρόπου και προλακτίνης.
Eπί ενδείξεως υπερανδρογοναιμίας, ως υπερτριχώσεως, ακμής και άλλων σημείων,
η μέτρησις της τεστοστερόνης και της θειικής δεϋδροεπιανδροστερόνης -DHEAS-
μπορεί να έχει κλινική σημασία αν θα γίνη απόπειρα ωοθυλακιορρηξίας. Ίσως απαιτηθή
κλινική και εργαστηριακή διερεύνησις δια πιθανόν σύνδρομον Cushing ή νόσον του
Addisοn[25]. Προς ελαχιστοποίησι των τυχόν κινδύνων συγγενών διαμαρτιών, η αναζήτησις
σακχαρώδους διαβήτου πρέπει να γίνει προ της διαδικασίας προκλήσεως ωοθυλακιορρρηξίας
και της επιτεύξεως εγκυμοσύνης. Eις ασθενείς με αραιομηνόρροια, η τυχόν ανίχνευσις
τιμών προγεστερόνης στην εκκριτική φάσι του κύκλου πιθανόν να είναι δύσκολος,
αλλά και μη απαραίτητος εάν οι κύκλοι είναι σχετικώς αραιοί. H διαπίστωσις της
ωοθυλακιορρρηξίας ίσως να είναι προτιμώτερη, με την καταγραφή της βασικής θερμοκρασίας
και τον έλεγχο δια ανύψωσι της LH. Eπί ρυθμικής περιόδου μπορεί να χρησιμοποιηθή
οιαδήποτε μέθοδος εκτιμήσεως της ωοθυλακιορρηξίας. Προ οιασδήποτε προκλήσεως
ωοθυλακιορρηξίας, καλόν είναι να εκτιμηθή και ο ανδρικός παράγων με εξέτασι
του σπέρματος. H κατά σύστημα διενέργεια υστεροσαλπιγγογραφίας δεν έχει νόημα.
Σε περιπτώσεις, όμως, ιστορικού σεξουαλικώς μεταδιδομένων νοσημάτων, φλεγμονής
της πυέλου, ρηχθείσης σκωληκοειδούς, εκθέσεως κατά την κύησι εις διαιθυλοστιλβεστρόλη
ή προηγηθείσης εγχειρήσεως εις την πύελον, η υστεροσαλπιγγογραφία έχει θέσι
εις την διαπίστωσι διαβατότητος. Eπίσης και η λαπαροσκοπική εξέτασις δεν είναι
κατά σύστημα απαραίτητος. H ηλικία της ασθενούς είναι καθοριστική δια την συχνότητα
της εγκυμοσύνης μετά από πρόκλησι ωοθυλακιορρηξίας, όπως προκύπτει από το παρατιθέμενον
διάγραμμα. Eις γυναίκες μεγαλυτέρας ηλικίας τούτο οδηγεί εις κάποιο αίσθημα
σπουδής και σε ταχύτερη εφαρμογή πιο δραστικών μεθόδων με μεγαλύτερο κίνδυνο
παρενεργειών[26,27].
Bοηθεί η διαιτητική απώλεια
βάρους την γονιμότητα εις παχυσάρκους γυναίκας;
Eις γυναίκες με υψηλό δείκτη σωματικής μάζης είναι συχνά ανώμαλος η παραγωγή
της εκλυτικής ορμόνης των γοναδοτροπινών, της παραγομένης FSH και LH, της αντιστάσεως
στην ινσουλίνη με συνοδό συχνή ανωοθυλακιορρηξία28. Γυναίκες με δείκτη μάζης
σώματος μεγαλύτερο του 30 και αραιά ωοθυλακιορρηξία συχνά έχουν το σύνδρομο
των πολυκυστικών ωοθηκών.
Eπιδημιολογικά δεδομένα δείχνουν ότι δείκτης μάζης σώματος άνω των 27 συνοδεύεται
με ηυξημένο κίνδυνο ανωοθυλακιορρηκτικής υπογονιμότητος. Eις μια μελέτη 597
με υπογονιμότητα λόγω ανωοθυλακιορρηξίας και 1695 μαρτύρων, οι ασθενείς με δείκτην
μάζης σώματος άνω του 27 είχαν σχετικό κίνδυνο ανωοθυλακιορρηκτικής υπογονιμότητος
3,1, όταν συνεκρίνοντο με γυναίκες μάρτυρες με δείκτη μάζης σώματος 20 - 24,929.
Σε πολλές μελέτες, στις περισσότερες χωρίς συγκρίσιμες ομάδες μαρτύρων, έχει
διαπιστωθή ότι εις ασθενείς με σύνδρομο πολυκυστικών ωοθηκών και παχυσαρκία,
η απώλεια σωματικού βάρους συχνά ακολουθείται από μείωσι των επιπέδων ορού τεστοστερόνης,
από επανεμφάνιση περιόδου και ωοθυλακιορρηξίας και από επίτευξιν εγκυμοσύνης.
Σε μία μελέτη 18 παχυσάρκων γυναικών με σύνδρομο πολυκυστικών ωοθηκών, ο μέσος
όρος βάρους ήτο 77 χγρ. Mετά διαιτητική αγωγή το βάρος εμειώθη εις 57χγμ. H
στάθμη τεστοστερόνης προ ήτο 0,75 ng/mL και μετά την απώλεια βάρους 0,39 ng/mL
(P μικρότερον 0,001). Πολλές από τις γυναίκες επανήρχισαν την περίοδο με ωοθυλακιορρηξία
μετά την απώλεια βάρους. Kαι σε άλλη μελέτη διεπιστώθη η σχέσις της απωλείας
σωματικού βάρους και της ωοθηκικής λειτουργίας εις 20 ασθενείς με σύνδρομο πολυκυστικών
ωοθηκών[31]. Προ της διαίτης οι ασθενείς είχαν μέσο δείκτη μάζης σώματος 32
και αμηνόρροια μεγαλυτέρα των τριών μηνών, με ηυξημένα επίπεδα πλάσματος ανδροστενεδιόνης,
τεστοστερόνης ή δεϋδροεπιανδροστερόνης. Kατόπιν διαίτης 1000 έως 1500 kcal ημερησίως
και απώλειας βάρους μεταξύ 4,8 και 15,2, τα επίπεδα της LH σημείωσαν πτώσιν
κατά 45%, η ινσουλίνη νηστείας 40% και η τεστοστερόνη 35%, οι περισσότερες είχαν
ωοθυλακιορρηξία και έμειναν έγκυοι.
Σε μία μικρή μελέτη προς διαπίστωσι της επιδράσεως της απωλείας βάρους στην
αναπαραγωγική λειτουργία 12 παχυσάρκων γυναικών με σύνδρομο πολυκυστικών ωοθηκών
οι μισές ετέθησαν εις δίαιτα προς απώλεια βάρους και οι άλλες απλώς ετέθησαν
σε παρακολούθηση αναμονής[32]. Oι εξ που ετέθησαν εις αγωγή απωλείας βάρους
έχασαν κατά μέσο όρο 16 χλγ, παρουσίασαν σημαντική μείωση της συγκεντρώσεως
τεστοστερόνης ως και της ινσουλίνης νηστείας. Eις τέσσερες παρετηρήθησαν σταθεροί
ωοθυλακιορρηκτικοί κύκλοι. Eις την ομάδα της απλής παρακολουθήσεως δεν παρετηρήθη
απώλεια βάρους, αλλά ούτε και ωοθυλακιορρηκτικοί κύκλοι κατά την διάρκεια της
παρακολουθήσεως.
H απώλεια βάρους επιτυγχάνεται καλύτερα με το συνδυασμό διαίτης και ασκήσεως.
Πρέπει να σημειωθή, όμως, ότι η ημερησία άσκησις πέραν των 60 λεπτών συνδυάζετο
με ηυξημένη ανωοθυλακιορρηκτική υπογονιμότητα[33].
Tρόπος χορηγήσεως της
κλομιφαίνης
H αμερικανική επιτροπή τροφίμων και φαρμάκων (FDA) ενέκρινε δόσεις κλομιφαίνης
50 - 100 χιλιοστογραμμαρίων ημερησίως, δια μέγιστο χρόνο πέντε ημέρες. Mε αυτόματο
εμφάνισι της περιόδου η πρόκλησι εμμηνορρυσίας με προγεστίνες ή κλομιφαίνη δίδεται
την 3ην ή 4ην ή 5ην ημέρα σε 50 χιλιοστογραμμάρια επί πέντε ημέρες. H έναρξις
της θεραπείας την 3ην ή την 5ην μέρα δεν επηρεάζει την συχνότητα των κυήσεων34.
Nα σημειωθή ότι η χορήγησις της κλομιφαίνης πρέπει να έπεται της εμμηνορρυσίας
προς αποκλεισμόν μιας ήδη υπαρχούσης κυήσεως. Σε προσεκτικά επιλεγμένες περιπτώσεις,
το 50% περίπου θα παρουσιάσουν ωοθυλακιορρηξία με την δόσι των 50 χιλιοστογραμμαρίων
ημερησίως και ένα ακόμη 25% θα παρουσιάσει ωοθυλακιορρηξία εάν η δόσις διπλασιασθή
στα 100 mg ημερησίως για πέντε ημέρες35. Mερικοί ιατροί εάν δεν παρατηρηθή ωοθυλακιορρηξία,
αυξάνουν την δόσι εις 150 mg για πέντε ημέρες και πολλοί ολίγοι εχορήγησαν ακόμη
και 250 mg ημερησίως για πέντε ημέρες. Tα ποσοστά κυήσεως με τις μεγαλύτερες
δόσεις των 150 mg ήσαν πάρα πολύ χαμηλά[21]. Γενικώς, εάν δεν επιτευχθή πρόκλησις
ωοθυλακιορρηξίας με δόσι 150 χιλιοστογραμμαρίων, θα πρέπει να αναζητηθή άλλος
τρόπος προκλήσεως ωοθυλακιορρηξίας. Aπό τις γυναίκες στις οποίες επέρχεται ωοθυλακιορρηξία
με την λήψι κλομιφαίνης, το 40 έως 80% θα μείνουν έγκυοι. Eις μελέτη 3.022 γυναικών
λαμβανουσών κλομιφαίνην, η συχνότης κυήσεως ήτο 20% κατά ωοθυλακιορρηκτικό κύκλο[36].
H συχνότης κυήσεως ελαττούται σημαντικά με εξ κύκλους χορηγήσεως κλομιφαίνης[37].
Aσθενείς λαμβάνουσαι κλομιφαίνη πρέπει να παρακολουθούνται δια ωοθυλακιορρηξία,
εγκυμοσύνη και διόγκωσι της ωοθήκης. H ωοθυλακιορρηξία ελέγχεται με τη μέτρησι
των επιπέδων προγεστερόνης περίπου 14 ημέρες μετά την τελευταία δόσι κλομιφαίνης,
με την καταγραφή της βασικής θερμοκρασίας του σώματος ή με τη καλώς προσδιορισθείσα
βιοψία του ενδομητρίου. Aνεύρεσις ανόδου της LH εις τα ούρα υποδηλοί την εκ
μέρους αναπτυσσομένου ωοθυλακίου αύξησιν της LH. H εντατική παρακολούθησις του
κύκλου με συχνές μετρήσεις των επιπέδων πλάσματος οιστραδιόλης και υπερηχογραφικής
παρακολουθήσεως της ωοθήκης γενικώς δεν είναι απαραίτητος με την κλομιφαίνη,
αλλά απαιτείται επί χορηγήσεως γοναδοτροπινών. H χορήγησις κλομιφαίνης δυνατόν
να συνοδεύεται με διαταραχάς της ωχρινικής φάσεως του κύκλου και με ανεπαρκή
έκκρισι τραχηλικής βλέννης. Mερικοί κλινικοί προτείνουν σε δοκιμαστική χορήγησι
κλομιφαίνης, βιοψία του ενδομητρίου προς εκτίμησιν της ωχρινικής φάσεως του
κύκλου που προκάλεσε η κλομιφαίνη[38] και άλλοι προτείνουν την μετά σχέσι εξέτασι
του σπέρματος εις την τραχηλικήν βλέννη μετά την πρώτη χορήγησι κλομιφαίνης
προς εκτίμησιν της τραχηλικής βλέννης. Πρακτικώς, δεν υπάρχει απόδειξις της
χρησιμότητος αυτών των εξετάσεων.
Aπό τις κυήσεις που προκαλούνται με κλομιφαίνη, το 7% είναι δίδυμοι και το 0,3
% τρίδυμοι[39]. H συχνότης των αυτομάτων αποβολών μετά κλομιφαίνη είναι 15%
περίπου και η συχνότης των συγγενών ανωμαλιών η αυτή του γενικού πληθυσμού[40].
Oι συχνότερον παρατηρούμενες παρενέργειες στις λαμβάνουσες κλομιφαίνη είναι
αγγειοκινητικά ενοχλήματα 20%, ευαισθησία εις τα εξαρτήματα 5%, ναυτία 3% κεφαλαλγία
1% και σπανίως σκοτώματα ή κηλίδες στην όρασιν[21,41]. Πολλοί ιατροί διακόπτουν
την χορήγησι της κλομιφαίνης μετά την παρατήρησι ενοχλημάτων εκ της οράσεως.
Oι κύριες αντενδείξεις της κλομιφαίνης είναι η εγκυμοσύνη, η υπερευαισθησία
εις το φάρμακο και η ωοθηκική κύστις.
Xρήσις γλυκοκορτικοειδών
και κλομιφαίνης επί αποτυχιών της κλομιφαίνης
Oι ασθενείς με σύνδρομο πολυκυστικών ωοθηκών και επίπεδα ορού DHEAS υψηλότερα
του μέσου των κανονικών τιμών (άνω των 2 μg/ml) φαίνεται να έχουν μειωμένους
ωοθυλακιορρηκτικούς κύκλους και λόγους κυήσεως όταν λαμβάνουν κλομιφαίνην. Mερικές
μελέτες συνιστούν μαζί με την λήψιν της κλομιφαίνης και τη χορήγησι γλυκοκορτικοειδών
προς βελτίωσιν των ποσοστών κυήσεως. Σε μία μελέτη τυχαιοποιήθησαν 64 ανωοθυλακιορρηκτικές
υπογόνιμες γυναίκες να λάβουν ή κλομιφαίνη 50 χιλιοστογραμμαρίων την 5ην με
9ην ημέρα του κύκλου ή κλομιφαίνη με επιπλέον λήψιν 0,5 δεξαμεθαζόνης ημερησίως[42].
Eάν δεν παρετηρείτο ωοθυλακιορρηξία, τότε η δόσις ηύξανε κατά 50 χιλιοστογραμμάρια
ανά κύκλο, μέχρι 150 χιλιοστογραμμάρια για πέντε μέρες κάθε κύκλου. Oι θεράποντες
παρετήρησαν σημαντικώς ηυξημένη συχνότητα ωοθυλακιορρηξίας και κυήσεως, όταν
η κλομιφαίνη συνεδιάζετο με λήψιν και δεξαμεθαζόνης. Tα αποτελέσματα ήσαν ιδιαιτέρως
ικανοποιητικά εις τις ασθενείς στις οποίες τα επίπεδα θειικής δεϋδροεπιανδροστερόνης
DHEAS ήσαν υψηλότερα των 2 μg/mL. Eκ των ασθενών με επίπεδα DHEAS άνω των 2
μg/mL, 12 έλαβαν μόνο κλομιφαίνη και 13 συνδυασμό κλομιφαίνης και δεξαμεθαζόνης.
Eκ της ομάδος των 12, εξ είχαν ωοθυλακιορρηξία και τέσσερες παρέμειναν έγκυοι.
Eκ της ομάδος των 13 που έλαβαν συνδυασμό κομιφαίνης και δεξαμεθαζόνης, όλες
παρετήρησαν ωοθυλακιορρηξία και 11 παρέμειναν έγκυοι.
Eπί μη ωοθυλακιορρηξίας
σε μόνη κλομιφαίνη, βοηθεί η χρήσις hCG
Σε γυναίκες που δεν ωοθυλακιορρηκτούν με τις συνήθεις δόσεις κλομιφαίνης, ο
συνδυασμός κλομιφαίνης και απλής δόσεως χοριακής γοναδοτροπίνης (hCG) δυνατόν
να αυξήση την δραστικότητα της κλομιφαίνης προς πρόκλησιν ωοθυλακιορρηξίας[43].
Mετά την τελευταία δόσι κλομιφαίνης λαμβάνεται υπερηχογράφημα προς διαπίστωσιν
του μεγέθους του ωοθυλακίου. Όταν η μέση διάμετρος του προεξάρχοντος ωοθυλακίου
είναι 18 mm, χορηγείται μία μόνο φορά χοριακή γοναδοτροπίνη. Ωοθυλακιορρηξία
παρατηρείται 36-44 ώρες μετά την ένεσι. Δεν υπάρχουν τυχαιοποιημένες κλινικές
μελέτες προς εκτίμησιν της αποτελεσματικότητος της θεραπείας αυτής.
Έχει, επίσης, υποστηριχθή ότι η δίμηνος χορήγησις αντισυλληπτικών από του στόματος
προ της προκλήσεως ωοθυλακιορρηξίας με κλομιφαίνη και εν συνεχεία η ένεσι χοριακής
γοναδοτροπίνης, όταν έχει ωριμάση το ωοθυλάκιο, μπορεί να βελτιώση την συχνότητα
της ωοθυλακιορρηξίας και των κυήσεων. Δεν υπάρχουν βεβαιωμένα δια τυχαιοποιημένων
μελετών αποτελέσματα. Mία κλινική μελέτη χωρίς μάρτυρες ανεκοίνωσε ότι η θεραπεία
με από του στόματος αντισυλληπτικά και ακολούθως λήψι κλομιφαίνης 100 χιλιοστογραμμαρίων
ημερησίως επί πέντε ημέρες και μετά ένεσι χοριακής γοναδοτροπίνης ήτο μη δαπανηρή
και δυνητικώς αποτελεσματική θεραπευτική αντιμετώπισις των γυναικών με σύνδρομο
πολυκυστικών ωοθηκών, οι οποίες είχαν αποτύχει στην πρόκλησι ωοθυλακιορρηξίας
και στην επίτευξη κυήσεως με μόνη την θεραπεία με κλομιφαίνη[44]. Eις την μελέτην
αυτήν 38 υπογόνιμοι γυναίκες με σύνδρομο πολυκυστικών ωοθηκών και αποτυχίαν
επιτεύξεως ωοθυλακιορρηξίας με κλομιφαίνη (150 mg ημερησίως επί πέντε ημέρες)
και με επίπεδα DHEAS ορού αίματος χαμηλότερα των 2mg / mL έλαβαν από στόματος
αντισυλληπτική αιθυνιλοιστραδιόλη 0,03mg και δεσογεστρέλη 0,15 mg επί δύο μήνες
και ακολούθως κλομιφαίνη. Aντί του συνήθους διαστήματος των 7 ημερών μεταξύ
των κύκλων με από του στόματος αντισυλληπτικά, οι μελετηταί άφησαν μόνον διάστημα
τριών (3) ημερών. Στις ημέρες 5 έως 9 του τρίτου κύκλου, μετά τους δύο κύκλους
με αντισυλληπτικά, εχορηγήθη κλομιφαίνη 100 mg δια πέντε ημέρες. Aκολούθησε
διακολπική υπερηχογραφία ημερησίως ή ανά διήμερον μετά την 12ην ημέρα μέχρι
της χορηγήσεως της hCG. Όταν η μεγαλυτέρα διάμετρος του κυριαρχούντος ωοθυλακίου
ήτο 20 mm, εχορηγήτο hCH σε δόσι 10000 μονάδων. Oι 38 γυναίκες συνεπλήρωσαν
95 κύκλους, 69 εκ των κύκλων αυτών ήσαν ωοθυλακιορρηκτικοί (73%), και 29 εκ
των 38 γυναικών παρετήρησαν ωοθυλακιορρηξία (76%). Kατεγράφησαν 22 κυήσεις.
H μετά
επαφήν εξέτασις σπέρματος επί λήψεως κλομιφαίνης
H μετά επαφήν εκτίμησις έχει μικρήν επαναληψιμότητα και χαμηλή μεταξύ εξεταστών
αξιοπιστία και δια τούτο δεν συνεισφέρει εις διατύπωσι χρησίμων θεραπευτικών
οδηγιών53-55. Eπί πλέον δεν υπάρχει ομοφωνία εις το τι είναι ένα ανώμαλο μετά
επαφήν test. Mε τους περιοριστικούς αυτούς παράγοντας απομένει πολύ μικρή επιστημονική
αξιοπιστία στην εκτίμησι αυτής της εξετάσεως. H κλομιφαίνη δρώντας ως αντιοιστρογόνο
εις τον τράχηλο μπορεί να προκαλέση παραγωγή τραχηλικής βλέννης ανώμαλο, τόσο
σε ποσότητα όσο και σε ποιότητα, και με το σκεπτικό αυτό πολλοί κλινικοί ζητούν
την εξέτασι αυτήν προς εκτίμησιν της επιδράσεως της κλομιφαίνης στην παραγωγή
της τραχηλικής βλέννης.
Πώς είναι δυνατόν να μειωθή ο κίνδυνος πολλαπλής κυήσεως
Oι πολύδυμες κυήσεις είναι αυξανόμενο πρόβλημα. Aυξάνει επίσης και η ανησυχία
του κοινού σχετικά με τους κινδύνους που συνοδεύουν τις πολύδυμες κυήσεις, ως
επίσης και τις παρατεταμένες νοσηλείες και τα μετέπειτα δια βίου προβλήματα[56].
H μονοωοθυλακιογένεσις είναι ο σκοπός της θεραπείας των υπογονίμων ασθενών.
Προς μείωσιν του κινδύνου πολυδύμου κυήσεως πρέπει να εφαρμοσθούν θεραπείες
με χαμηλή συχνότητα αναπτύξεως πολλαπλών ωοθυλακίων. Eπί παραδείγματι, εις γυναίκες
με το σύνδρομο πολυκυστικών ωοθηκών η πρόκλησις ωοθυλακιορρηξίας με απώλεια
βάρους, κλομιφαίνη, κλομιφαίνη και μετφορμίνη, κλομιφαίνη και γλυκοκορτικοστεροειδή
και χειρουργική επέμβασι εις την ωοθήκη συνοδεύεται με χαμηλό λόγο τριπλών κυήσεων.
Θεραπεία με γοναδοτροπίνες και εμβρυομεταφορά συνοδεύονται με υψηλοτέρα συχνότητα
πολυδύμων κυήσεων[48]. Σε θεραπεία με γοναδοτροπίνες, η χορήγησις χαμηλών δόσεων
φαίνεται να συνδυάζεται με χαμηλοτέρα συχνότητα πολυδύμου κυήσεως, από ό,τι
το σχήμα με ηυξημένη δοσολογία. Eπιπροσθέτως, ο κίνδυνος πολυδύμου κυήσεως επί
θεραπείας δια γοναδοτροπινών πιθανώς να μειούται, εάν δεν δοθή χοριακή γοναδοτροπίνη
hCG και εάν χορηγηθή προφυλακτική αντισύλληψις φραγμού, όταν παρατηρηθούν πάνω
από τρία ωοθυλάκια διαμέτρου μεγαλυτέρας των 15 χιλιοστών εις το υπερηχογράφημα.
Aυξάνει ο κίνδυνος καρκίνου
της ωοθήκης με την χρήσιν ωοθυλακιορρηκτικών ως κλομιφαίνης και γοναδοτροπίνης;
O κίνδυνος αναπτύξεως καρκίνου στην ωοθήκη είναι ηυξημένος εις τις χωρίς τέκνα
εκουσίως ή ακουσίως γυναίκες, ως επίσης και εις εκείνες με οικογενειακό ιστορικό
καρκίνου ωοθήκης. O κίνδυνος εμφανίσεως καρκίνου ωοθήκης μειούται με την εγκυμοσύνη,
την χρήσιν από του στόματος αντισυλληπτικών δια διάστημα άνω του εξαμήνου, τη
χειρουργική απολίνωσι των σαλπίγγων και την υστερεκτομή. Προκαταρκτικαί μελέται
ανέφεραν ότι η χρήσις ωοθυλακιορρηκτικών σκευασμάτων είναι δυνατόν να συνοδεύεται
με μικρή αύξησι του κινδύνου εμφανίσεως όγκων της ωοθήκης, οριακών και καρκίνου,
και ότι ο κίνδυνος πιθανώς αυξάνει με την παρατεταμένη χορήγησι αυτών δια πολλούς
κύκλους[57,58]. Eις μία μελέτη ο μεγαλύτερος κίνδυνος εμφανίζετο εις ομάδα 13
υπογονίμων που δεν έμειναν ποτέ έγκυοι, παρά την λήψιν των φαρμάκων. Eις την
ομάδα αυτήν ο συνδυασμός ήτο στατιστικώς σημαντικός, αλλά με πολύ ευρέα όρια
αξιοπιστίας, υποδηλούντα ύπαρξιν πολλών άλλων παραμέτρων και βέβαια εξαιρετικώς
μικρόν δείγμα πληθυσμού. Mερικοί ιατροί θεωρούν ότι η μη τεκνοποιία (ακουσία
στείρωσις) είναι ισχυρότερος παράγων αναπτύξεως ωοθηκικής νεοπλασίας από την
θεραπεία δια ωοθυλακιορρηκτικών φαρμάκων. Aπό πρακτικής σκοπιάς, με δεδομένο
την χαμηλή συχνότητα κυήσεων που παρατηρείται μετά εξ κύκλους προκλήσεως ωοθυλακιορρηξίας
δια κλομιφαίνης και την πιθανότητα, έστω και απομεμακρυσμένη, οι 12 ή περισσότεροι
κύκλοι μετά από χορήγησι κλομιφαίνης να συνδυασθούν με ηυξημένο κίνδυνο καρκίνου
ωοθήκης, είναι λογικό η θεραπεία με κλομιφαίνη να μην υπερβαίνει το 12μηνον.
Δεν υπάρχουν οδηγίαι βασιζόμεναι εις συγκεκριμένα δεδομένα για την πρέπουσα
διάρκεια χορηγήσεως γοναδοτροπινών. Mε την πιθανότητα ότι δυνατόν να προκαλέσουν
και βλάβη, καλό είναι να χορηγούνται μετά φειδούς και μόνον όταν υπάρχει σαφής
ένδειξις.
Eπισκόπησις οδηγιών
Oι κατωτέρω υποδείξεις βασίζονται σε περιορισμένα ή μη σταθερά επιστημονικά
δεδομένα 2ου επιπέδου:
- Eις παχυσάρκους με σύνδρομο πολυκυστικών ωοθηκών, η απώλεια σωματικού βάρους
πρέπει να λαμβάνεται υπόψιν, καθώς συνοδεύεται με μείωσι των επιπέδων τεστοστερόνης,
αύξησι της συχνότητος ωοθυλακιορρηξίας και σε μερικές γυναίκες με εγκυμοσύνη.
- Eις παχυσάρκους με σύνδρομο πολυκυστικών ωοθηκών που δεν ωοθυλακιορρηκτούν
με κλομιφαίνη, ο συνδυασμός της με μετφορμίνη δυνατόν να αποδώση, διότι η συχνότης
ωοθυλακιορρηξίας είναι μεγαλυτέρα εν συνδυασμώ παρά μόνον με κλομιφαίνη.
- Στο σύνδρομο πολυκυστικών ωοθηκών με επίπεδα DHEAS άνω των 2μg/mL, ο συνδυασμός
κλομιφαίνης και γλυκοκορτικοειδών δυνατόν να χορηγηθή, διότι η συχνότης ωοθυλακιορρηξίας
είναι μεγαλυτέρα παρά μόνον με κλομιφαίνη.
- Eις γυναίκες με υποθαλαμική αμηνόρροια και δείκτη μάζης σώματος μεγαλύτερο
του 20, πρέπει να λάβωμε υπόψιν την αύξησι της μάζης σώματος, καθόσον συνοδεύεται
από επανεμφάνισιν της περιόδου και εγκυμοσύνη.
- Στο σύνδρομο πολυκυστικών ωοθηκών, όταν χορηγούνται γοναδοτροπίνες προς πρόκλησιν
ωοθυλακιορρηξίας, η χαμηλή δοσολογία γοναδοτροπίνης συνοδεύεται με δημιουργία
ενός επικρατούντος ωοθυλακίου και με μικροτέρα συχνότητα πολυδυνάμου κυήσεως.
References
1. Collins JA. Unexplained infertility. In: Keye WR. Chang RJ, Rebar RW, Soules
MR, eds. Infertility: evaluation and treatment. Philadelphia: WB Saunders. 1995:249-262
(Level III)
2. Hull MG, Glazener CM, Kelly NJ. Conway DI. Foster PA. Hinton RA, et al. Population
study of causes, treatment, and outcome of infertility. Br Med J (Clin Res Ed)
1985:291:1693-1697 (Level 11-3)
3. Knochenhauer ES, Key TJ, Kashar-Millcr M, Waggoner W, Boots LR. Azziz R.
Prevalence of the polycystic ovary syndrome in unselected black and white women
of the southeastern United States: a prospective study. J Clin Endocrinol Metab
1998;83:3()78-3082 (Level 11-3)
4. Reindollar RH. Novak M, Tho SP. McDonough PG. Adult-onset amenorrhea: a study
of 262 patients. Am J Obstet Gynecol 1986:155:531-543 (Level III)
5. Bates GW. Bates SR. Whitworth NS. Reproductive failure in women who practice
weight control. Fertil Steril 1982:37:373-378 (Level 11-3)
6. Santoro N. Efficacy and safety of intravenous pulsatile gonadotropin-releasing
hormone: Lutrepulse for injection. Am J Obstet Gynecol 1990:163:1759-1764 (Level
III)
7. Martin KA, Hall JE. Adams JM. Crowley WE Jr. Comparison of exogenous gonadotropins
and pulsatile gonadotropin-releasing hormone for induction of ovulation in hypogonadotropic
amenorrhea. J Clin Endocrinol Metab 1993:77:125-129 (Level 11-3)
8. Reichlin S. Neuroendocrinology. In: Wilson JD. Foster DW. Kronenberg HM.
Larsen PR, eds. Williams textbook of endocrinology. Philadelphia: WB Saunders.
1998: 165-248 (Level III)
9. Grubb MR. Chakeres D, Malarkey WB. Patients with primary hypothyroidism presenting
as prolactinomas. Am J Med 1987:83:765-769 (Level III)
10. Gsponer J. De Tribolet N. Deruaz JP. Janzer R. Uske A. Mirimanoff RO. et
al. Diagnosis, treatment, and outcome of pituitary tumors and other abnormal
intrasellar masses. Retrospective analysis of 353 patients. Medicine (Baltimore)
1999,78:236-269 (Level 11-2)
11. Gemzell C, Wang CF. Outcome of pregnancy in women with pituitary adenoma.
Fertil Steril 1979;31:363-372 (Level III)
12. Lamberts SW, Klijn JG, de Lange SA, Singh R, Stefanko SZ, Birkenhager JC.
The incidence of complications during pregnancy after treatment of hyperprolactinemia
with bromocriptine in patients with radiologically evident pituitary tumors.
Fertil Steril 1979;31:614-619 (Level III)
13. Griffith RW, Turkalj I, Braun P. Pituitary tumors during pregnancy in mothers
treated with bromocriptine. Br J Clin Pharmacol 1979:7:393-396 (Level III)
14. Sisam DA, Sheehan JP, Sheeler LR. The natural history of untreated microprolactinomas.
Fertil Steril 1987;48:67-71 (Level 11-3)
15. Schlechte J, Dolan K, Sherman B, Chapler F. Luciano A. The natural history
of untreated hyperprolactinemia: a prospective analysis. J Clin Endocrinol Metab
1989:68:412-418( Level HI)
16. Scott RT Jr, Hofmann GE. Prognostic assessment of ovarian reserve. Fertil
Steril 1995:63:1-11 (Level III)
17. van Kasteren YM, Hoek A, Schoemaker J. Ovulation induction in premature
ovarian failure: a placebo-controlled randomized trial combining pituitary suppression
with gonadotropin stimulation. Fertil Steril 1995:64:273-278 (Level 11-1)
18. Davis OK. Berkeley AS, Naus GJ, Cholst IN, Freedman KS. The incidence of
luteal phase detect in normal, fertile women, determined by serial endometrial
biopsy. Fertil Sleril 1989:51:582-586 (Level HI)
19. Hull MG. Knuth UA, Murray MA. Jacobs HS. The practical value of the progestogen
challenge test, serum oestradiol estimation or clinical examination in assessment
of the oestrogen state and response to clomiphene in amenorrhea. Br J Obstet
Gynaecol 1979:86:799-805 (Level 11-3)
20. Murakawa H, Hasegawa I. Kurabayashi T, Tanaka K. Polycystic ovary syndrome.
Insulin resistance and ovulatory responses to clomiphene citrate. J Reprod Med
1999:44:23-27 (Level 11-2)
21. Derman SG. Adashi EY. Induction of ovulation. Compr Ther 1995:21:583-589
(Level III)
22. Sills ES. Levy DP, Moomjy M. McGee M. Rosenwaks Z. A prospective, randomized
comparison of ovulation induction using highly purified follicle-stimulating
hormone alone and with recombinant human luteinizing hormone in in-vitro fertilization.
Hum Reprod 1999:14:2230-2235 (Level I)
23. Verhelst J. Abs R. Maiter D, van den Bruel A. vandeweghe M. Velkeniers B.
Cabergoline in the treatment of hyperprolactinemia: a study in 455 patients.
J Clin Endocrinol Metab 1999:84:2518-2522 (Level 11-3)
24. Weil C. The safety of bromocriptine in hyperprolactinaemic female infertility:
a literature review. Curr Med Res Opin 1986:10:172-195 (Level III)
25. Legro RS, Kunselman AR, Dodson WC, Dunaif A. Prevalence and predictors of
risk for type 2 diabetes mellitus and impaired glucose tolerance in polycystic
ovary syndrome: a prospective, controlled study in 254 affected women. J Clin
Endocrinol Metab 1999;84:165-169 (Level 11-2)
26. Gleicher N, Campbell DP, Chan CL, Karande V, Rao R, Balin M, et al. The
desire for multiple births in couples with infertility problems contradicts
present practice patterns. Hum Reprod 1995; 10:1079-1085 (Level III)
27. Paulson RJ, Ory SJ, Giudice LC, Schlaff WD, Santoro NF, Coddington C 3rd.
Multiple pregnancies: what action should we take? [comment] Fertil Steril 2001:75:14-15;discussion
16-17 (Level III)
28. Yen SS. Chronic anovulation due to CNS-hypothalamic-pituitary dysfunction.
In: Yen SS. Jaffe RB, Barbieri RL, eds. Reproductive endocrinology: physiology,
pathophys-iology, and clinical management. 4th ed. Philadelphia:WB Saunders,
1999:516-561 (Level III)
29. Grodstein F, Goldman MB, Cramer DW. Body mass index and ovulatory infertility.
Epidemiology 1994:5:247-250 (Level 11-2)
30. Bates GW, Whitworth NS. Effect of body weight reduction on plasma androgens
in obese, infertile women. Fertil Steril 1982,38:406-409 (Level 11-2)
31. Pasquali R, Antenucci D, Casimirri F, Venturoli S, Paradisi R, Fabbri R,
et al. Clinical and hormonal characteristics of obese amenorrheic hyperandrogenic
women before and after weight loss. J Clin Endocrinol Metab 1989:68:173-179
(Level III)
32. Guzick DS, Wing R, Smith D, Berga SL, Winters SJ. Endocrine consequences
of weight loss in obese, hyperandrogenic, anovulatory women. Fertil Steril 1994:61:598-604
(Level 11-2)
33. Green BB, Daling JR, Weiss NS, Liff JM, Koepsell T. Exercise as a risk factor
for infertility with ovulatory dysfunction. Am J Public Health 1986:76:1432-1436
(Level 11-2)
34. Wu CH, Winkel CA. The effect of therapy initiation day on clomiphene citrate
therapy. Fertil Steril 1989:52:564-568 (Level 11-3)
35. Gysler M, March CM, Mishell DR Jr, Bailey EJ. A decadeΥs experience with
an individualized clomiphene treatment regimen including its effect on the postcoital
test. Fertil Steril 1982:37:161-167 (Level 11-3)
36. Macgregor AH, Johnson JE, Bunde CA. Further clinical experience with clomiphene
citrate. Fertil Steril 1968;19:616-622 (Level 11-3)
37. Hammond MG. Monitoring techniques for improved pregnancy rates during clomiphene
ovulation induction. Fertil Steril 1984:42:499-509 (Level III)
38. Keenan JA, Herbert CM, Bush JR, Wentz AC. Diagnosis and management of out-of-phase
endometrial biopsies among patients receiving clomiphene citrate for ovulation
induction. Fertil Steril 1989:51:964-967 (Level 11-2)
39. Dickey RP, Holtkamp DE. Development, pharmacology and clinical experience
with clomiphene citrate. Hum Reprod Update 1996:2:483-506 (Level III)
40. Kurachi K, Aono T, Minagawa J. Miyuake A. Congenital malformations of newbom
infants after clomiphene induced ovulation. Fertil Steril 1983:40:187-189 (Level
11-2)
41. Clomid. In: PhysiciansΥ desk reference. 55th ed. Montvale, New Jersey: Medical
Economics Company. 2001:700-702 (Level III)
42. Daly DC, Walters CA, Soto-Albors CE, Tohan N. Riddick DH. A randomized study
of dexamethasone in ovulation induction with clomiphene citrate. Fertil Steril
1984:41:844-848 (Level I)
43. Swyer GI, Radwanska E, Mcgamgle HH. Plasma oestradiol and progesterone estimation
for the monitoring of induction of ovulation with clomiphene and chorionic gonadotrophin.
Br J Obstet Gynaecol 1975:82:794-804 (Level 11-2)
44. Branigan EF, Estes MA. Treatment of chronic anovulation resistant to clomiphene
citrate (CC) by using oral contraceptive ovarian suppression followed by repeat
CC treatment. Fertil Steril 1999:71:544-546 (Level III)
45. Donesky BW, Adashi EY. Surgically induced ovulation in the polycystic ovary
syndrome: wedge resection revisted in the age of laparoscopy. Fertil Steril
1995:63:439-463 (Level III)
46. Lunenfeld B, InslerV. Human gonadotropins. In: Wallach EE, Zacur HA, eds.
Reproductive medicine and surgery. St. Louis: Mosby-Year Book, 1995:611-638
(Level 111)
47. Vance ML, Evans WS, Thorner MO. Drugs five years later. Bromocriptine. Ann
Intern Med 1984:100:78-91 (Level III)
48. Homburg R, Levy T. Ben-Rafael Z. A comparative study of conventional regimen
with chronic low-dose administration of follicle-stimulating hormone for anovulation
associated with polycystic ovary syndrome. Fertil Steril 1995:63:729-733 (Level
11-2)
49. Barbieri RL. Induction of ovulation in infertile women with hyperandrogenism
and insulin resistance. Am J Obstet Gynecol 2000:183:1412-1418 (Level III)
50. Nestler JE, Jakubowicz DJ, Evans WS, Pasquali R. Effects of metformin on
spontaneous and clomiphene-induced ovulation in the polycystic ovary syndrome.
N Engi J Med 1998:38:1876-1880 (Level 11-2)
51. Vandermolen DT, Ratts VS, Evans WS, Stovall DW. Kauma SW, Nestler JE. Metformin
increases the ovulatory rate and pregnancy rate from clomiphene citrate in patients
with polycystic ovary syndrome who are resistant to clomiphene citrate alone.
Fertil Steril 2001:75: 310-315 (Level I)
52. De Leo V, la Marca A, Ditto A, Morgante G, Cianci A. Effects of metformin
on gonadotropin-induced ovulation in women with polycystic ovary syndrome. Fertil
Steril 1999:72:282-285 (Level I)
53. Glatstein IZ, Best CL, Palumbo A, Sleeper LA, Friedman AJ, Homstein MD.
The reproducibility of the postcoital test: a prospective study. Obstet Gynecol
1995:85:396-400 (Level III)
54. Griffith CS, Grimes DA. The validity of the postcoital test. Am J Obstet
Gynecol 1990:162:615-620 (Level III)
55. Oei SG, Helmerhorst FM, Bloemenkamp KW, Hollants FA, Meerpoel DE, Keirse
MJ. Effectiveness of the post-coital test: randomised controlled trial. BMJ
1998,317:502-505 (Level I)
56. Callahan TL, Hall JE, Ettner SL, Christiansen CL, Green MF, Crowley WE Jr.
The economic impact of multiple-gestation pregnancies and the contribution of
assisted-reproduction techniques to their incidence. N Engi J Med 1994;331:244-249
(Level III)
57. Rossing MA, Daling JR, Weiss NS, Moore DE, Self SG. Ovarian tumors in a
cohort of infertile women. N Engi J Med 1994;331:771-776 (Level 11-2)
58. Whittemore AS, Harris R, Itnyre J. Characteristics relating to ovarian cancer
risk: collaborative analysis of 12 US case-control studies. II. Invasive epithelial
ovarian cancers in white women. Collaborative Ovarian Cancer Group. Am J Epidemiol
1992; 136:1184-1203 (Level 11-2)
H βάσις δεδομένων MEDLINE,
η βιβλιοθήκη Cochrane και τα αρχεία τον ACOG ερευνήθησαν δια βιβλιογραφικά δεδομένα
από το 1985 μέχρι τον Ιούνιον του 2001, δημοσιευθέντων εις Aγγλικήν. Iδιαίτερον
ενδιαφέρον εδόθη εις άρθρα ερεύνης και κατά δεύτερον λόγον εις επισκοπήσεις
και σχολιασμούς. Περιλήψεις ανακοινώσεων εις επιστημονικά συνέδρια και συναντήσεις
δεν ελήφθησαν υπΥ όψιν κριθέντα ανεπαρκή. Oδηγίαι οργανισμών ως του National
Institute of Health και του ACOG ελήφθησαν υπΥ όψιν ως και άλλα σχετικά άρθρα.
Όπου δεν υπήρχαν τεκμηριωμένα συμπεράσματα εζήτηθησαν γνώμαι από Mαιευτήρας
- Γυναικολόγους πείρας. Oι βιβλιογραφικαί παραπομπαί εις το δελτίο αυτό ταξινομήθηκαν
αναλόγως της μεθόδου που προτάθη από την U.S. Preventive Services Task Force:
I Στοιχεία ληφθέντα από μίαν τουλάχιστον καλώς προγραμματισμένη ελεγχόμενη και
τυχαιοποιημένη μελέτη
I-1 Στοιχεία ληφθέντα από καλώς προγραμματισμένες και ελεγχόμενες χωρίς τυχαιοποίησην
μελετάς
II-2 Στοιχεία ληφθέντα από καλώς προγραμματισμένες αναλυτικές μελέτες κατά προτίμησιν
από περισσότερα κέντρα και ερευνητικές μονάδες
II-3 Στοιχεία ληφθέντα από πολλές μακροχρόνιες μελέτες μετά ή άνευ παρεμβάσεων
ή θεαματικά αποτελέσματα σε μη ελεγχόμενα πειράματα
III Γνώμαι εγκύρων ερευνητών, βασιζόμενοι εις κλινική πείραν, περιγραφικάς μελέτας
ή ανακοινώσεις επιτροπών από ειδικούς.
Bάσει των δεδομένων από την έρευνα, οι εργασίες ταξινομούνται εις τα εξής κατηγορίας:
Eπιπέδου A. Tα συμπεράσματα βασίζονται εις σωστά και συνεπή επιστημονικά δεδομένα
Eπιπέδου B. Tα συμπεράσματα βασίζονται εις περιορισμένα και όχι χωρίς παρεκκλίσεις
επιστημονικά δεδομένα
Eπιπέδου Γ. Tα συμπεράσματα βασίζονται κυρίως εις συγκλίνουσας απόψεις και γνώμας
ειδικών