
ΣΤΡΟΓΓΥΛΟ ΤΡΑΠΕΖΙ
ΓΛΥΚΟΚΟΡΤΙΚΟΕΙΔΗ
ΚΑΙ ΑΥΤΟΑΝΟΣΑ
ΝΟΣΗΜΑΤΑ
Φ. Ψύχου
Tα κορτικοειδή που παράγονται από το φλοιό των επινεφριδίων έχουν γλυκοκορτικοειδή, αλατοκορτικοειδή ή ανδρογόνο δράση. Επειδή η αντιφλεγμονώδης δράση είναι παράλληλη με τη γλυκοκορτικοειδή, η επιτροπή της ΕULAR (European League Against Rheumatism), που ασχολείται με τα κορτικοειδή, συνέστησε το 2001 τη χρήση του γενικού όρου γλυκοκορτικοειδή για τα συνθετικά σκευάσματα κορτικοειδών που χρησιμοποιούνται ως αντιφλεγμονώδη ή ανοσοκατασταλτικά φάρμακα. Τα γλυκοκορτικοειδή "δεν ανήκουν" σε καμία ιατρική ειδικότητα, συνταγογραφούνται, όμως, ως ισχυρότατοι αντιφλεγμονώδεις και ανοσοκατασταλτικοί παράγοντες, συχνότερα από τους ρευματολόγους και τους ασχολούμενους με αυτοάνοσα νοσήματα. Εξάλλου, σε ρευματικό νόσημα δόθηκαν για πρώτη φορά θεραπευτικά.
Ιστορική
αναδρομή
Στη δεκαετία του '20 συνδυάζονται εύστοχα κλινικές παρατηρήσεις και διατυπώνεται
η άποψη ότι η ρευματοειδής αρθρίτιδα οφείλεται σε ανεπάρκεια ορμόνης των επινεφριδίων.
Η δυσλειτουργία του άξονα υποθάλαμος - υπόφυση - επινεφρίδια στη ρευματοειδή
αρθρίτιδα αποδείχθηκε το 1992, ήδη όμως, το 1948, ο Hench χορήγησε κορτιζόλη
σε μέλος του προσωπικού του εργαστηρίου του που έπασχε από ρευματοειδή αρθρίτιδα.
Τα αποτελέσματα ήταν τόσο εντυπωσιακά ώστε ακόμη και η επιτροπή απονομής του
βραβείου Nobel ξέχασε την παραδοσιακή επιφυλακτικότητά της και απένειμε το βραβείο
Nobel Ιατρικής του 1950 στους Kendall, Reichstein και Hench για τις ανακαλύψεις
τους για τη δομή και βιολογική δράση των ορμονών του φλοιού των επινεφριδίων.
Tο 1956 γίνεται και η πρώτη αναφορά χορήγησης γλυκοκορτικοειδούς στη νεανική
ρευματοειδή αρθρίτιδα.
Σύντομα, όμως, γίνεται αντιληπτό ότι οι ανεπιθύμητες ενέργειες των γλυκοκορτικοειδών
είναι σοβαρές και ότι στη ρευματοειδή αρθρίτιδα απαιτείται συνεχής θεραπεία
με υψηλές δόσεις για τη διατήρηση της ύφεσης, χωρίς να αποτρέπεται πάντα η καταστροφή
των αρθρώσεων και η αναπηρία. Έτσι, στη δεκαετία του '60 τα γλυκοκορτικοειδή
αποκλείονται από τη θεραπεία της ρευματοειδούς αρθρίτιδας, περιλαμβάνονται,
όμως, στη θεραπεία άλλων αυτoάνοσων νοσημάτων με θανατηφόρα, συνήθως την εποχή
εκείνη, έκβαση και κυρίως του συστηματικού ερυθηματώδους λύκου (ΣΕΛ) και των
αγγειιτίδων. Σήμερα, 50 περίπου χρόνια από την πρώτη χορήγησή τους σε ρευματικό
νόσημα, οι γνώσεις μας για τα γλυκοκορτικοειδή διαφαίνονται από τα παρακάτω.
Σε συμπόσιο που οργανώθηκε από την ΕULAR το 2001, διατυπώθηκε η άποψη ότι η
επιλογή των θεραπευτικών σχημάτων γλυκοκορτικοειδών και οι δοσολογικές προτιμήσεις
σε συγκεκριμένες κλινικές ενδείξεις είναι σε ελάχιστες μόνο περιπτώσεις τεκμηριωμένες.
Στην πραγματικότητα, όπως φαίνεται από τη διάσταση στις θέσεις ομιλητών συμποσίου
που οργανώθηκε από το American College of Rheumatology (ACR) το 2002 (πίνακας
1), δεν έχει ακόμη συμφωνηθεί η ανάγκη χορήγησης έστω και μικρής δόσης γλυκοκορτικοειδούς
στη ρευματοειδή αρθρίτιδα, το συχνότερο ρευματικό νόσημα των ενηλίκων. Επόμενο
είναι η κατάσταση να είναι πλέον συγκεχυμένη στην Παιδιατρική Ρευματολογία που
διαχειρίζεται μικρό αριθμό ασθενών. Στη συνέχεια, όπου δεν υπάρχουν στοιχεία
για τα παιδιά, θα χρησιμοποιηθούν δεδομένα από τη θεραπευτική των ενηλίκων.
Γενικά
περί γλυκοκορτικοειδών
Tα γλυκοκορτικοειδή είναι ο ισχυρότερος αντιφλεγμονώδης και ανοσοκατασταλτικός
παράγοντας που διαθέτουμε. Δρουν στο δίκτυο των κυτοκινών και ενζύμων που μετέχουν
στην πορεία της φλεγμονής, επηρεάζουν τα προσκολλητικά μόρια, τη διαπερατότητα
των αγγείων, τη λειτουργία ή και την επιβίωση βασικών κυττάρων του ανοσιακού
συστήματος, όπως τα Τ και Β λεμφοκύτταρα και τα μακροφάγα (πίνακας 2).
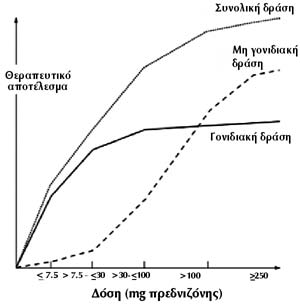
Για λόγους συνεννόησης και εκτίμησης των διαφόρων σχημάτων χορήγησης γλυκοκορτικοειδών,
η EULAR όρισε ως χαμηλή δόση γλυκοκορτικοειδούς τη δόση που αντιστοιχεί σε ή
κάτω από 7,5mg πρεδνιζόνης/24ωρο, ως μέση δόση: >7,5mg και <_30mg πρεδνιζόνης/24ωρο,
υψηλή δόση: >30mg και <_100mg πρεδνιζόνης/24ωρο, πολύ υψηλή δόση: >100mg
πρεδνιζόνης/24ωρο και τέλος, ώσεις >_250mg πρεδνιζόνης/24ωρο για ένα ή περισσότερα,
συνήθως λιγότερα από πέντε, εικοσιτετράωρα. Ο ορισμός αυτός βασίσθηκε στη σχέση
δόσης γλυκοκορτικοειδούς και μηχανισμού δράσης, η οποία φαίνεται στο σχήμα 1.
Είναι σαφές ότι μέχρι τα 30mg πρεδνιζόνης υπάρχει σχεδόν μόνο γονιδιακή δράση,
η οποία φθάνει στο μέγιστο στα 100mg και μετά σχηματίζει plateau. Αντίθετα,
η μη γονιδιακή δράση ανεβαίνει κατακόρυφα από τα 30mg και συνεχίζει την ίδια
πορεία και μετά τη δόση των 100mg.
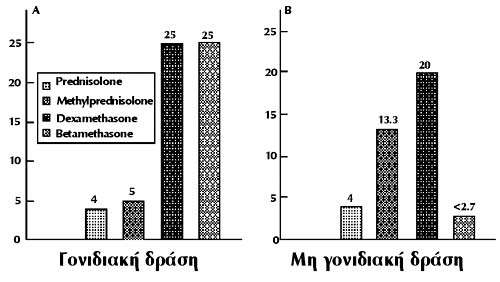
Τα σκευάσματα γλυκοκορτικοειδών διαφέρουν στην αναλογία γονιδιακής και μη γονιδιακής
δράσης. Η γνωστή σε όλους ισοδυναμία πρεδνιζολόνης / μεθυλπρεδνιζολόνης / δεξαμεθαζόνης
/ βηταμεθαζόνης 4/5/25/25 αντιστοιχεί στη γονιδιακή δράση, ενώ η δραστικότητα
όσο αφορά στη μη γονιδιακή δράση είναι, όπως φαίνεται στο σχήμα 2, διαφορετική.
Αν λάβει κανείς υπόψη ότι η μη γονιδιακή δράση υπερτερεί στις υψηλές δόσεις,
γίνεται κατανοητό γιατί για τη θεραπεία με ώσεις έχουν επιλεγεί κυρίως η μεθυλπρεδνιζολόνη
και μερικές φορές η δεξαμεθαζόνη.


ΣΧΗΜΑ 1. σχέση δόσης γλυκοκορτικοειδούς
και μηχανισμού δράσης
ΣΧΗΜΑ 2. Σκευάσματα γλυκοκορτικοειδών και μηχανισμός δράσης




Γενικές
αρχές συνταγογράφησης γλυκοκορτικοειδών
Από τα παραπάνω γίνεται σαφές ότι η διαχείριση των γλυκοκορτικοειδών πρέπει
να γίνεται με σεβασμό, ιδιαίτερα αν λάβει κανείς υπόψη ότι ουσιαστικά αποτελούν
συνθετική έκδοση ορμονών του οργανισμού μας. Πρέπει να συνταγογραφούνται με
συγκεκριμένες ενδείξεις και πάντα με γνώμονα τη σχέση κόστος/όφελος, γιατί η
ανοσοκατασταλτική και αντιφλεγμονώ δης δράση, αλλά και η συχνότητα ανεπιθύμητων
ενεργειών, είναι δοσοεξαρτώμενες.
Καλύτερο θεραπευτικό αποτέλεσμα έχουν τα σχήματα καθημερινής χορήγησης και η
μοιρασμένη ημερήσια δόση και λιγότερες ανεπιθύμητες ενέργειες, σε βάρος της
θεραπευτικής εμβέλειας, τα παρήμερα σχήματα και η μία ημερήσια δόση το πρωί.
Σοβαρές ανεπιθύμητες ενέργειες παρατηρούνται συνήθως σε χρόνια χορήγηση φαρμακολογικών
δόσεων γλυκοκορτικοειδών και σπανιότερα στις χαμηλές δόσεις και τα βραχυχρόνια
σχήματα. Αυτό καταφαίνεται από τα παρακάτω: 1. Ψύχωση εμφανίζουν 1,6% όσων αντιμετωπίζονται
με ημερήσια δόση πρεδνιζόνης <20mg/kg, 57%, όμως, όσων λαμβάνουν πρεδνιζόνη
σε δόση >100mg/kg/24ωρο. 2. Οστεονέκρωση παρατηρείται σε <3% όσων λαμβάνουν
γλυκοκορτικοειδή σε δόση υποκατάστασης και σχετικά σπάνια όταν η ημερήσια δόση
πρεδνιζόνης είναι <20mg. Η ημερήσια δόση, η συνολική δόση και η διάρκεια
θεραπείας πρέπει συνεπώς να είναι οι ελάχιστες δυνατές που επιτρέπουν έλεγχο
της νόσου. Η συχνότητα λοίμωξης αυξάνει όταν η ημερήσια δόση πρεδνιζόνης είναι
>_10mg, η συνολική δόση >700mg και η διάρκεια χορήγησης >3-4 εβδομάδες.
Η μέση δόση πρεδνιζόνης με την οποία έχει παρατηρηθεί οπίσθιος υποκαψικός καταρράκτης
είναι 10mg/24ωρο επί 12 μήνες, ενώ η ελάχιστη 5mg/24ωρο επί 2 μήνες.
Το γεγονός ότι η θεραπεία με γλυκοκορτικοειδή προκαλεί σημαντικές ανεπιθύμητες
ενέργειες παρακινεί, δικαιολογημένα, σε γρήγορη ελάττωση της χορηγούμενης δόσης
που, όμως, συνήθως αποδεικνύεται άστοχη γιατί συχνά συνοδεύεται από αναζωπύρωση
της νόσου για την οποία συνταγογραφούνται, ανάγκη νέας αύξησης της δόσης (κατά
25-50%) και δημιουργία φαύλου κύκλου. Όπως και το αρχικό θεραπευτικό σχήμα,
η προσπάθεια μείωσης της δόσης εξατομικεύεται, προσαρμόζεται στο πρόβλημα του
συγκεκριμένου ασθενούς και πρέπει να γίνεται αργά, με συνεχή κλινικοεργαστηριακή
παρακολούθηση.
Η διακοπή χρόνιας θεραπείας με γλυκοκορτικοειδή πρέπει να γίνεται βαθμιαία και
για την αποφυγή οξείας επινεφριδιακής ανεπάρκειας λόγω της καταστολής του άξονα
υποθάλαμος υπόφυση - επινεφρίδια που παρατηρείται στη χρόνια χορήγηση γλυκοκορτικοειδών.
Στη συνταγογράφηση πρέπει να λαμβάνονται υπόψη και άλλοι παράγοντες που αφορούν
στα ίδια τα γλυκοκορτικοειδή, τον ασθενή αλλά και την υπόλοιπη θεραπεία, δηλαδή
η φαρμακοκινητική των διαφόρων γλυκοκορτικοειδικών σκευασμάτων, η επίδραση της
υποκείμενης νόσου στη φαρμακοκινητική των γλυκοκορτικοειδών και η αλληλεπίδραση
των γλυκοκορτικοειδών και άλλων φαρμάκων.
Η κάθαρση της πρεδνιζολόνης είναι χαμηλότερη τις πρωινές ώρες, κατά 33% υψηλότερη
στα παιδιά ηλικίας <12 χρόνων και αυξάνει, κατά 75%, με αύξηση της δόσης
από τα 5 στα 40mg, παραμένοντας στη συνέχεια σταθερή.
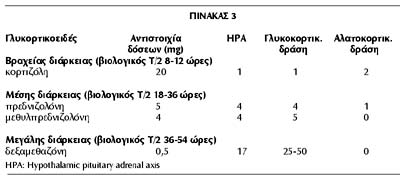
Για την αντιμετώπιση των αυτοάνοσων νοσημάτων απαιτείται συχνά χρόνια χορήγηση
γλυκοκορτικοειδών. Γι αυτό χρησιμοποιούμε σκεύασμα μέσης διάρκειας δράσης με
μικρή αλατοκορτικοειδή δράση, συνήθως την πρεδνιζολόνη, την πρεδνιζόνη ή τη
μεθυλπρεδνιζολόνη, όποιο μάς είναι προσιτό και περισσότερο οικείο (πίνακας 3).
Επιλέγουμε τον τρόπο χορήγησης ανάλογα με τη βαρύτητα και το είδος του προβλήματος
που αντιμετωπίζουμε. Προτιμάμε τις τοπικές θεραπείες όταν το θεραπευτικό αποτέλεσμα
είναι αποδεκτό (πίνακας 4).
Πολλά αυτοάνοσα νοσήματα είναι βαρύτατα συστηματικά νοσήματα, στα οποία επηρεάζεται
η λειτουργία διαφόρων οργάνων με αντίκτυπο στη φαρμακοκινητική των γλυκοκορτικοειδών.
Η κάθαρση της πρεδνιζολόνης είναι κατά 58% αυξημένη στους ασθενείς με υπερθυρεοειδισμό.
Σε βαριά ηπατική νόσο παρεμποδίζεται η μετατροπή της ανενεργού πρεδνιζόνης στην
ενεργό πρεδνιζολόνη, γεγονός που μπορεί να επηρεάσει την αποτελεσματικότητα
της θεραπείας με το σκεύασμα αυτό. Το νεφρωσικό σύνδρομο και η νεφρική ανεπάρκεια
σε κάθαρση, επηρεάζουν με διάφορους τρόπους τη φαρμακοκινητική των γλυκοκορτικοειδών,
δεν φαίνεται, όμως, να απαιτούν διαφορετική δοσολογία. Στους παχύσαρκους, καίτοι
τα αποτελέσματα των μέχρι τώρα μελετών δίνουν αντικρουόμενα αποτελέσματα, φαίνεται
ότι η δόση πρέπει να υπολογίζεται με βάση το ιδανικό βάρος.
Τα γλυκοκορτικοειδή χρησιμοποιούνται στους ασθενείς με αυτοάνοσα νοσήματα σε
συνδυασμό συνήθως με άλλα φάρμακα. Είναι ευτυχής συγκυρία το γεγονός ότι τα
φάρμακα τα οποία φαίνονται στον πίνακα 5 και τα οποία συνταγογραφούνται συχνά
στους ασθενείς με αυτοάνοσα νοσήματα, δεν επηρεάζουν σημαντικά τη φαρμακοκινητική
των γλυκοκορτικοειδών, άλλα, όμως, όπως αυτά του πίνακα 6, ελαττώνουν τη στάθμη
των γλυκοκορτικοειδών αυξάνοντας την κάθαρση ή ελαττώνοντας την απορρόφησή τους
και άλλα, όπως αυτά του πίνακα 7, αυξάνουν τη στάθμη τους, αναστέλλοντας τα
ένζυμα που τα μεταβολίζουν ή ελαττώνοντας την κάθαρσή τους. Κλινικής σημασίας
θεωρούνται μεταβολές στάθμης μεγαλύτερες του 30%.
Από τα παραπάνω διαφαίνεται ότι σωστό είναι στην αντιμετώπιση των αυτοανόσων
νοσημάτων, τουλάχιστον αυτών που έχουν βαριά προβολή, να γίνεται θεραπευτική
παρέμβαση με σημαντική δόση γλυκορτικοειδούς σε μοιρασμένες δόσεις, ώστε να
επιτευχθεί τάχιστα το μέγιστο θεραπευτικό αποτέλεσμα και στη συνέχεια να επιχειρείται
σταδιακή μείωση των δόσεων με ταχύτητα ανάλογη της δόσης, αλλά και της βαρύτητας
του νοσήματος. Εάν η πιθανότητα υποτροπής με τη διακοπή των γλυκοκορτικοειδών
είναι απαράδεκτα υψηλή και η φυσική ιστορία της νόσου κακή, πρέπει να γίνεται
εγκαίρως προσθήκη και άλλου ή άλλων ανοσοτροποποιητικών φαρμάκων, ώστε να έχει
επιτευχθεί θεραπευτική δράση κατά τη διακοπή των γλυκοκορτικοειδών.
Σε ελαφρά νόσηση ή όταν απαιτείται θεραπεία συντήρησης, προτιμούνται μέση ή
χαμηλή δόση χορηγούμενη όλη το πρωί ή παρήμερα σχήματα. Θα πρέπει, πάντως, να
επισημανθεί ότι τα παρήμερα σχήματα δεν είναι εξίσου αποτελεσματικά στη διατήρηση
της ύφεσης, τουλάχιστον στα βαριάς πρόγνωσης ρευματικά νοσήματα.
Για παράδειγμα στο ΣΕΛ, το κατ΄ εξοχήν νόσημα στο οποίο συνταγογραφούνται τα
γλυκοκορτικοειδή, χορηγούνται αρχικά, ανάλογα με τη βαρύτητα του προβλήματος,
IV ώσεις μεθυλπρεδνιζολόνης 30mg/kg/ώση επί 1-5 ημέρες, ή πρεδνιζόνη peros σε
δόση 15-60mg/24ωρο. Η αρχική δόση διατηρείται συνήθως επί 3-4 εβδομάδες. Η μείωση
γίνεται με ταχύτητα ανάλογη της αρχικής δόσης: κατά 2,5-5mg κάθε εβδομάδα σε
ημερήσιες δόσεις των 20-60mg, 1-2,5mg την εβδομάδα (μέση μείωση 2,5mg/2-4 εβδομάδες)
σε ημερήσιες δόσεις των 10-20mg και 0,5-1mg/2-4 εβδομάδες σε ημερήσιες δόσεις
<10mg. Τα παρήμερα σχήματα, παρά τις λιγότερες ανεπιθύμητες ενέργειες, δεν
παρέχουν ικανοποιητική ανοσοκαταστολή και πρέπει να αποφεύγονται στους ασθενείς
με βαρύ ΣΕΛ, μπορεί να χρησιμοποιηθούν, όμως, σε όσους χρειάζονται ημερήσιες
δόσεις <10mg. Η συνολική διάρκεια χορήγησης των γλυκοκορτικοειδών στους ασθενείς
με ΣΕΛ είναι δύσκολο να οριστεί. Σπάνια διακόπτονται τα πρώτα δύσκολα χρόνια
μετά τη διάγνωση, μερικά μάλιστα παιδιά χρειάζονται μια πολύ μικρή δόση συντήρησης
επί μακρό χρονικό διάστημα για τη διατήρηση της ύφεσης.
Είναι αδύνατο να αναλυθεί η χρήση των γλυκοκορτικοειδών σε όλα τα αυτοάνοσα
νοσήματα, γι΄αυτό θα περιορισθούμε σε ορισμένες βασικές αρχές.
Δεν χορηγούμε συστηματικά γλυκοκορτικοειδή στις αυτοάνοσες ενδοκρινοπάθειες,
με εξαίρεση τη νόσο Addison, το αντιφωσφολιπιδικό σύνδρομο που αντιμετωπίζεται
με αντιπηκτική αγωγή, τη μονοαρθρική ιδιοπαθή νεανική αρθρίτιδα στην οποία τα
γλυκοκορτικοειδή χορηγούνται ενδαρθρικά, την ψωριασική αρθρίτιδα διότι κατά
τη διακοπή τους προκαλείται συχνά έξαρση της ψωρίασης, την αγκυλοποιητική σπονδυλίτιδα,
τις ήπιες κυτταροπενίες και τις αρθρικές και βλεννοδερματικές εκδηλώσεις του
ΣΕΛ, που αντιμετωπίζονται ικανοποιητικά με άλλα φάρμακα ή τοπική αγωγή.
Μικρή δόση γλυκοκορτικοειδών (συνήθως 0,1-0,2mg/kg/24ωρο), σε συνδυασμό πάντα
με άλλο τροποποιητικό της νόσου φάρμακο, χρησιμοποιούμε στην πολυαρθρική ιδιοπαθή
νεανική αρθρίτιδα, μόνη ή σε συνδυασμό με αζαθειοπρίνη στην αυτοάνοση ηπατίτιδα,
ως δόση συντήρησης στο ΣΕΛ, στα αρχικά στάδια και για την αντιμετώπιση της μυοσίτιδας
στη σκληροδερμία.
Μεγάλες δόσεις κορτικοειδών (πρεδνιζόνη 1mg/kg/24ωρο) χρησιμοποιούνται στη συστηματική
μορφή ιδιοπαθούς νεανικής αρθρίτιδας, στο ΣΕΛ (σπειραματονεφρίτιδα, προσβολή
ΚΝΣ, βαριά αιμολυτική αναιμία), κλασικά στη δερματομυοσίτιδα και τις αγγειίτιδες.
Τις μεγαδόσεις χρησιμοποιούμε σε βαριά, ταχέως εξελισσόμενη ή απειλητική για
τη ζωή νόσο, για την αντιμετώπιση της οποίας εκτιμούμε ότι χρειάζονται υψηλές
δόσεις γλυκοκορτικοειδών. Με τη μέθοδο αυτή επιτυγχάνουμε άμεσο αποτέλεσμα με
μικρή μακροχρόνια τοξικότητα. Σκεύασμα εκλογής είναι η μεθυλπρεδνιζολόνη σε
δόση συνήθως 30mg/kg/ώση. Υπάρχουν διάφορα πρωτόκολλα χορήγησης ώσεων, μιας
ώσης/μήνα, τριών ώσεων/μήνα, που χορηγούνται σε τρεις συνεχείς ημέρες ή σε παρήμερο
σχήμα.
Μεγαδόσεις συνήθως χρησιμοποιούμε στη συστηματική μορφή ιδιοπαθούς νεανικής
αρθρίτιδας και ιδιαίτερα στη βαριά επιπλοκή της, στο σύνδρομο ενεργοποίησης
μακροφάγου, στο ΣΕΛ (σε προσβολή του ΚΝΣ, σπειραματονεφρίτιδα, οξεία αιμόλυση
και στον οξύ ΣΕΛ), στη δερματομυοσίτιδα που προβάλλει με σοβαρή μυϊκή αδυναμία
ή αγγειίτιδα του πεπτικού. Οι ώσεις μεθυλπρεδνιζολόνης αποτελούν θεραπεία εκλογής
της οπτικής νευρίτιδας και αποδεκτό θεραπευτικό μέτρο στο καταστροφικό αντιφωσφολιπιδικό
σύνδρομο, την επαπειλούσα την όραση ραγοειδίτιδα και την ταχέως εξελισσόμενη
οφθαλμοπάθεια Graves. Τέλος, τελευταία προτείνονται στην ανθεκτική στην κλασική
θεραπεία νεφρίτιδα Henoch Schonlein και στη νόσο Kawasaki (μετά από αποτυχημένη
επαναχορήγηση γ-σφαιρίνης σε δόση 2mg/kg/24ωρο) υπό τη μορφή 3 καθημερινών ώσεων
μεθυλπρεδνιζολόνης σε δόση 30 mg/kg/ώση.
Οι ώσεις δεν είναι χωρίς ανεπιθύμητες ενέργειες. Συνηθέστερες είναι η υπεργλυκαιμία,
οι καρδιακές αρρυθμίες ή η υπερτασική κρίση στη διάρκεια της έγχυσης. Προϋπόθεση
για τη χορήγηση ώσεων είναι η ομοιοστασία ύδατος και ηλεκτρολυτών. Αντένδειξη
είναι η υπέρταση, ενώ η ουραιμία και η προϋπάρχουσα ψύχωση αποτελούν σχετικές
αντενδείξεις.
Βιβλιογραφία
Ansell BM, Bywaters EGL, Isdale IC. Comparison of cortisone and aspirin in the
treatment of juvenile rheumatoid arthritis. BMJ 1956; 1:1.075-7.
Ansell BM. Overview of the side effects of cocrticosteroid therapy. Clin Exp
Rheumatol 1991; 9:19-20.
Buttgereit F, Wehling M, Burmester GR. A new hypothesis of modular glucocorticoid
actions. Steroid treatment of rheumatic diseases revisited. Arthritis Rheum
1998; 41:761-7.
Buttgereit F, Da Silva JAP, Boers M et al. Standardised nomenclature for glucocοrticoid
dosages and glucocorticoid treatment regimens: current questions and tentative
answers in rheumatology. Ann Rheum Dis 2002; 61:718-22.
Chrousos GA, Kattah JC, Beck RW, Cleary PA. Side effects of glucocοrticoid treatment.
Experience of the Optic Neuritis Treatment Trial. JAMA 1993; 269:2.110-12.
Dixon RB, Christy NP. On the various forms of corticosteroid withdrawal syndrome.
Am J Med 1980; 68:224-30.
Evans P, Walker RF, Peters JR et al. Anticonvulsant therapy and cortisol elimination.
Br J Clin Pharmacol 1985; 20:129-32.
Lewis DA, Smith RE. Steroid induced psychiatric syndromes. J Affective Disord
1983; 5:319-32.
Loeb JN. Corticosteroids and growth. N Engl J Med 1976; 295:547-52.
Frey FJ, Horber FF, Frey BM. Altered metabolism and decreased efficacy of prednisone
and prednisolone in patients with hyperthyroidism. Clin Pharmacol Ther 1988;
44:510-21.
Keenan PA, Jacobson MW, Soleymani RM et al. The effect on memory of chronic
prednisone treatment in patients with systemic disease. Neurology 1996; 47:1.396-402.
Klein-Gitelman MS, Pachman LM. Intravenous corticosteroids. Adverse effects
are more variable than expected in children. J Rheumatol 1998; 25:1.995-2.002.
Lubkin VL. Steroid cataract - a review and conclusion. J Asthma Res 1997; 14:55.
Μiller JJ III. Prolonged use of large intravenous steroid pulses in the rheumatic
diseases of children. Pediatrics 1980; 65:989-94.
Milsap RL, Plaisance KI, Jusko WJ. Prednisolone disposition in obese men. Clin
Pharmacol Ther 1984; 36:824-31.
Myles AB, Schiller LF, Glass D, Daly JR. Single daily dose of corticosteroid
treatment. Ann Rheum Dis 1976; 35:73.
Nelson AM, Conn DL. Glucocοrticoids in rheumatic disease. Mayo Clin Proc 1980;
55:758-69.
Padeh S, Passwell JH. Intra-articular corticosteroid injection in the management
of children with chronic arthritis. Arthritis Rheum 1998; 41:1.210-14.
Prieur AM. The place of corticosteroid therapy in juvenile chronic arthritis
in 1992. J Rheumatol 1993; 20(S7):32-34.
Rae SA, Williams IA, English J et al. Alteration of plasma prednisolone kinetics
by indomethacin and naproxen. Br J Clin Pharmacol 1982; 14:459-61.
Renner E, Horber FF, Jost G et al. Effect of liver function on the metabolism
of prednisone and prednisolone in humans. Gastroenterology 1986; 90:819-28.
Saag KG, Koehnke R, Caldwell JR et al. Low dose long term corticosteroid therapy
in rheumatoid arthritis: An analysis of serious adverse events. Am J Med 1994;
96:115-23.
Sambrook PN. Corticosteroid induced osteoporosis. J Rheumatol 1996; 23(S45):19-22.
Sherlock JE, Letteri JM. Effect of hemodialysis on methylprednisolone plasma
levels. Nephron 1977; 18:208-11.
Stuck AE, Minder CE, Frey FJ. Risk of infectious complications in patients taking
glucocorticosteroids. Rev Infect Dis 1989; 11:954-63.
White KP, Driscoll MS, Rothe MJ et al. Severe adverse cardiovascular effects
of pulse steroid therapy: Ιs continuous cardiac monitoring necessary? J Am Acad
Dermatol 1994; 30(5Pt1):768-73.