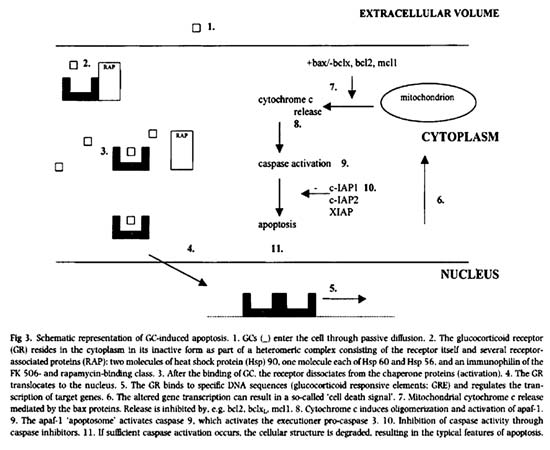
Σχημα 1. Μηχανισμός δράσης των κορτικοειδών μέσω των υποδοχέων τους και ο κυτταρικός θάνατος (απόπτωση)
ΣΤΡΟΓΓΥΛΟ ΤΡΑΠΕΖΙ
Η
ΧΡΗΣΗ ΤΩΝ ΚΟΡΤΙΚΟΕΙΔΩΝ
ΣΤΗΝ ΠΑΙΔΙΑΤΡΙΚΗ ΟΓΚΟΛΟΓΙΑ
Μ. Μοσχόβη
Τα κορτικοειδή χρησιμοποιούνται
κατά πολλούς τρόπους στην παιδιατρική ογκολογία. Έχουν έντονη λεμφολυτική δράση
διότι προάγουν την απόπτωση, δηλαδή το θάνατο του λεμφοκυττάρου. Ας δούμε, όμως,
πώς γίνεται η κυτταρολυτική δράση των κορτικοειδών στο λεμφοκύτταρο. Τα κορτικοειδή
είναι λιπόφιλα μόρια μικρού μοριακού βάρους και η είσοδός τους στο λεμφοκύτταρο
γίνεται με παθητική διάχυση. Όταν μπαίνουν στο κυτταρόπλασμα συνδέονται με τους
υποδοχείς των κορτικοειδών. Οι υποδοχείς βρίσκονται στο κυτταρόπλασμα με την
ανενεργό μορφή τους, συνδεδεμένοι με πρωτεΐνες RAP (receptor-associated proteins).
Οι πρωτεΐνες εξασφαλίζουν σταθεροποίηση των υποδοχέων στο κυτταρόπλασμα και
αύξηση της δέσμευσης των κορτικοειδών. Μόλις τα κορτικοειδή συνδεθούν με τον
υποδοχέα, οι πρωτεΐνες απομακρύνονται, μετατρέποντας τον ανενεργό υποδοχέα σε
ενεργό. Ο ενεργοποιημένος υποδοχέας εισέρχεται στον πυρήνα όπου συνδέεται με
συγκεκριμένες περιοχές του DNA, προκαλώντας αλλαγή σε μεταγραφικούς γόνους.
Έτσι παράγεται ένα "σήμα κυτταρικού θανάτου" που δρα στα μιτοχόνδρια
εκλύοντας το κυτόχρωμα C, με την επίδραση του Bax και bcl2. Το κυτόχρωμα C με
τη σειρά του ενεργοποιεί την κασπάση 9 και το κύτταρο οδηγείται σε θάνατο, δηλαδή
σε απόπτωση (κυτταρικός θάνατος, σχήμα 1).
Η προαγωγή της απόπτωσης έχει ως αποτέλεσμα την καταστροφή όχι μόνον των κακοήθων
λεμφοκυττάρων αλλά και των "φυσιολογικών" λεμφοκυττάρων και κατά συνέπεια
βλάπτεται και η λειτουργία του ανοσολογικού συστήματος, ιδιαίτερα των Τ και
Β λεμφοκυττάρων, των μακροφάγων και δενδριτικών κυττάρων. Η λεμφολυτική δράση
των κορτικοειδών διαπιστώνεται και σε μη κακοήθη νοσήματα, όπως η σηψαιμία και
η λοιμώδης μονοπυρήνωση. Λεμφοπενία παρατηρείται κατά τη διάρκεια σηψαιμίας,
από την αυξημένη ενδογενή παραγωγή των κορτικοειδών, λόγω του στρες του οργανισμού.
Στη λοιμώδη μονοπυρήνωση, χορηγούνται κορτικοειδή για να αντιμετωπισθεί η μεγάλη
διόγκωση των λεμφαδένων όταν προκαλούν μηχανικό κώλυμα στην αναπνοή. Η διόγκωση
βελτιώνεται ταχύτατα με τα κορτικοειδή, λόγω της έντονης λεμφολυτικής τους δράσης.
Εκτός από τα "φυσιολογικά" λεμφοκύτταρα, έντονη κυτταρολυτική δράση
παρατηρείται και στα βλαστικά κύτταρα της λεμφικής σειράς, γι' αυτό τα κορτικοειδή
αποτελούν άριστο χημειοθεραπευτικό σε κακοήθη νοσήματα της λεμφικής σειράς.
Αντίθετα, δεν έχουν καταστροφική δράση σε νεοπλασματικά κύτταρα συμπαγών όγκων,
διότι αναστέλλουν την απόπτωση, δηλαδή την καταστροφή των νεοπλασματικών κυττάρων,
ενώ σε μερικές περιπτώσεις μπορεί να ευνοούν και τον πολλαπλασιασμό των νεοπλασματικών
κυττάρων.
Τα κορτικοειδή ασκούν την αποπτωτική - κυτταρολυτική δράση τους μέσω των υποδοχέων
τους. Οι υποδοχείς των κορτικοειδών έχουν μεγάλη δομική συγγένεια με τους υποδοχείς
των αλατοκορτικοειδών, της προγεστερόνης και των ανδρογόνων και φαίνεται ότι
μπορούν να συνομιλούν μεταξύ τους (cross-talk). Η προγεστερόνη μπορεί να μιμηθεί
τη δράση των κορτικοειδών σε κάποιους ιστούς, όπως και τα κορτικοειδή μπορούν
να έχουν προγεστερινοειδή δράση στα κύτταρα του καρκίνου του μαστού. Φαίνεται,
δηλαδή, ότι οι υποδοχείς κορτικοειδών και προγεστερόνης έχουν αλληλοεπικαλυπτόμενη
δράση στις ενδιάμεσες εστίες προσκόλλησης.
Κορτικοειδή
ως θεραπεία κακοήθων νοσημάτων
Θεραπευτικά αποτελούν βασικό και θεμελιώδες φάρμακο στην αντιμετώπιση νεοπλασμάτων
του λεμφικού ιστού, όπως είναι η λεμφοβλαστική λευχαιμία, τα μη-Hodgkin λεμφώματα,
αλλά και η νόσος Hodgkin.
Λόγω της λεμφολυτικής τους δράσης, στο τέλος της δεκαετίας του 1940, τα κορτικοειδή
άρχισαν να χρησιμοποιούνται στη θεραπεία της λευχαιμίας της παιδικής ηλικίας,
αρχικά ως μονοθεραπεία και στη συνέχεια μαζί με άλλους χημειοθεραπευτικούς παράγοντες.
Σήμερα αποτελούν αναπόσπαστο τμήμα των θεραπευτικών πρωτοκόλλων. Είναι σημαντική
η κατανόηση του μηχανισμού δράσης των κορτικοειδών στα κακοήθη κύτταρα, αλλά
εξίσου σημαντική είναι και η κατανόηση της ανθεκτικότητας των λευχαιμικών κυττάρων
στα κορτικοειδή, διότι έτσι μπορεί να εξηγηθεί η αποτελεσματικότητα αλλά και
η αποτυχία της χημειοθεραπείας σε μερικές περιπτώσεις.
Μερικά πρωτόκολλα χημειοθεραπείας στην οξεία λεμφοβλαστική λευχαιμία, όπως το
ΒFM, συνδέουν την αποτελεσματικότητά τους και τα ποσοστά επιβίωσης των ασθενών
με την καλή ανταπόκριση ή όχι στα κορτικοειδή. Η 3ετής ελεύθερη νόσου επιβίωση
στα παιδιά που υποβλήθηκαν σε χημειοθεραπεία με το πρωτόκολλο ΒFM, ήταν 75%
όταν οι ασθενείς είχαν καλή ανταπόκριση σε 7ήμερη μονοθεραπεία με κορτικοειδή
(καλοί απαντητές) και αντίστοιχα 43% όταν δεν είχαν καλή ανταπόκριση στα κορτικοειδή
(κακοί απαντητές). Φαίνεται, δηλαδή, ότι ενδεχόμενη ανθεκτικότητα στα κορτικοειδή
μπορεί να επηρεάσει την έκβαση της λευχαιμίας. Για το λόγο αυτό, πολλά πρωτόκολλα
χημειοθεραπείας ξεπερνούν την ύπαρξη ή μη ανθεκτικότητας στα κορτικοειδή συνδυάζοντας
περισσότερα χημειοθεραπευτικά.
Κακής πρόγνωσης λευχαιμίες θεωρούνται η λευχαιμία σε παιδιά κάτω των 12 μηνών,
η Τ-λεμφοβλαστική λευχαιμία και η λεμφοβλαστική λευχαιμία που έχει θετικό χρωμόσωμα
Φιλαδέλφεια. Αυτές οι μορφές λευχαιμίας συχνά παρουσιάζουν μεγάλη ανθεκτικότητα
στα κορτικοειδή, ενώ η λευχαιμία των ενηλίκων που επίσης έχει χειρότερη πρόγνωση
από τη λευχαιμία της παιδικής ηλικίας, παρουσιάζει επίσης μεγαλύτερη ανθεκτικότητα
στα κορτικοειδή.
Η ανθεκτικότητα του λευχαιμικού κυττάρου στα κορτικοειδή εξαρτάται από πολλούς
παράγοντες και φαίνεται ότι σχετίζεται κυρίως με τους υποδοχείς των κορτικοειδών.
Μελέτες που έγιναν σε ασθενείς με λεμφοβλαστική λευχαιμία έδειξαν ότι τα λευχαιμικά
κύτταρα των ασθενών που υποτροπίασαν είχαν 300 φορές μεγαλύτερη ανθεκτικότητα
στα κορτικοειδή, σε σχέση με τους ασθενείς που δεν υποτροπίασαν. Σε ασθενείς
που υποτροπίασαν, όταν μελετήθηκε η ευαισθησία των λευχαιμικών κυττάρων κατά
τη διάγνωση της λευχαιμίας και κατά την υποτροπή, βρέθηκε ότι στην πλειονότητα
των ασθενών υπήρχε αυξημένη ανθεκτικότητα στα κορτικοειδή κατά την υποτροπή
σε σχέση με τη διάγνωση.

Σχημα 1. Μηχανισμός δράσης
των κορτικοειδών μέσω των υποδοχέων τους και ο κυτταρικός θάνατος (απόπτωση)
Αίτια
ανθεκτικότητας στα κορτικοειδή
Η ανθεκτικότητα στα κορτικοειδή είναι πολυπαραγοντική και φαίνεται ότι: α) οι
υποδοχείς των γλυκοκορτικοειδών (ΥΓ) έχουν τον κύριο λόγο. Το γονίδιο του υποδοχέα
των κορτικοειδών αποτελείται από 9 εξώνια. Καθώς το mRNA ενώνεται με τα εξώνια,
δημιουργούνται πέντε τύποι υποδοχέων με διαφορετική δομή και λειτουργία, ήτοι:
ΥΓα που θεωρείται ότι είναι ο κυριότερος, ΥΓβ, ΥΓγ, ΥΓ-Ρ, και ΥΓ-Α. Ο αριθμός
των υποδοχέων του λευχαιμικού κυττάρου θεωρείται ένας από τους παράγοντες ευαισθησίας
ή ανθεκτικότητας στα κορτικοειδή. Χαμηλός αριθμός υποδοχέων στη λεμφοβλάστη
(4.000 υποδοχείς/κύτταρο) συνδυάζεται με κακή ανταπόκριση στη θεραπεία, αλλά
και ο μεγάλος αριθμός υποδοχέων ανά κύτταρο δεν σημαίνει υποχρεωτικά ευαισθησία
στα κορτικοειδή. Εκτός από το βασικό αριθμό ΥΓ που εκφράζεται, το κύτταρο έχει
τη δυνατότητα να αυξάνει τον αριθμό των ΥΓ κατά την έκθεσή του στα κορτικοειδή.
Η αύξηση αυτή δεν συμβαίνει σε όλα τα κύτταρα και η αδυναμία αύξησης των ΥΓ
θεωρείται ένας επιπρόσθετος παράγοντας αντοχής. Αδυναμία αύξησης του αριθμού
των ΥΓ έχει παρατηρηθεί, επίσης, στα κύτταρα του αναπνευστικού επιθηλίου στο
ανθεκτικό στα κορτικοειδή άσθμα, καθώς και στις ανθεκτικές μορφές ρευματοειδούς
αρθρίτιδας.
Άλλοι παράγοντες που υπεισέρχονται στην ανθεκτικότητα είναι: β) η ύπαρξη μεταλλάξεων
στο γονίδιο του υποδοχέα των κορτικοειδών. Οι μεταλλάξεις, γενετικές ή σωματικές,
προκαλούν ανθεκτικότητα με ποικίλους τρόπους ανάλογα με τη θέση της μετάλλαξης.
γ) τα επίπεδα των τύπων του υποδοχέα των κορτικοειδών και η μεταξύ τους σχέση.
Το λευχαιμικό κύτταρο έχει 6 φορές χαμηλότερα επίπεδα υποδοχέα α (ΥΓα) σε σχέση
με το φυσιολογικό λεμφοκύτταρο. Σε παιδιά με Τ-λεμφοβλαστική λευχαιμία, που
παρουσιάζουν μεγαλύτερη ανθεκτικότητα στα κορτικοειδή, παρατηρούνται ακόμη χαμηλότερα
επίπεδα Υγα, αλλά και υψηλότερα επίπεδα ΥΓβ. Έτσι, στα παιδιά με Τ-λεμφοβλαστική
λευχαιμία, ο λόγος ΥΓα/ΥΓβ είναι 15 φορές χαμηλότερος από το φυσιολογικό και
10 φορές χαμηλότερος από τη Β-λεμφοβλαστική λευχαιμία. Βεβαίως, δεν είναι γνωστό
σε πια φάση της οντογένεσης του λεμφοκυττάρου εμφανίζονται οι υποδοχείς, αλλά
φαίνεται ότι ο λόγος ΥΓα/ΥΓβ σχετίζεται με την ανθεκτικότητα στα κορτικοειδή.
Από πρόσφατα πειραματικά δεδομένα φαίνεται ότι και το επίπεδο των υποδοχέων
γ (ΥΓγ) παίζει κάποιο ρόλο στην ανθεκτικότητα του λευχαιμικού κυττάρου στα κορτικοειδή
και δ) οποιαδήποτε διαταραχή της αλληλουχίας των γεγονότων μέσα στον κύκλο ενεργοποίησης
του υποδοχέα και των μεταγραφικών παραγόντων έως την απόπτωση (σχήμα 1). Από
μελέτες φαίνεται ότι παρατηρείται αύξηση του bcl2 και αύξηση στη σχέση bcl2/bax.
H ευαισθησία των υποδοχέων στα κορτικοειδή φαίνεται να αποτελεί όχι μόνον προγνωστικό
παράγοντα για την έκβαση της λευχαιμίας, αλλά φαίνεται να σχετίζεται με σοβαρές
επιπλοκές κατά τη διάρκεια της θεραπείας, όπως είναι το σύνδρομο Cushing, η
παχυσαρκία, ή και η άσηπτη νέκρωση της κεφαλής του μηριαίου. Άρα, αν υπήρχε
δυνατότητα προσδιορισμού της ομάδας των ασθενών με ανθεκτικότητα ή ευαισθησία
στα κορτικοειδή, τότε η ομάδα των ασθενών με αυξημένη ευαισθησία στα κορτικοειδή
μπορεί να έχει καλή πρόγνωση και λιγότερες παρενέργειες με μικρότερες δόσεις
κορτικοειδών.
Θεραπευτικά
πρεδνιζόνη ή δεξαμεθαζόνη;
Για πολλά χρόνια υπήρχε ο προβληματισμός. Αρχικά στη θεραπεία της λευχαιμίας
χρησιμοποιήθηκε η πρεδνιζόνη σε συνδυασμό με άλλους χημειοθεραπευτικούς παράγοντες.
Στη συνέχεια, όμως, η καλύτερη φαρμακοκινητική της δεξαμεθαζόνης, το γεγονός
ότι είχε καλύτερη διαπερατότητα στο ΚΝΣ και πιο παρατεταμένη δράση, άρα μπορούσε
να προφυλάξει περισσότερο από υποτροπή στο ΚΝΣ, σε συνδυασμό με το γεγονός ότι
η δεξαμεθαζόνη ενώ ήταν 7 φορές ισχυρότερη από την πρεδνιζόνη, ήταν 16 φορές
ισχυρότερη στο να προκαλεί κυτταρόλυση, έκανε τη δεξαμεθαζόνη να χρησιμοποιηθεί
σε αρκετά σχήματα χημειοθεραπείας. Ο ενθουσιασμός αυτός, όμως, ανεκόπη όταν
το 1996 νεώτερα πειραματικά δεδομένα έδειξαν ότι η πραγματική καταστροφική δράση
της δεξαμεθαζόνης ήταν μόνο 5-6 φορές μεγαλύτερη από αυτήν της πρεδνιζόνης.
Στη λευχαιμία, η θεραπεία εφόδου περιλαμβάνει κορτικοειδή (πρεδνιζόνη) σε δόση
60mg/m2/ημ για 22 ημέρες. Ακολουθεί η θεραπεία σταθεροποίησης που περιλαμβάνει
πρεδνιζόνη 60mg/m2/ημ ή δεξαμεθαζόνη 10mg/m2/ημ για 5 ημέρες κάθε τρεις εβδομάδες.
Στη θεραπεία συντήρησης χορηγείται πρεδνιζόνη 180mg/m2/ημ για 7 ημέρες κάθε
2 μήνες ή 40mg/m2/ημ για 5 ημέρες κάθε μήνα (πίνακας 1).
Βεβαίως, ανακύπτει το ερώτημα αν προκαλείται καταστολή του υποθαλαμοϋποφυσιακού
άξονα από την παρατεταμένη χορήγηση κορτικοειδών. Στη θεραπεία εφόδου, που είναι
και το μεγαλύτερο διάστημα συνεχούς χορήγησης κορτικοειδών, η καταστολή που
προκαλείται από τα κορτικοειδή φαίνεται να εξισορροπείται από το stress στο
οποίο βρίσκεται ο ασθενής από την ίδια τη λευχαιμία, τη χημειοθεραπεία, αλλά
και από τις λοιμώξεις που συμβαίνουν κατά τη διάρκεια της θεραπείας. Επίσης,
καταστολή του άξονα δεν φαίνεται να συμβαίνει ακόμη και με τη μεγάλη δόση κορτικοειδών
180mg/m2/ημ για 7 ημέρες (πίνακας 2).
Γνωστή είναι η συμμετοχή των κορτικοειδών και στη θεραπεία των λεμφωμάτων Hodgkin
και μη-Hodgkin. Τα σχήματα MOPP, COP, CHOP ήταν από τα πρώτα σχήματα που χρησιμοποιήθηκαν
στη θεραπεία των λεμφωμάτων με επιτυχή αποτελέσματα και όλα περιέχουν πρεδνιζολόνη.
Στη συνέχεια, πολλές τροποποιήσεις έγιναν ώστε να μειωθούν οι παρενέργειες μερικών
χημειοθεραπευτικών και αντικατεστάθησαν από άλλους παράγοντες ώστε να μειωθεί
η μειωμένη αναπαραγωγική ικανότητα που προκαλούσε το ΜΟΡΡ ή η καρδιοτοξικότητα
της αδριαμυκίνης, όμως, τα κορτικοειδή παρέμεναν πάντα ως βασικό φάρμακο σε
οποιοδήποτε νέο σχήμα (πίνακας 3).
H έντονη λεμφολυτική τους δράση δημιουργεί βεβαίως την υποχρέωση να μην χρησιμοποιούνται
κορτικοειδή σε αμφισβητούμενες καταστάσεις, αν δεν υπάρχει η βεβαιότητα ότι
δεν υποκρύπτεται κάποια κακοήθεια.
Κορτικοειδή
ως αποιδηματική αγωγή
Οίδημα εγκεφάλου μπορεί να σχηματισθεί από πρωτοπαθείς όγκους ή από μεταστάσεις,
δηλαδή αγγειογενές οίδημα λόγω της διαταραχής του τόνου των αγγείων. Οίδημα
σημαίνει αύξηση του εξωκυττάριου ύδατος λόγω μείωσης από το νεόπλασμα της διαπερατότητας
των τριχοειδών στον αιματοεγκεφαλικό φραγμό και προκαλείται από τους αγγειογενετικούς
παράγοντες που εκλύει ο όγκος. Μπορεί, όμως, να αναπτυχθεί και κατά τη διάρκεια
της ακτινοθεραπείας, κυτταροτοξικό οίδημα, λόγω διαταραχής της ομοιόστασης των
κυττάρων.
Η δεξαμεθαζόνη είναι το κορτικοειδές που συνήθως χρησιμοποιείται γιατί έχει
καλύτερη διεισδυτικότητα στο ΚΝΣ και πιο παρατεταμένη δράση. Ο μηχανισμός με
τον οποίο ασκεί την αποιδηματική της δράση δεν έχει πλήρως διευκρινισθεί, αλλά
θεωρείται ότι βελτιώνει την τοπική ροή του αίματος, προκαλεί αρχικά μεταβολικές
διαταραχές και στη συνέχεια αποκαθιστά τη διαταραχή του όγκου (volume) των αγγείων,
αναστέλλοντας την φωσφολιπάση στα ενδοθηλιακά κύτταρα των αγγείων.



Κορτικοειδή
σε αντιδράσεις υπερευαισθησίας
Αντιδράσεις υπερευαισθησίας προκαλούνται από συγκεκριμένα χημειοθεραπευτικά
και μπορεί να είναι θανατηφόρες, γι΄ αυτό συνήθως προληπτικά χρησιμοποιούνται
κορτικοειδή. Οι αντιδράσεις υπερευαισθησίας οφείλονται στην: α) αποκοκκιοποίηση
των μαστοκυττάρων μέσω της Ig E, β) ιδιοσυστασιακή αποκοκκιοποίηση, δηλαδή χωρίς
τη μεσολάβηση της Ig E και γ) ενεργοποίηση του συμπληρώματος. Τα κορτικοειδή
προκαλούν αναστολή της φλεγμονής, ιδιαίτερα μέσω της κυτταρικής ανοσίας (cellular-mediated
immunity) και καταστολή των τοπικών παραγόντων (local mediators) φλεγμονής,
όπως είναι οι προσταγλανδίνες και οι λεμφοκίνες. Επιπλέον, τα κορτικοειδή στεγανοποιούν
τα αγγεία μειώνοντας τη διαπερατότητα του τοιχώματος και διατηρούν τον τόνο
των αγγείων, ανθιστάμενα στους αγγεισυσπαστικούς παράγοντες που εκλύονται.
Έτσι, οι αντιδράσεις υπερευαισθησίας μπορούν να προληφθούν με βραχέα σχήματα
μεθυλπρεδνιζολόνης ή δεξαμεθαζόνης, προ της χορήγησης του χημειοθεραπευτικού.
Κορτικοειδή
στο ΑRDS
Τα κορτικοειδή είναι ο πιο σημαντικός φυσιολογικός αναστολέας της φλεγμονής.
Παρόλα αυτά, όμως, τα ενδογενή κορτικοειδή δεν είναι πάντοτε ικανά να καταστείλουν
συστηματικές άσηπτες ή μη φλεγμονές, όπως είναι το σύνδρομο οξείας αναπνευστικής
ανεπάρκειας, ΑRDS.
Tο ARDS οφείλεται σε ελεύθερες ρίζες Ο2 που δρουν τοξικά στα ενδοθηλιακά κύτταρα
των τριχοειδών του πνευμονικού παρεγχύματος. Αυτό έχει ως αποτέλεσμα την άθροιση
ύδατος στο διάμεσο ιστό και την αναπνευστική ανεπάρκεια. Η θνητότητα του συνδρόμου
είναι πολύ υψηλή και κυμαίνεται από 40-60%. Στο ΑRDS, παρά το ότι τα επίπεδα
των ενδογενών κορτικοειδών είναι φυσιολογικά, φαίνεται ότι υπάρχει αντίσταση
των υποδοχέων στα κορτικοειδή που ευοδώνεται από την έκλυση των κυτοκινών. Η
χορήγηση μεγάλων δόσεων μεθυλπρεδνιζολόνης δεν καταστέλλει μόνο την παραγωγή
κυτοκινών, αλλά αυξάνει και τη δεσμευτική ικανότητα των υποδοχέων των κορτικοειδών.
Κορτικοειδή
ως αντιεμετική αγωγή
Τα χημειοθεραπευτικά προκαλούν διέγερση διαφόρων υποδοχέων στο πεπτικό και στο
ΚΝΣ, προκαλώντας ναυτία και εμέτους, οξείας ή απώτερης φάσης. Για την αντιμετώπιση
της ναυτίας και των εμέτων χρησιμοποιούνται ανταγωνιστές της 5-υδροξυτρυπταμίνης
(Zofron, Navoban, Kytril), όμως, όταν αυτό δεν είναι αρκετό τότε μπορούμε να
χορηγήσουμε μία εφάπαξ δόση δεξαμεθαζόνης 8-20mg για καταστολή των εμέτων, με
πολύ καλά αποτελέσματα.
Η ογκολογία φαίνεται ότι χρησιμοποιεί όλες τις δράσεις των κορτικοειδών, όμως,
πρέπει πάντα να έχουμε κατά νου και τις παράλληλες βλαπτικές δράσεις τους. Οστεονέκρωση
ή άσηπτη νέκρωση, συμβαίνει μέχρι και σε ποσοστό 30% των ασθενών με κακοήθεια
που παίρνουν κορτικοειδή. Από τις περιπτώσεις αυτές, το 90% συμβαίνει σε αρθρώσεις
που φέρουν το βάρος του σώματος και συνηθέστερη είναι η κεφαλή του μηριαίου
και ακολουθεί σε συχνότητα η κατά γόνυ και τα σώματα των σπονδύλων.
Συχνά απαιτείται αντικατάσταση της κεφαλής του μηριαίου με ενδοπρόθεμα.
Η άσηπτη νέκρωση οφείλεται σε αύξηση της πίεση στο μυελό των οστών σε συνδυασμό
με μειωμένη αιμάτωση. Ο κίνδυνος αυξάνει σε παχύσαρκα άτομα, σε παιδιά με υπερπαραθυρεοειδισμό
και σε παιδιά με οστεοπόρωση λόγω των κορτικοειδών.
Παλαιότερα πιστεύαμε ότι τα κορτικοειδή προκαλούν οστεοπόρωση λόγω διαταραχής
του μεταβολισμού του ασβεστίου, της βιταμίνης D και πολλών άλλων παραγόντων,
δηλαδή θεωρούσαμε ότι δρουν στο τελικό όργανο-στόχο. Φαίνεται όμως ότι, τα κορτικοειδή
όταν εισέρχονται στον πυρήνα του κυττάρου, παρεμβαίνουν στο DNA, εγγράφονται
σε πολλές θέσεις και διαταράσσουν την έκφραση πολλών γόνων. Μερικές από τις
θέσεις αυτές επικαλύπτουν αλληλουχίες του DNA σημαντικές για τη μεταγραφή του
γόνου της οστεοκαλσίνης και την εξ΄ αυτής διέγερση της 1,25 διυδροξυ-βιταμίνη
D3, δηλαδή η αιτία της οστεοπόρωσης είναι η παρέμβαση στο DNA που προκαλούν
τα κορτικοειδή.
Η άσηπτη νέκρωση και η οστεοπόρωση είναι ανεπιθύμητες δράσεις που εκδηλώνoνται
παράλληλα με τη θεραπεία και που υποχρεώνουν σε δραματική μείωση ή και διακοπή
της χορήγησης των κορτικοειδών, με επιπτώσεις άγνωστες στην τελική έκβαση της
λευχαιμίας ή του λεμφώματος.
Βιβλιογραφία
Assouline-Dayan Y, Chang C, Greenspan A, Shoenfeld Y, Gershwin ME. Pathogenesis
and natural history of osteonecrosis. Semin Arthritis Rheum 2002; 32(2):94-124.
Chikanza IC, Kozaci D, Chernajovsky Y. The molecular and cellular basis of corticosteroid
resistance. J Endocrinol 2003; 179(3):301-310.
DeVita VT Jr. Hodgkin's disease--clinical trials and travails. N Engl J Med
2003; 348(24):2.375-2.376.
Diehl V, Franklin J, Pfreundschuh M, Lathan B, Paulus U, Hasenclever D, Tesch
H, Herrmann R, Dorken B, Muller-Hermelink HK, Duhmke E, Loeffler M. German Hodgkin's
Lymphoma Study Group. Standard and increased-dose BEACOPP chemotherapy compared
with COPP-ABVD for advanced Hodgkin's disease. N Engl J Med 2003; 348(24):2.386-2.395.
Ekert H. Chemotherapy for Hodgkin's disease. N Engl J Med 2003; 349(12):1.186-1.187.
Flake ZA, Scalley RD, Bailey AG. Practical selection of antiemetics. Am Fam
Physician 2004; 69(5):1.169-1.174.
Greenstein S, Ghias K, Krett NL, Rosen ST. Mechanisms of glucocorticoid-mediated
apoptosis in hematological malignancies. Cancer Res 2002; 8(6):1.681-1.694.
Goel A. Tumour induced hydrocephalus and oedema: pathology or natural defence.
J Postgrad Med 2002; 48:153-154.
Haarman EG, Kaspers GJ, Pieters R, Rottier MM, Veerman AJ. Glucocorticoid receptor
alpha, beta and gamma expression vs in vitro glucocorticod resistance in childhood
leukemia. Leukemia 2004; 18(3):530-537.
Holleman A, den Boer ML, Kazemier KM, Janka-Schaub GE, Pieters R. Resistance
to different classes of drugs is associated with impaired apoptosis in childhood
acute lymphoblastic leukemia. Blood 2003; 102(13):4.541-4.546.
Hui L, Wiernik PH. Avascular necrosis of bone after adult acute lymphocytic
leukemia treatment with methotrexate, vincristine, L-asparaginase, and dexamethasone
(MOAD). Am J Hematol 1996; 52(3):184-188.
Kino T, De Martino MU, Charmandari E, Mariani M, Chrousos GP. Tissue glucorticoid
resistance/hypersensitivity syndromes. J Steroid Biochem Mol Biol 2003; 85(2-5):457-467.
Koehler PJ. Use of corticosteroids in neuro-oncology. Anticancer Drugs 1995;
6(1):19-33.
Kofler R, Schmidt S, Kofler A, Ausserlechner MJ. Resistance to glucocorticoid-induced
apoptosis in lymphoblastic leukemia. J Endocrinol 2003; 178(1):19-27.
Lauten M, Cario G, Asgedom G, Welte K, Schrappe M. Protein expression of the
glucocorticoid receptor in childhood acute lymphoblastic leukemia. Haematologica
2003; 88(11):1.253-1.258.
Longui CA, Vottero A, Adamson PC, Cole DE, Kino T, Monte O, Chrousos GP. Low
glucocorticoid receptor alpha/beta ratio in T-cell lymphoblastic leukemia. Horm
Metab Res 2000; 32(10):401-406.
Meduri GU, Tolley EA, Chrousos GP, Stentz F. Prolonged methylprednisolone treatment
suppresses systemic inflammation in patients with unresolving acute respiratory
distress syndrome. Evidence for inadequate endogenous glucocorticoid secretion
and inflammation-induced immune cell resistance to glucorticoids. Am J Respir
Crit Care Med 2002; 165:983-991.
Petersen KB, Jusko WJ, Rasmussen M, Schmiegelow K. Population pharmacokinetics
of prednisolone in children with acute lymphoblastic leukemia. Cancer Chemother
Pharmacol 2003; 51(6):465-473.
Ramakers-van Woerden NL, Beverloo HB, Veerman AJ, Camitta BM, Loonen AH, van
Wering ER, Slater RM, Harbott J, den Boer ML, Ludwig WD, Haas OA, Janka-Schaub
GE, Pieters R. In vitro drug-resistance profile in infant acute lymphoblastic
leukemia in relation to age, MLL rearrangements and immunophenotype. Leukemia
2004; 18(3):521-529.
Redding GJ. Current concepts in adult respiratory distress syndrome in children.
Curr Opin Pediatr 2001; 13(3):261-266.
Tissing WJ, Meijerink JP, den Boer ML, Pieters R. Molecular determinants of
glucocorticoid sensitivity and resistance in acute lymphoblastic leukemia. Leukemia
2003; 17(1):17-25.
Van Agthoven M, Sonneveld P, Hagenbeek A, Uyl-de Groot CA. A review of recruitment
criteria, patient characteristics and results of CHOP chemotherapy in prospective
randomized phase III clinical trials for aggressive non-Hodgkin's lymphoma.
Hematol J 2003; 4(6):399-409.
Virik K, Karapetis C, Droufakou S, Harper P. Avascular necrosis of bone: the
hidden risk of glucocorticoids used as antiemetics in cancer chemotherapy. Int
J Clin Pract 2001; 55(5):344-345.
Werner A, Jager M, Schmitz H, Krauspe R. Joint preserving surgery for osteonecrosis
and osteochondral defects after chemotherapy in childhood. Klin Padiatr 2003;
215(6):332-337.