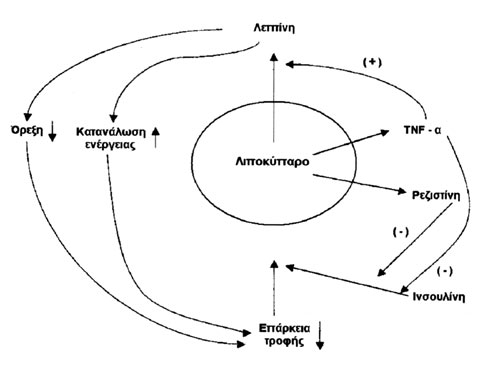
Σχήμα 1. Βασικοί μηχανισμοί αλληλεπίδρασης TNF-α, IL-6, λιποσίνης, λιπονεκτίνης, λεπτίνης, ινσουλίνης και ρεζιστίνης.
Ρεζιστίνη:
μια νέα "λιποκίνη"
Δ. Φαρμακιώτης
Δ. Ρούσσος
Α. Κούρτης
Δ. Πανίδης
Μονάδα Ενδοκρινολογίας
και Ανθρώπινης Αναπαραγωγής,
Β΄ Μαιευτική και Γυναικολογική Κλινική Α.Π.Θ.
Αλληλογραφία:
Δ. Πανίδης
Μητροπόλεως 119
54622, Θεσσαλονίκη
Τηλ: 2310 230333
e-mail: argic@med.auth.gr
Κατατέθηκε: 26/9/2003
Εγκρίθηκε: 5/11/2003
Περίληψη
Η ρεζιστίνη είναι μία λιποκίνη που πήρε το όνομά της από το γεγονός ότι θεωρήθηκε
ως ο κρίκος ο οποίος συνδέει την παχυσαρκία με τον σακχαρώδη διαβήτη. Η ρεζιστίνη
ενδέχεται να συμμετέχει στην παθογένεια της ανάπτυξης αντίστασης στην ινσουλίνη.
Στην ανασκόπηση αυτή περιγράφονται η ενδοκρινική λειτουργία του λιπώδους ιστού,
η ρεζιστίνη και τα συγγενή πεπτίδια, η κατανομή της ρεζιστίνης στους ιστούς
και η σχέση της με την αντίσταση στην ινσουλίνη. Περιγράφονται, ακόμη, η ρύθμιση
της παραγωγής της ρεζιστίνης και η αλληλεπίδρασή της με άλλες ορμόνες, το κλινικό
ενδιαφέρον όσον αφορά στη δράση της, και οι γενετικοί πολυμορφισμοί του γονιδίου
της ρεζιστίνης. Τέλος, αναφέρονται οι δράσεις της ρεζιστίνης στις γονάδες.
Όροι ευρετηρίου: Ρεζιστίνη, λιπώδης ιστός, αντίσταση στην ινσουλίνη, σακχαρώδης διαβήτης τύπου 2.
EΙΣΑΓΩΓΗ
Η ανάπτυξη του λιπώδους ιστού υπήρξε καθοριστική στην εξέλιξη των θηλαστικών.
Σε όλο το ζωικό βασίλειο η φύση πολεμά ανάμεσα στη Σκύλα του υποσιτισμού και
στη Χάρυβδη της παχυσαρκίας.(1) Στις σύγχρονες, όμως, βιομηχανικές κοινωνίες
των ανθρώπων, που έχουν αντιμετωπίσει προ πολλού τις προαιώνιες απειλές της
επιβίωσης, η λεπτή ισορροπία μεταξύ θερμιδικής πρόσληψης και κατανάλωσης φαίνεται
να διαταράσσεται.
Πριν από 100 περίπου χρόνια ο σακχαρώδης διαβήτης (ΣΔ) τύπου 2, ο οποίος είναι
άρρηκτα συνδεδεμένος με την παχυσαρκία, θεωρούνταν σπάνια νόσος. Αντίθετα, υπολογίζεται
ότι το 2025, 300 περίπου εκατομμύρια άνθρωποι παγκοσμίως θα πάσχουν από σακχαρώδη
διαβήτη τύπου 2.(2) Στις ΗΠΑ τουλάχιστον 32 εκατομμύρια έχουν διαταραχές στην
ομοιόσταση της γλυκόζης και οι μισοί, περίπου, πάσχουν από ΣΔ τύπου 2.(3) Στην
Ελλάδα η συχνότητα του διαβήτη στον γενικό πληθυσμό έχει αυξηθεί σημαντικά τα
τελευταία χρόνια.(4) Το κυριότερο μέτρο στην αντιμετώπιση του σακχαρώδη διαβήτη
τύπου 1 παραμένει η χορήγηση ινσουλίνης.(5,6) Το ερευνητικό, όμως, ενδιαφέρον
σήμερα εστιάζεται στην αποκωδικοποίηση των πολύπλοκων μοριακών μηχανισμών με
τους οποίους συνδέονται η παχυσαρκία, ο σακχαρώδης διαβήτης τύπου 2 και η αντίσταση
στην ινσουλίνη.(7)
Η
ΕΝΔΟΚΡΙΝΙΚΗ ΛΕΙΤΟΥΡΓΙΑ ΤΟΥ ΛΙΠΩΔΟΥΣ ΙΣΤΟΥ
Η παραδοσιακή θεώρηση του λιπώδους ιστού ως απλής παρακαταθήκης ενεργειακών
αποθεμάτων με τη μορφή των τριγλυκεριδίων ανατράπηκε το 1994, με την ανακάλυψη
της λεπτίνης.(8) Η λεπτίνη είναι ένα πεπτίδιο που εκκρίνεται από τα λιποκύτταρα
και δρα κυρίως στον υποθάλαμο, όπου επάγει το αίσθημα του κορεσμού, περιορίζοντας
την πρόσληψη της τροφής. Επιπλέον, η λεπτίνη παρουσιάζει ποικιλία δράσεων στο
κεντρικό και στο αυτόνομο νευρικό σύστημα, αλλά και σε περιφερικά όργανα-στόχους
(γραμμωτούς μυς, ήπαρ, καρδιά), μεταφέροντας συνολικά το μήνυμα της επάρκειας
σε αποθέματα τριγλυκεριδίων.(1,7,9-14)
Σήμερα, μπορούμε πλέον να πούμε με βεβαιότητα ότι το λιποκύτταρο αποτελεί δυναμικό
στοιχείο του συστήματος των ενδοκρινών αδένων, που συντονίζει τον ενεργειακό
μεταβολισμό και τροποποιεί την ευαισθησία των ιστών στη δράση της ινσουλίνης.(15)
Στις δράσεις αυτές του λιποκυττάρου συμβάλλουν αναμφίβολα τα ελεύθερα λιπαρά
οξέα, τα οποία διοχετεύονται στην κυκλοφορία από τα λιποκύτταρα.(16) Σημαντικό
ρόλο παίζει και η έκκριση μιας ποικιλίας παραγόντων από τον λιπώδη ιστό με δράση
ενδοκρινική, παρακρινική ή και αυτοκρινική.(1,7,15) Οι κυριότερες από αυτές
τις "λιποκίνες"(17) είναι, εκτός από τη λεπτίνη, η λιποσίνη,(18) η
λιπονεκτίνη(19-21) και η ρεζιστίνη.(22) Σημαντικό, επίσης, ρόλο διαδραματίζουν
οι γνωστές από χρόνια κυτταροκίνες του ανοσολογικού συστήματος TNF-α και IL-6,
οι οποίες παράγονται και από τα λιποκύτταρα.(23-25) Οι βασικοί μηχανισμοί αλληλεπίδρασης
αυτών των παραγόντων συνοψίζονται στο σχήμα 1.
ΡΕΖΙΣΤΙΝΗ
ΚΑΙ ΣΥΓΓΕΝΗ ΠΕΠΤΙΔΙΑ:
ΙΣΤΟΡΙΑ, ΧΗΜΕΙΑ ΚΑΙ ΜΟΡΙΑΚΗ ΓΕΝΕΤΙΚΗ
Η ρεζιστίνη βρέθηκε για πρώτη φορά στα ποντίκια από τους Steppan και συν. στο
Πανεπιστήμιο της Pennsylvania το 2001.(22) Ονομάσθηκε έτσι γιατί ευθύς-εξαρχής
συνδέθηκε με την αντίσταση στην ινσουλίνη (in sulin + resist ance: resist in).
Η πρωτεΐνη που συνθέτει αρχικά το λιποκύτταρο αποτελείται από 114 αμινοξέα.
Κατά την έξοδο, όμως, του πεπτιδίου από το λιποκύτταρο αποκόπτονται τα πρώτα
20 αμινοξέα από το αμινοτελικό του άκρο. Ιδιαίτερη βιολογική σημασία πρέπει
να έχει η αλληλουχία που περιλαμβάνει 11 μόρια κυστεΐνης (Cys), η οποία διατηρείται
σταθερή σε τρία διαφορετικά είδη εργαστηριακών ποντικών.(26) Σημαντικός σε αυτή
την αλληλουχία είναι ο ρόλος της κυστεΐνης στη θέση 26 (Cys26), όπου δύο πεπτίδια
ενώνονται μεταξύ τους με δισουλφιδικό δεσμό, δηλαδή η ρεζιστίνη εκκρίνεται τελικά
ως ομοδιμερές. Ανασυνδυασμένα μόρια ρεζιστίνης χωρίς την Cys26 εκκρίνονται σε
μονομερή μορφή.(27) Η ρεζιστίνη του ανθρώπου και του ποντικού είναι ομόλογες
κατά 59%. Το γονίδιο που κωδικοποιεί τη ρεζιστίνη έχει χαρτογραφηθεί στο χρωμόσωμα
19 και ειδικότερα στη θέση 19q13.3 για τον άνθρωπο και στο χρωμόσωμα 8 για τον
ποντικό.(22)
Ταυτόχρονα με την ομάδα της Steppan, τη ρεζιστίνη εντόπισαν ανεξάρτητα δύο ακόμη
ερευνητικές ομάδες.(26,28) Oι Kim και συν.(28) ονόμασαν την πρωτεΐνη αυτή ειδικό
εκκριτικό παράγοντα του λιπώδους ιστού (Adipose Tissue-Specific Secretory Factor-ATSSF).
Οι Holcomb και συν. ανακάλυψαν πρώτα το συγγενές προς τη ρεζιστίνη πεπτίδιο
FIZZ1 (Found In Inflammatory Zone 1), δηλαδή πρώτο πεπτίδιο παραγόμενο στη φλεγμονώδη
ζώνη, το οποίο και ονόμασαν έτσι επειδή εντοπίστηκε αρχικά σε φλεγμαίνον πνευμονικό
παρέγχυμα.(26) Χρησιμοποιώντας τους ειδικούς για το πεπτίδιο αυτό δείκτες εντόπισαν
και τη ρεζιστίνη, την οποία ονόμασαν σε αναλογία προς το FIZZ1, FIZZ3. Από την
άλλη μεριά, οι Steppan και συν.(29) μετά την ανακάλυψη της ρεζιστίνης χρησιμοποίησαν
τους δικούς τους δείκτες για την ανίχνευση του FIZZ1, το οποίο ονόμασαν μόριο
σχετιζόμενο με τη ρεζιστίνη-α (Resistin-Like Molecule-α ή RELMα). Τα αντίστοιχα
γονίδια συμβολίζονται πλέον διεθνώς ως Retn (Ρεζιστίνη/ATSSF /FIZ3) και Retn1a
(FIZZ1/RELMα). Έχει ακόμη εντοπιστεί ένα τρίτο πεπτίδιο, ειδικό για τον εντερικό
ιστό (FIZZ2/RELMβ). Πολύ πρόσφατα(30) διαπιστώθηκε ότι, εκτός από τον σχηματισμό
δισουλφιδικών διμερών, τα μονομερή των τριών πεπτιδίων μπορούν να αλληλεπιδρούν
και μεταξύ τους με τον σχηματισμό μη-ομοιοπολικών δεσμών. Επιπλέον, η ρεζιστίνη
και το FIZZ2 πιθανότατα σχηματίζουν και ανώτερης τάξης πολυμερή. Στον άνθρωπο
έχουν εντοπισθεί 2 μόνον γονίδια που κωδικοποιούν πεπτίδια αντίστοιχα των τριών
που βρέθηκαν στους ποντικούς.(7)
KΑΤΑΝΟΜΗ
ΤΗΣ ΡΕΖΙΣΤΙΝΗΣ ΣΤΟΥΣ ΙΣΤΟΥΣ ΚΑΙ Η ΣΧΕΣΗ ΤΗΣ ΜΕ ΤΗΝ ΑΝΤΙΣΤΑΣΗ ΣΤΗΝ ΙΝΣΟΥΛΙΝΗ
Η ρεζιστίνη εκφράζεται (mRNA) μόνο στον λιπώδη ιστό και σε κανένα άλλο όργανο,
εκτός ίσως από το μαστό, προερχόμενη και εκεί κατά πάσα πιθανότητα από το λίπος
του μαζικού αδένα.(22) Το mRNA της ρεζιστίνης ανιχνεύθηκε μόνο στο λευκό και
όχι στο φαιό λίπος. Νεότερα, όμως, δεδομένα θέτουν υπό αμφισβήτηση τη θέση αυτή,
καθώς η ρεζιστίνη και η λιπονεκτίνη βρέθηκαν να εκφράζονται και σε μια φαιά
λιποκυτταρική σειρά,31 αλλά και στον ανθρώπινο πλακούντα.(32)
Στην κλασική, πλέον, μελέτη των Steppan και συν,(22) τα υψηλότερα επίπεδα mRNA
της ρεζιστίνης βρέθηκαν στο γοναδικό και μάλιστα στο περιωοθηκικό λίπος. Η παρατήρηση
αυτή δεν έχει αξιοποιηθεί, μολονότι θα μπορούσε να υπαινίσσεται την πιθανή εμπλοκή
της ρεζιστίνης στη συμμετοχή των γονάδων στο μεταβολικό σύνδρομο. Είναι γνωστό,
για παράδειγμα, ότι η αντίσταση στην ινσουλίνη αποτελεί χαρακτηριστικό εύρημα
του συνδρόμου των πολυκυστικών ωοθηκών (PCOS).(33)
Πρόσφατα, μελετήθηκαν οι διαφορές στην έκφραση του γονιδίου της ανθρώπινης ρεζιστίνης
στους διάφορους τύπους του λιπώδους ιστού.(34) Υποστηρίχθηκε, λοιπόν, ότι η
ρεζιστίνη εκφράζεται σε εντυπωσιακά μεγαλύτερο βαθμό στο υποδόριο λίπος της
κοιλιακής χώρας και στο επιπλοϊκό (σπλαγχνικό) λίπος σε σχέση με το λίπος στην
περιοχή του μηρού ή της πυέλου. Το εύρημα αυτό ενισχύει την άποψη ότι η ρεζιστίνη
σχετίζεται με την αντίσταση στην ινσουλίνη που συνοδεύει την παχυσαρκία κεντρικού
(ανδρικού) τύπου. Τα πρώτα αυτά αποτελέσματα επιβεβαιώθηκαν με τη διαπίστωση
ότι τα εξίσου αυξημένα σε αυτές τις δυο κατηγορίες λίπους επίπεδα γονιδιακής
έκφρασης οδηγούν και στην αυξημένη συγκέντρωση της ίδιας της πρωτεΐνης, σε σύγκριση
πάντα με το υποδόριο λίπος σε άλλες περιοχές του σώματος.(35)
Σε μια πολύ πρόσφατη μελέτη(36) βρέθηκε ότι τα επίπεδα της ρεζιστίνης σχετίζονται,
ανεξάρτητα από τον δείκτη μάζας σώματος (ΒΜΙ), με την επιφάνεια κάτω από την
καμπύλη (AUC) κατά τη δοκιμασία ανοχής γλυκόζης (OGTT), και με άλλους δείκτες
αντίστασης στην ινσουλίνη. Τα ευρήματα αυτά συνηγορούν για την άμεση εμπλοκή
της ορμόνης αυτής στην αντίσταση στην ινσουλίνη που παρατηρείται στο μεταβολικό
συνδρόμο. Επιπλέον, βρέθηκε στατιστικά σημαντική συσχέτιση των επιπέδων της
ρεζιστίνης με την εκατοστιαία αναλογία του λίπους του σώματος, όχι όμως και
με τον ΒΜΙ. Πάντως, τα αποτελέσματα όσον αφορά στη σχέση των επιπέδων της ρεζιστίνης
με την εκατοστιαία αναλογία του λίπους του σώματος ή με τον ΒΜΙ είναι αντικρουόμενα.(37,38)
Προηγούμενες μελέτες(39,40) χρήζουν ιδιαίτερης προσοχής, καθώς αντιστρατεύονται
την άποψη ότι η ρεζιστίνη αποτελεί τον συνδετικό κρίκο μεταξύ της παχυσαρκίας
και της αντίστασης στην ινσουλίνη. Έτσι, οι Nagaev και συν.(39) διαπίστωσαν
την έλλειψη της έκφρασης της ρεζιστίνης σε απομονωμένα ανθρώπινα λιποκύτταρα
και, συνεπώς, την απουσία συσχέτισης της νέας λιποκίνης με την παχυσαρκία, την
αντίσταση στην ινσουλίνη και τον σακχαρώδη διαβήτη τύπου 2. Επιπλέον, οι Savage
και συν.(40) σε απομονωμένα ανθρώπινα λιποκύτταρα δεν παρατήρησαν συσχέτιση
ανάμεσα στα επίπεδα του mRNA της ρεζιστίνης και στις τιμές του ΒΜΙ, μολονότι
η έκφραση του πεπτιδίου αυτού ήταν σημαντικά αυξημένη σε παχύσαρκα από ό,τι
σε λεπτόσωμα άτομα. Οι συγγραφείς ανέφεραν ότι τα επίπεδα του mRNA της ρεζιστίνης
στο υποδόριο λίπος της κοιλίας ήταν παρόμοια με εκείνα στο επιπλοϊκό λιπώδες
στρώμα.(40) Πολύ πρόσφατη μελέτη έδειξε ότι η συγκέντρωση της πρωτεΐνης στο
σπλαγχνικό λίπος ήταν κατά 250% υψηλότερη σε σύγκριση με το υποδόριο λίπος της
κοιλίας.(41)
Σε δική μας μελέτη που αφορούσε γυναίκες με το σύνδρομο των πολυκυστικών ωοθηκών,
τα επίπεδα της ρεζιστίνης του ορού βρέθηκαν να συσχετίζονται με τον BMI.(37)
Πρέπει πάντως να σημειωθεί ότι η γονιδιακή έκφραση μιας λιποειδικής ορμόνης
ή κυτοκίνης άλλοτε αντανακλά τα επίπεδά της στον ορό(42,43) και άλλοτε όχι,(44)
πόσο μάλλον τη βιολογική της δραστικότητα. Οι Savage και συν. απέδωσαν τη δυσαρμονία
των ευρημάτων τους είτε στην αλλαγή της γονιδιακής έκφρασης in-vitro είτε στη
μεγαλύτερη συμβολή των στρωματικών στοιχείων του λιπώδους ιστού στην παραγωγή
και την έκκριση ρεζιστίνης, με το υποδόριο λίπος των παχύσαρκων να περιέχει
μεγαλύτερη αναλογία μονοκυττάρων.(40) Η θέση αυτή θα μπορούσε να ερμηνεύσει
και τα αποτελέσματα των Nagaev και συν., οι οποίοι όμως έλεγξαν την έκφραση
της ρεζιστίνης και σε ολικά εκχυλίσματα λιπώδους ιστού, χωρίς να οδηγηθούν σε
διαφορετικά αποτελέσματα. Το βέβαιο είναι ότι κάθε μελέτη που αφορά μόνο τα
λιποκύτταρα(45) πρέπει να αντιμετωπίζεται υπό το πρίσμα της ισότιμης, και ενδεχομένως
της σπουδαιότερης συμβολής στη σύνθεση λιποκινών in-vivo και άλλων μεσεγχυματικών
κυττάρων του λιπώδους ιστού, όπως είναι τα μονοκύτταρα. Νεότερες μελέτες έδειξαν
ότι η ρεζιστίνη εκφράζεται και σε κύτταρα του αιμοποιητικού μυελού, ενισχύοντας
την άποψη ότι το νευροενδοκρινικό και το ανοσολογικό σύστημα αποτελούν αλληλένδετους
συντονιστές των ομοιοστατικών μηχανισμών στο ανθρώπινο σώμα.(46,47)
Ορισμένες μελέτες σε πειραματόζωα in-vivo επιβεβαιώνουν τη σύνδεση της ρεζιστίνης
με την αντίσταση στην ινσουλίνη, ενώ σε άλλες δεν επιβεβαιώθηκε το εύρημα αυτό.
Οι Steppan και συν(22) διατύπωσαν την άποψη ότι η ρεζιστίνη αποτελεί ορμόνη
που συνδέει την παχυσαρκία με το σακχαρώδη διαβήτη τύπου 2. Τα επίπεδα της ρεζιστίνης
αυξάνονταν στην παχυσαρκία και η γονιδιακή έκφραση βρέθηκε να επάγεται κατά
τη διαφοροποίηση των λιποκυττάρων. Επιπλέον, η χορήγηση ρεζιστίνης προκάλεσε
παθολογική ανοχή στη γλυκόζη και παρεμπόδισε την ομαλή δράση της ινσουλίνης.
Αντίθετα, η αδρανοποίηση της ρεζιστίνης με ειδικά αντισώματα μείωσε την υπεργλυκαιμία
σε ένα πειραματικό πρότυπο εξωγενούς αντίστασης στην ινσουλίνη και αύξησε την
ινσουλινοεξαρτώμενη πρόσληψη γλυκόζης. Τα ευρήματα αυτά ενισχύουν την άποψη
ότι η επίδραση της ρεζιστίνης στου μεταβολισμό της γλυκόζης ανταγωνίζεται τη
δράση της ινσουλίνης. Οι Kim και συν(28) επιβεβαίωσαν τα ευρήματα αυτά, αποδεικνύοντας
ότι τα επίπεδα του mRNA της ρεζιστίνης είναι χαμηλά κατά τη νηστεία, αλλά αυξάνονται
με την επανασίτιση ή τη χορήγηση ινσουλίνης. Tα θειαζολιδινεδιονικά σκευάσματα
(γλιταζόνες) ελαττώνουν την έκφραση της ρεζιστίνης,(22,48-52) γεγονός στο οποίο
μπορεί να οφείλεται, τουλάχιστον εν μέρει, η αντιδιαβητική τους δράση.
Οι Way και συν, αντίθετα, ανακοίνωσαν ότι η πειραματική πρόκληση παχυσαρκίας
στα τρωκτικά συνδέεται με τη σημαντικά ελαττωμένη έκφραση της ρεζιστίνης, ενώ,
ταυτόχρονα, διαπίστωσαν αυξημένη γονιδιακή έκφραση μετά από τη χορήγηση PPARγ-αγωνιστών
(Peroxisome Proliferator Activated Receptor gamma).(53) Στη συνέχεια δημοσιεύθηκαν
και άλλες μελέτες που υποστηρίζουν την άποψη ότι η παχυσαρκία και η αντίσταση
στην ινσουλίνη σχετίζονται τελικά με την ελαττωμένη έκφραση ρεζιστίνης. Παραδείγματος
χάριν, σε ένα πειραματικό πρότυπο αντίστασης στην ινσουλίνη σε επίμυες παρατηρήθηκε
καταστολή της έκφρασης του γονιδίου της ρεζιστίνης στο λιπώδη ιστό, πιθανότατα
λόγω της αυξημένης έκκρισης ελεύθερων λιπαρών οξέων (FFA).(54) Η β-αδρενεργική
δραστηριότητα, που ως γνωστό προάγει τη λιπόλυση και την αντίσταση στην ινσουλίνη,
διαπιστώθηκε ότι μειώνει την έκφραση του γονιδίου της ρεζιστίνης σε 3Τ3-λιποκύτταρα.(55)
Επιπλέον, οι ειδικοί β3-αδρενεργικοί αγωνιστές, που φαίνεται πως έχουν αντιδιαβητικές
ιδιότητες, επάγουν την έκφραση του γονιδίου της ρεζιστίνης σε παχύσαρκα πειραματόζωα,
τα οποία αρχικά εμφάνιζαν χαμηλά επίπεδα mRNA της ρεζιστίνης.(56) Επιπλέον,
ο TNF-α, που αυξάνεται στην παχυσαρκία, καταστέλλει την έκφραση του γονιδίου
της ρεζιστίνης.(57) Τέλος, η έκφραση του γονιδίου της ρεζιστίνης δεν φαίνεται
να συμμετέχει στην αιτιολογία της ινσουλινοαντοχής σε επίμυες Fischer 344, οι
οποίοι αποτελούν ένα καλό πειραματικό μοντέλο προσομοίωσης του μεταβολικού συνδρόμου
των ανθρώπων.(58)

Σχήμα
1. Βασικοί μηχανισμοί αλληλεπίδρασης TNF-α, IL-6, λιποσίνης, λιπονεκτίνης,
λεπτίνης, ινσουλίνης και ρεζιστίνης.
ΡΥΘΜΙΣΗ
ΤΗΣ ΠΑΡΑΓΩΓΗΣ ΡΕΖΙΣΤΙΝΗΣ - ΑΛΛΗΛΕΠΙΔΡΑΣΗ ΜΕ ΑΛΛΕΣ ΟΡΜΟΝΕΣ
Πληθώρα ορμονών και άλλων παραγόντων επηρεάζουν την έκφραση της ρεζιστίνης,(52)
αλλά τα αποτελέσματα σε ορισμένες περιπτώσεις είναι αντιφατικά. Ειδικότερα,
τα αυξημένα επίπεδα γλυκόζης,(52) η δεξαμεθαζόνη(50,52) και, σύμφωνα με ορισμένες
μελέτες, η ινσουλίνη(28,53) επάγουν την έκφραση του γονιδίου της ρεζιστίνης.
Σε άλλες μελέτες υποστηρίχθηκε η άποψη ότι η ινσουλίνη ελαττώνει την έκφραση
του Retn.(50,52) Παρόμοια δράση εμφανίζουν ο TNF-α,(52,57), η επινεφρίνη(52)
και η διέγερση των β-αδρενεργικών υποδοχέων.(49) Αντίθετα, η εκλεκτική διέγερση
των β3-αδρενεργικών υποδοχέων αυξάνει την έκφραση του γονιδίου αυτού.(56) Στις
περισσότερες μελέτες διαπιστώθηκε ότι οι θειαζολιδινεδιόνες ελαττώνουν την έκφραση
της ρεζιστίνης,(22,48-52) ενώ σε άλλες το αντίθετο.(38,53) Η ενδοθηλίνη-1 (ΕΤ-1),
η οποία αποτελεί ισχυρή αγγειοσυσπαστική ουσία, αναστέλλει την έκκριση της ρεζιστίνης
στα 3Τ3-λιποκύτταρα.(59) Ενδιαφέρον εύρημα αποτελεί το γεγονός ότι η αυξητική
ορμόνη,(60) όπως και το νευροπεπτίδιο-Υ (ΝΡΥ),(61) διεγείρουν την έκφραση του
γονιδίου της ρεζιστίνης στον λευκό λιπώδη ιστό. Τέλος, πρόσφατα πειράματα σε
επίμυες έδειξαν ότι η έκφραση του γονιδίου της ρεζιστίνης καταστέλλεται από
τις θυρεοειδικές ορμόνες, ενώ, αντίθετα, επάγεται από τα στεροειδή του φύλου.(62)
Στον πίνακα Ι συγκρίνονται οι ιδιότητες της λεπτίνης, του ΤΝF-α, της λιπονεκτίνης,
της ιντερλευκίνης-6 και της ρεζιστίνης.
ΚΛΙΝΙΚΕΣ
ΠΡΟΕΚΤΑΣΕΙΣ: ΡΕΖΙΣΤΙΝΗ ΚΑΙ ΘΕΙΑΖΟΛΙΔΙΝΕΔΙΟΝΕΣ
Το κλινικό ενδιαφέρον, όσον αφορά τη ρεζιστίνη και τις υπόλοιπες "λιποκίνες",
εστιάζεται στη συμμετοχή τους στην ευαισθητοποίηση των ιστών στην ινσουλίνη,
εφόσον είναι αποδεκτή η άποψη ότι η αντίσταση στην ινσουλίνη αποτελεί την κύρια
παθοφυσιολογική διαταραχή του μεταβολικού συνδρόμου.(63-65)
Τα από του στόματος αντιδιαβητικά δισκία τα οποία περιορίζουν την "τοξική
δράση" της υπεργλυκαιμίας στην έκκριση αλλά και στη δράση της ινσουλίνης
ευαισθητοποιούν έμμεσα τους ιστούς στην ινσουλίνη.66 Επιπλέον, οι διγουανίδες
ασκούν και άμεση δράση στην περιφέρεια.(67) Τα θειαζολιδινεδιονικά, όμως, παράγωγα
(TZDs-γλιταζόνες) ασκούν την υπογλυκαιμική τους δράση, κατά κύριο λόγο, ευαισθητοποιώντας
τους ιστούς-στόχους στη δράση της ινσουλίνης,(63,64,68,69) αν και έχει αποδειχτεί
ότι έχουν ευεργετική επίδραση και στην έκκριση της ινσουλίνης από τα β-κύτταρα
του παγκρέατος.(70)
Η ευαισθητοποιητική δράση των γλιταζονών ασκείται μέσω της ενεργοποίησης του
ειδικού πυρηνικού υποδοχέα PPAR-γ, ο οποίος τροποποιεί μια συστοιχία γονιδίων
στο λιποκύτταρο.(71-73) Στα γονίδια αυτά συμπεριλαμβάνεται και το γονίδιο της
ρεζιστίνης, το οποίο και ταυτοποιήθηκε από τους Steppan και συν,(22) όταν οι
ερευνητές αυτοί διερευνούσαν την ενδεχόμενη ύπαρξη γονιδίων που επάγονται κατά
την PPARγ-εξαρτώμενη ωρίμανση του λιπώδους ιστού. Οι μικτοί PPARγ-αγωνιστές
(γλιταζόνες) ελαττώνουν την έκφραση της ρεζιστίνης,(22,48-52) γεγονός στο οποίο
ενδέχεται να οφείλεται η αντιδιαβητική τους δράση. Άλλοι ερευνητές, όμως, διαπίστωσαν
αντίθετη δράση των αγωνιστών αυτών.(38,53) Σημειώνεται, πάντως, ότι τα παράδοξα
αυτά ευρήματα ίσως δεν είναι αντιφατικά, αφού σε μία μελέτη βρέθηκε ότι η αδρανοποίηση
του PPARγ αυξάνει αρχικά την ευαισθησία στην ινσουλίνη, η περαιτέρω, όμως, απενεργοποίησή
του καθιστά τους ιστούς-στόχους ανθεκτικούς στην ινσουλίνη (καμπύλη σχήματος
"U").(74)
Ο PPARγ διαδραματίζει αναμφίβολα πρωταρχικό ρόλο στη διαφοροποίηση του λιπώδους
ιστού.75 Έτσι, οι γλιταζόνες ασκούν πλειοτροπική δράση στη λιπογένεση, η οποία
μπορεί να οδηγήσει σε αύξηση του σωματικού βάρους.68,69 Αντίθετα, ο αποκλεισμός
του αγνώστου μέχρι στιγμής υποδοχέα της ρεζιστίνης ή και των ενδοκυττάριων διαβιβαστών,
εφόσον η ρεζιστίνη αποτελεί σημαντικό μεσολαβητή της ευαισθητοποιητικής δράσης
των TZDs, θα προσφέρει έναν εκλεκτικότερο έλεγχο της αντίστασης στην ινσουλίνη
που χαρακτηρίζει το μεταβολικό σύνδρομο.

ΓΕΝΕΤΙΚΟΙ
ΠΟΛΥΜΟΡΦΙΣΜΟΙ ΤΟΥ RETN ΚΑΙ ΑΝΤΙΣΤΑΣΗ ΣΤΗΝ ΙΝΣΟΥΛΙΝΗ
Το γονίδιο της ρεζιστίνης στον άνθρωπο εδράζεται στη γονιδιακή θέση (gene locus)
19q13.3,(22) σε απόσταση 420 Kbp από το γονίδιο του υποδοχέα της ινσουλίνης
(locus D19S884). To γεγονός αυτό, σε συνδυασμό με την αρχική υπόθεση ότι η ρεζιστίνη
αποτελεί τον κρίκο ανάμεσα στην παχυσαρκία και την αντίσταση στην ινσουλίνη,
οδήγησε στη μελέτη γενετικών πολυμορφισμών του Retn, που θα μπορούσαν να συνδέονται
με τον αυξημένο ΒΜΙ, την αντίσταση στην ινσουλίνη και τον σακχαρώδη διαβήτη
τύπου 2.
Τα αποτελέσματα των περισσότερων μελετών ήταν αρνητικά.(76-78) Σε μελέτη πληθυσμού
από τη Σικελία βρέθηκε σημαντική συσχέτιση ανάμεσα στη συχνότητα εμφάνισης μιας
ATG επανάληψης στο 3΄-μη-μεταφραζόμενο άκρο (3΄-UTR) του Retn και στην αντίσταση
στην ινσουλίνη, γεγονός που δεν επιβεβαιώθηκε σε γειτονικό πληθυσμό διαφορετικής
εθνικότητας.(79) Άτομα που φέρουν το σπάνιο αλληλόμορφο CG στη θέση 394 του
προαγωγέα (CG ετεροζυγώτες) έχουν μεγαλύτερη ευαισθησία στην ινσουλίνη από τους
CC-ομοζυγώτες, αν και δεν διαπιστώθηκε σχέση ανάμεσα σε αυτό τον πολυμορφισμό
και στον δείκτη μάζας σώματος.(80) Αντίθετα, σε πρόσφατη μελέτη στις ΗΠΑ, σε
γυναίκες με PCOS δεν βρέθηκε συσχέτιση αυτού του πολυμορφισμού με την αντίσταση
στην ινσουλίνη, την παχυσαρκία ή το ίδιο το σύνδρομο.(81) Τα ευρήματα αυτά συμφωνούν
με τα ευρήματα μελέτης που πραγματοποιήθηκε από την Kλινική μας σε συνεργασία
με την Ενδοκρινολογική Κλινική και τη Μονάδα Γενετικής και Μαιευτικής και Γυναικολογικής
Κλινικής του Πανεπιστημίου Ιωαννίνων. Στη μελέτη αυτή διαπιστώθηκε ότι οι CC-ομοζυγώτες
είχαν σημαντικά υψηλότερο ΒΜΙ.(82) Δεν βρέθηκε, πάντως, καμία συσχέτιση του
C/G πολυμορφισμού με τα επίπεδα της ρεζιστίνης ή την αντίσταση στην ινσουλίνη.(82)
Σε δύο ακόμη μελέτες διαπιστώθηκε η ύπαρξη συσχέτισης της παχυσαρκίας με σημειακούς
πολυμορφισμούς στην 5΄-UTR(83) και στο ιντρόνιο-2 του Retn,(84) αλλά οι πολυμορφισμοί
αυτοί δεν έχουν άμεση σχέση με την έκφραση του γονιδίου. Σε μια μελέτη από την
Κίνα αναφέρθηκε ότι ο πολυμορφισμός +62GΰΑ της 3΄-μη-μεταφραζόμενης περιοχής
(3΄-UTR) σχετίζεται με την αυξημένη επίπτωση σακχαρώδη διαβήτη τύπου 2 και υπέρτασης.
Οι συγγραφείς επισημαίνουν ότι οι πολυμορφισμοί της 3΄-UTR είναι δυνατόν να
επηρεάζουν την έκφραση του γονιδίου της ρεζιστίνης.(85) Αξίζει να σημειωθεί
ότι η μετάλλαξη Pro12Ala του PPARγ συνδέεται με την αυξημένη ευαισθησία στην
ινσουλίνη.(86)
Συμπερασματικά, δεν έχει αποδειχθεί σαφής και ισχυρή συσχέτιση των πολυμορφισμών
του Retn με την αντίσταση στην ινσουλίνη και τον σακχαρώδη διαβήτη τύπου 2,
μολονότι σε ορισμένες μελέτες συσχετίζονται οι μεταλλάξεις του γονιδίου της
ρεζιστίνης με την παχυσαρκία. Πρέπει, πάντως, να σημειωθεί ότι οι διαφορές στα
αποτελέσματα ενδέχεται να οφείλονται στο γεγονός ότι οι μελέτες αναφέρονται
σε πληθυσμούς διαφορετικής εθνικότητας.
ΡΕΖΙΣΤΙΝΗ ΚΑΙ ΓΟΝΑΔΕΣ
Το σύνδρομο των πολυκυστικών ωοθηκών χαρακτηρίζεται από χρόνια ανωοθυλακιορρηξία
και υπερανδρογοναιμία, ενώ σε υψηλό ποσοστό συνδυάζεται με την παχυσαρκία και
την αντίσταση στην ινσουλίνη.(87,88) Το PCOS αποτελεί εκδήλωση του "μεταβολικού
συνδρόμου" και ένα από τα καλύτερα μοντέλα για τη μελέτη της αλληλεπίδρασης
ανάμεσα στον λιπώδη ιστό και τον άξονα υποθάλαμος-υπόφυση-γονάδες.(89)
Όπως ήδη επισημάνθηκε στη μελέτη των Steppan και συν.(22) τα υψηλότερα επίπεδα
mRNA της ρεζιστίνης παρατηρήθηκαν στο γοναδικό και μάλιστα στο περιωοθηκικό
λίπος. Το εύρημα, όμως, αυτό δεν έχει αξιοποιηθεί, μολονότι θα μπορούσε να υποδηλώνει
πιθανή εμπλοκή της ρεζιστίνης στη συμμετοχή των γονάδων στο μεταβολικό σύνδρομο
και στην αντίσταση στην ινσουλίνη, η οποία χαρακτηρίζει το PCOS. Πρόσφατα πειράματα
έδειξαν ότι η έκφραση του γονιδίου της ρεζιστίνης επηρεάζεται και από τα στεροειδή
του φύλου.62 Η πρώτη μελέτη των επιπέδων της ρεζιστίνης στον ορό γυναικών με
PCOS πραγματοποιήθηκε από τη Μονάδα Ενδοκρινολογίας και Ανθρώπινης Αναπαραγωγής
της Β' Μαιευτικής και Γυναικολογικής Κλινικής του Α.Π.Θ. σε συνεργασία με το
Εργαστήριο Βιολογικής Χημείας της Ιατρικής Σχολής του Α.Π.Θ.(37)
Tα επίπεδα της ρεζιστίνης στον ορό γυναικών με PCOS και ΒΜΙ >25kg/m2 βρέθηκαν
σημαντικά αυξημένα σε σύγκριση με εκείνα των γυναικών με PCOS και ΒΜΙ <25kg/m2
και των μαρτύρων. Εντούτοις, δεν παρατηρήθηκε στατιστικά σημαντική διαφορά στα
επίπεδα της ρεζιστίνης ορού ανάμεσα στις λεπτόσωμες γυναίκες με PCOS και στις
μάρτυρες. Επιπλέον, αν και βρέθηκε σημαντική θετική συσχέτιση ανάμεσα στα επίπεδα
της ρεζιστίνης και στον λόγο γλυκόζης/ινσουλίνη ο οποίος αποτελεί έναν ικανοποιητικό
δείκτη της αντίστασης στην ινσουλίνη, η σχέση αυτή δεν ήταν ανεξάρτητη από τον
δείκτη μάζας σώματος, τη μόνη παράμετρο που βρέθηκε να σχετίζεται θετικά και
ανεξάρτητα με τα επίπεδα της ρεζιστίνης στον ορό. Τέλος, δεν διαπιστώθηκε σημαντική
συσχέτιση ανάμεσα στα επίπεδα της ρεζιστίνης και των ανδρογόνων ή των γοναδοτροπινών
στο πλάσμα των γυναικών με PCOS. Τα ευρήματα αυτά συνηγορούν υπέρ της άποψης
ότι η ρεζιστίνη πιθανότατα δεν παίζει ενεργό ρόλο στην αντίσταση στην ινσουλίνη
και την παθογένεια στου PCOS. Επιπλέον, τα αποτελέσματα μελετών, όσον αφορά
στους πολυμορφισμούς του γονιδίου της ρεζιστίνης και τη σχέση τους με την παχυσαρκία
και την αντίσταση στην ινσουλίνη σε γυναίκες με PCOS, ήταν αρνητικά.(81,82)
ΡΕΖΙΣΤΙΝΗ:
ΜΙΑ ΟΡΜΟΝΗ ΠΟΥ ΑΝΤΙΣΤΕΚΕΤΑΙ
Τα ερωτήματα που απομένουν να απαντηθούν είναι πολλά.(90) Τα περισσότερα δεδομένα
για τη ρεζιστίνη προέρχονται από μελέτες σε πειραματόζωα. Δεδομένου ότι ο ενεργειακός
μεταβολισμός, αλλά και η οργάνωση του γονιδίου της ρεζιστίνης(91) διαφέρει ανάμεσα
στους ανθρώπους και στους ποντικούς, τίθεται το ερώτημα εάν η φυσιολογία της
ρεζιστίνης στα ποντίκια αφορά τον ανθρώπινο οργανισμό. Πώς επηρεάζει η ρεζιστίνη
τη μετάδοση του σήματος από την ινσουλίνη; Ποια είναι τα όργανα-στόχοι και οι
ενδοκυττάριοι διαβιβαστές; Υπάρχουν υποδοχείς για τη ρεζιστίνη στον μυϊκό ιστό,
στο ήπαρ και άλλα ινσουλινοευαίσθητα όργανα; Θα μπορούσε η ρεζιστίνη και τα
ανάλογα αυτής (FIZZ) να ευθύνονται για την αντίσταση στην ινσουλίνη που παρατηρείται
σε χρόνιες λοιμώξεις και φλεγμονώδεις καταστάσεις γενικότερα; Υπάρχουν "ιστικά"
συστήματα ρεζιστίνης, ορμονικά δηλαδή μικροκυκλώματα που τροποποιούν τον μεταβολισμό,
χωρίς σημαντικές διακυμάνσεις στα επίπεδα της ρεζιστίνης ορού, όπως συμβαίνει,
για παράδειγμα, με την αγγειοτενσίνη;(92) Πώς αλληλεπιδρά η ρεζιστίνη του περιωοθηκικού
λίπους με τη λειτουργία των γονάδων και ειδικότερα τη στεροειδογένεση;
Επιπλέον, τίθεται το ερώτημα εάν οι ανταγωνιστές της ρεζιστίνης θα αποτελέσουν
δραστικά φάρμακα για την αντιμετώπιση του σακχαρώδη διαβήτη τύπου 2, και εφόσον
ισχύει αυτό, θα είναι αποτελεσματικότερα από τις θειαζολιδινεδιόνες; Αν η ρεζιστίνη
πραγματικά αναστέλλει τη λιπογέννεση, οι ανταγωνιστές της ρεζιστίνης ίσως προκαλέσουν
αύξηση του σωματικού βάρους, όπως άλλωστε συμβαίνει και με τις γλιταζόνες. Έτσι,
το πιθανότερο είναι ότι οι νέες θεραπευτικές αγωγές για την αντίσταση στην ινσουλίνη
θα έχουν ρόλο επικουρικό στην παχυσαρκία, αφού τα κύρια μέτρα παραμένουν η άσκηση
και η απώλεια βάρους.(90)
Προς το παρόν η ρεζιστίνη φαίνεται πως αντιστέκεται στην αποκωδικοποίηση των
πολύπλοκων μηχανισμών με τους οποίους επιδρά στη διαφοροποίηση των λιποκυττάρων
και την ευαισθησία των ιστών στην ινσουλίνη.(93) Στο μέλλον, όμως, η ανακάλυψη
και άλλων πρωτεϊνών που παράγονται από τα λιποκύτταρα, ίσως οδηγήσει στην πληρέστερη
κατανόηση των μηχανισμών με τους οποίους τα κύτταρα του λιπώδους ιστού συντονίζουν
την ενεργειακή μας ισορροπία.(90)
Summary
Farmakiotis D, Roussos D, Kourtis A, Panidis D.
Rezistin: a new adipocytokine.
Hellen Obstet Gynecol 16(1):25-34, 2004
Resistin is a novel adipocytokine, which is considered the possible link between obesity and diabetes mellitus type 2. It has been suggested that resistin might play a part in the pathogenesis of insulin resistance. In this review, the endocrine function of the adipose tissue, resistin and its relative peptides, resistin's distribution in the tissues and resistin's relationship with insulin resistance are described. Moreover, resistin production, its interference with other hormones, its clinical significance concerning its action and resistin gene polymorphism are reffered. Finally, the influence of resistin upon gonads is described.
Key words: resistin, adipose tissue, insuline resistance, diabetes mellitus type 2.
ΒΙΒΛΙΟΓΡΑΦΙΑ
1. Vernon RG, Denis RGP, Sorensen A. Signals of adiposity. Dom An Endocrinol
2001; 21:197-214.
2. King H, Aubert RE, Herman WH. Global burden of diabetes, 1995-2025: prevalence,
numerical estimates, and projections. Diabetes Care 1998; 21:1414-1431.
3. Harris MI, Eastman RC. Early diagnosis of undiagnosed diabetes mellitus:
a US perspective. Diabetes Metabol Res Rev 2000; 16:230-236.
4. Katsilambros N, Aliferis K, Darviri C, Tsapogas P, Alexiou Z, Tritos N, et
al. Evidence for an increase in the prevalence of known diabetes in a sample
of an urban population in Greece. Diab Med 1993; 10:87-90.
5. Davis SN, Granner DK. Insulin, oral hypoglycemic agents and the pharmacology
of the endocrine pancreas. In: Hardman J.G., Molinoff P.B, Ruddon RW, Gilman
AG, eds. Goodman & Gilman's The Pharmacological Basis of Therapeutics. 10th
edition, NewYork: McGraw Hill, 1996:1487-1517.
6. Senior K. Resistin links obesity to type 2 diabetes. Lancet 2001; 357:202.
7. Steppan CM, Lazar MA. Resistin and obesity-associated insulin resistance.
Trends Endocrinol Metabol 2002; 13:18-22.
8. Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional
cloning of the mouse obese gene and its human homologue. Nature 1994; 372:425-432.
9. Friedman JM, Halaas JL. Leptin and the regulation of body weight in mammals.
Nature 1998; 395:763-770.
10. Flier JS. what's in a name? In search of leptin's physiologic role. J Clin
Endocrinol Metabol 1998; 83:1407-1413.
11. Ahima RS, Flier JS. Leptin. Annu Rev Physiol 2000; 62:413-437.
12. Cohen B, Novick D, Rubinstein M. Modulation of insulin activities by leptin.
Science 1996; 274:1185-1188.
13. Rossetti L, Massillon D, Barzilai N, Vuguin P, Chen W, Hawkins M, et al.
Short term effects of leptin on hepatic gluconeogenesis and in-vivo insulin
action. J Biol Chem 1997; 272:27758-27763.
14. Waters M. Human leptine: from an adipocyte hormone to an endocrine mediator.
Eur J Endocrinol 2000; 143:293-311.
15. Ahima RS, Flier JS. Adipose Tissue as an Endocrine Organ. Trends Edocrinol
Metabol 2000; 11:327-332.
16. Golay A, Chen YD, Reaven GM. Effects of differences in glucose tolerance
on insulin's ability to regulate carbohydrate and free fatty acid metabolism
in obese individuals. J Clin Endocrinol Metab 1986; 62:1081-1088.
17. Ukkola O. Resistin-a mediator of obesity-associated insulin resistance or
an innocent bystander? Eur J Endocrinol 2002; 147:571-4.
18. Cook KS, Groves DL, Min HY, Spiegelman BM. A developmentally regulated mRNA
from 3T3 adipocytes encodes a novel serine protease homologue. Proc Natl Acad
Sci USA 1985; 82:6480-6484.
19. Scherer PE, Williams S, Fogliano M, Baldini G, Lodish HF. A novel serum
protein similar to C1q, produced exclusively in adipocytes. J Biol Chem 1995;
270:26746-26749.
20. Berg AH, Combs TP, Scherer PE. ACRP30/Adiponectin: an adipokine regulating
glucose and lipid metabolism. Trends Endocrinol Metabol 2002; 13:84-89.
21. Tsao TS, Lodish HF, Fruebis J. ACRP30, a new hormone controlling fat and
glucose metabolism. Eur J Pharmacol 2002; 440:213-221.
22. Steppan CM, Bailey ST, Bhat S, Brown EJ, Banerjee RR, Wright CM, et al.
The hormone resistin links obesity to diabetes. Nature 2001; 409:307-312.
23. Hotamisligil G, Shargill NS, Spiegelman BM. Adipose expression of tumor
necrosis factor alpha: direct role in obesity-linked insulin resistance. Science
1993; 259:87-91.
24. Mohamed-Ali V, Goodrick S, Rawesh A, Katz DR, Miles JM, Yudkin JS, et al.
Subcutaneous adipose tissue releases interleukin-6, but not tumor necrosis factor-α
in vivo. J Clin Endocrinol Metabol 1997; 82:4196-4200.
25. Bastard J, Jardel C, Brucket E, Blondy P, Capeau J, Laville M, et al. Elevated
levels of interleukin 6 are reduced in serum and subcutaneous adipose tissue
of obese women after weight loss. J Clin Endocrinol Metabol 2000; 85:3338-3342.
26. Holcomb IN, Kabakoff RC, Chan B, Baker TW, Gurney A, Henzel W, et al. FIZZ1,
a novel cystein-rich secreted protein associated with pulmonary inflammation
defines a new gene family. EMBO J 2000; 19:4046-4055.
27. Banerjee RR, Lazar MA. Dimerization of resistin and resistin-like molecules
is determined by a single cysteine. J Biol Chem 2001; 276:25970-25973.
28. Kim KH, Lee K, Soo Y, Moon YS, Sul HS. A cysteine-rich adipocyte tissue-specific
secretory factor inhibits adipocyte differentiation. J Biol Chem 2001; 276:1152-1156.
29. Steppan CM, Brown EJ, Wright CM, Bhat S, Banerjee RR, Dai CY, et al. A family
of tissue-specific resistin-like molecules. Proc Natl Acad Sci USA 2001; 98:502-506.
30. Chen J, Wang L, Boeg YS, Xia B, Wang J. Differential dimerization and association
among resistin family proteins with implications for functional specificity.
J Endocrinol 2002; 175:499-504.
31. Viengchareun S, Zennaro MC, Pascual-Le Tallec L, Lombes M. Brown adipocytes
are novel sites of expression and regulation of adiponectin and resistin. FEBS
Lett 2002; 532:345-350.
32. Yura S, Sagawa N, Itoh H, Kakui K, Nuamah MA, Korita D, et al. Resistin
is expressed in the human placenta. J Clin Endocrinol Metabol 2003; 88:1394-1397.
33. Dunaif A. Molecular mechanisms of insulin resistance in the polycystic ovary
syndrome. Semin Reprod Endrocrinol 1994; 12:15-20.
34. McTernan CL, McTernan PG, Harte AL, Levick PL, Barnett AH, Kumar S. Resistin,
central obesity, and type 2 diabetes. Lancet 2002; 359:46-47.
35. McTernan PG, McTernan CL, Chetty R, Jenner K, Fisher FM, Laurer MN, et al.
Increased resistin gene and protein expression in human abdominal adipose tissue.
J Clin Endocrinol Metabol 2002; 87:2407-2410.
36. Zhang J, Qin Y, Zheng X, Qiu J, Gong L, Mao H. The relationship between
human serum resistin level and body fat content, plasma glucose as well as blood
pressure. Zhongua Yi Xue Za Zhi 2003; 82:1609-1612.
37. Panidis D, Koliakos G, Kourtis A, Farmakiotis D, Mouslech T, Rousso D. Serum
resistin levels in women with PCOS. Fertil Steril 2003; in press.
38. Yannakoulia M, Yiannakouris N, Bluher S, Matalas AL, Klimis-Zacas D, Mantzoros
C. Body fat mass and macronutritient intake in relation to circulating soluble
leptin receptor, free leptin index, adiponectin and resisitn concentrations
in healthy humans. J Clin Endocrinol Metabol 2003; 88:1730-1736.
39. Nagaev I, Smith U. Insulin resistance and type 2 diabetes are not related
to resistin expression in human fat cells or skeletal muscle. Biochem Biophys
Res Commun 2001; 285:561-564.
40. Savage DB, Sewter CP, Klenk ES, Segal DG, Puig AV, et al. Resistin / Fizz3
Expression in Relation to Obesity and Peroxisome Proliferator-Activated Receptor-γ.
Diabetes 2001; 50:2199-2202.
41. Fain JN, Cheema PS, Bahouth SW, Lloyd Hiler M. Resistin release by human
adipose tissue explants in primary culture. Biochem Biophys Res Commun 2003;
300:674-678.
42. Hotamisligil GS, Arner P, Caro JF, Atkinson RL, Spiegelman BM. Increased
adipose tissue expression of tumor necrosis factor-alpha in human obesity and
insulin resistance. J Clin Invest 1995; 95:2409-2415.
43. Montague CT, Prins JB, Sanders L, Digby JE, O'Rahilly S. Depot and sex-specific
differences in human leptin mRNA expression: implications for the control of
regional fat distribution. Diabetes 1997; 46:342-347.
44. Combs TP, Berg AH, Rajala MW, Klebanov S, Iyengar P, Jimenez-Chillaron JC,
et al. Sexual differentiation, pregnancy, calorie restriction and aging affect
the adipocyte-specific protein adiponectin Diabetes 2003; 52:268-276.
45. Janke J, Engeli S, Gorzelniak K, Luft FC, Sharma AM. Resistin gene expression
in human adipocytes is not related to insulin resistance. Obes Res 2002; 10:1-5.
46. Patel L, Buckels AC, Kinghorn IJ, Murdock PR, Holbrook JD, Plumpton C. Resistin
is expressed in human macrophages and directly regulated by PPARgamma activators.
Biochem Biophys Res Commun 2003; 300:472-476.
47. Χαρσούλης Φ. Εισαγωγή στην Ενδοκρινολογία. Στο: Τομέας Παθολογίας Ιατρικής
Σχολής Α.Π.Θ. (εκδ.) Εσωτερική Παθολογία-Τόμος Β΄. Θεσσαλονίκη: University Studio
Press, 1998:939.
48. Hartman HB, Hu X, Tyler KK, Dalal CK, Lazar MA. Mechanisms regulating adipocyte
expression of resistin. J Biol Chem 2002; 277:19754-19761.
49. Moore GB, Chapman H, Holder JC, Lister CA, Piercy V, Smith SA, et al. Differential
regulation of adipocytokine mRNAs by rosiglitazone in db/db mice. Biochem Biophys
Res Commun 2001; 286:735-741.
50. Haugen F, Jorgensen A, Drevon CA, Trayhurn P. Inhibition by insulin of resistin
gene expression in 3T3-L1 adipocytes. FEBS Letters 2001; 507:105-108.
51. Li Y, Lazar MA. Differential gene regulation by PPARgamma agonist and constitutively
active PPARgamma2. Mol Endocrinol 2002; 16:1040-1048.
52. Shojima N, Sakoda H, Ogihara T, Fujishiro M, Katagiri H, Anai M, et al.
Humoral regulation of resistin gene expression in 3T3-L1 and mouse adipose cells.
Diabetes 2002; 51:1737-1741.
53. Way JM, Gorgun CZ, Tong Q, Uysal KT, Brown KK, Harrington WW, et al. Adipose
tissue resistin gene expression is severely suppressed in obesity and stimulated
by peroxisome proliferators-activated receptor gamma agonists. J Biol Chem 2001;
276:25651-25653.
54. Juan CC, Au LC, Fang VS, Kang SE, Ko YH, Kuo SF, et al. Suppressed gene
expression of adipocyte resistin in an insulin-resistant rat model probably
by elevated free fatty acids. Biochem Biophys Res Commun 2001; 289:1328-13233.
55. Fasshauer M, Klein J, Neumann S, Eszlinger M, Paschke R. Isoproterenol inhibits
resistin gene expression through a G(S)-protein-coupled pathway in 3T3-L1 adipocytes.
FEBS Lett 2001; 500:60-63.
56. Maritnez JA, Margareto J, Marti A, Milagro FI, Larrate E, Moreno Aliaga
MJ. Resistin over-expression is induced by a beta-3 adrenergic agonist in diet-related
over-weightiness. J Physiol Biochem 2001; 57:287-288.
57. Fasshauer M, Klein J, Neumann S, Eszlinger M, Paschke R. Tumor necrosis
factor alpha is a negative regulator of resistin gene expression and secretion
in 3T3-L1 adipocytes. Biochem Biophys Res Commun 2001; 288:1027-1031.
58. Levy JR, Davenport B, Clore JN, Stevens W. Lipid metabolism and resistin
gene expression in insulin-resistant Fischer 344 rats. Am J Physiol Endocrinol
Metabol 2002; 282:E626-E633.
59. Zhong Q, Lin CY, Clarke KJ, Kempainnen RJ, Schwarz DD, Judd RL. Endothelin-1
inhibits resistin expression in 3T3 adipocytes. Biochem Biophys Res Commun 2002;
296:383-387.
60. Delhanty PJ, Mesotten D, McDougall F, Baxter RC. Growth hormone rapidly
induces resistin gene expression in white adipose tissue of spontaneous dwarf
(SDR) rats. Endocrinology 2002; 143:2445-2448.
61. Yuzuriha H, Inui A, Goto K, Asakawa A, Fujimiya M, Kasuga M. Intracerebroventricular
administration of NPY stimulates resistin gene expression in mice. Int J Mol
Med 2003; 11:675-676.
62. Nogueiras R, Gualilo O, Caminos JE, Casanueva FF, Diaguez C. Regulation
of resistin by gonadal, thyroid hormone and nutritional status. Obes Res 2003;
11:408-414.
63. Mathaei S, Stumvoll M, Kellerer M, Haring HU. Pathophysiology and Pharmacological
Treatment of Insulin Resistance. Endoc Rev 2000; 21:585-618.
64. Σαραφίδης Π, Λαζαρίδης Α, Τουρκαντώνης Α. Το παθοφυσιολογικό υπόβαθρο του
μεταβολικού συνδρόμου: Η λειτουργική σύνδεση της αντίστασης στην ινσουλίνη με
το σακχαρώδη διαβήτη τύπου 2, τη δυσλιπιδαιμία και την κεντρική παχυσαρκία.
Αρτηριακή Υπέρταση 2000; 9:101-123.
65. Goldstein BJ. Insulin Resistance as the Core Defect in Type 2 Diabetes Mellitus.
Am J Cardiol 2002; 90(S):3G-10G.
66. Yki-Jarvinen H. Glucose toxicity. Endoc Rev 1992; 13:415-431.
67. Bailey CJ. Biguanides and NIDDM. Diabetes Care 1992; 15:755-772.
68. Schoonjans K, Auwerx J. Thiazolidinediones: an update. Lancet 2000; 355:1008-1010.
69. Stumvoll M, Haring HU. Glitazones: Clinical effects and molecular mechanisms.
Ann Med 2002; 34:217-224.
70. Finegood DT, McArthur MD, Kojwang D, Thomas MJ, Topp BG, Leonard T, et al.
Cell mass dynamics in Zucker diabetic fatty rats: rosiglitazone prevents the
rise in net cell death. Diabetes 2001; 50:1021-1029.
71. Vamecq J, Latruffe N. Medical significance of peroxisome proliferator-activated
receptors. Lancet 1999; 354:141-148.
72. Desvergne B, Wahli W. Peroxisome proliferators-activated receptors: nuclear
control of metabolism. Endoc Rev 1999; 20:649-688.
73. Akiyama TE, Nikol CJ, Gonzalez FJ. On par with PPARs. Trends in Genetics
2001; 17:310-312.
74. Kubota N, et al. PPARγ mediates high-fat diet-induced adipocyte hypertrophy
and insulin resistance. Mol Cell 1999; 4:597-609.
75. Camp HS, Ren D, Leff T. Adipogenesis and fat-cell function in obesity and
diabetes. Trends Mol Med 2002; 8:442-446.
76. Cao H, Hegele RA. Single nucleotide polymorphism of the resistin (RSTN)
gene. J Hum Genet 2001; 46:553-555.
77. Osawa H, Onuma H, Murakami A, Ochi M, Nishima T, Kao K, et al. Systemic
search for single nucleotide polymorphisms in the resistin gene. The absence
of evidence for the association of three identified single nucleotide polymorphisms
with Japanese type 2 diabetes. Diabetes 2002; 51:863-866.
78. Sentinelli F, Romeo S, Arca M, Filippi E, Leonetti F, Banchieri M, et al.
Human resistin gene, obesity and type 2 diabetes. Mutation analysis and population
study. Diabetes 2002; 51:1992.
79. Pizzuti A, Argiolas A, Di Paola R, Baratta R, Rauseo A, Bozzali M, et al.
An ATG repeat in the 3' untranslated region of the human resistin gene is associated
with a decreased risk of insulin resistance. J Clin Endocrinol Metabol 2002;
87:4403-4406.
80. Wang H, Chu WS, Hemphill C, Elbein SC. Human resistin gene: molecular scanning
and evaluation of association with insulin sensitivity and type 2 diabetes in
Caucasians. J Clin Endocrinol Metabol 2002; 87:2520-2524.
81. Urbanek M, Du V, Silander K, Collins FS, Steppan CM, Strauss III JF, et
al. Variation in resistin gene promoter not associated with polycystic ovary
syndrome. Diabetes 2003; 52:214-217.
82. Xita N, Georgiou I, Kourtis A, Koukouvitis A, Tsatsoulis A, et al. Association
of resistin gene variant with BMI in PCOS. P-119 in the 30th Balkan Congress
of Endocrinology / 12th Panhellenic Congress of Endocrinology and Metabolism,
Thessaloniki, Greece, May 21-25, 2003. Book of Abstracts: p. 118.
83. Engert JC, Vohl MC, Williams SM, Lepage P, Loredo-Osti JC, Faith J, et al.
5΄-flanking variants of resistin are associated with obesity. Diabetes 2002;
51:1629-1634.
84. Ma X, Warram JH, Trischitta V, Doria A. Genetic variants at the resistin
locus and the risk of type 2 diabetes in Caucasians. J Clin Endocrinol Metabol
2002; 87:4407-4410.
85. Tan MS, Chang SY, Chang DM, Tsai JC, Lee YJ. Association of resistin gene
3-untranslated region +62GΰA polymorphism with type 2 diabetes and hypertension
in a Chinese population. J Clin Endocrinol Metabol 2003; 88:1258-1263.
86. Deeb SS, Fajas L, Nemoto M, Pihlajamaki J, Mykkanen L, Kuusisto J, et al.
A Pro12Ala substitution in PPARg2 associated with decreased receptor activity,
lower body mass index and improved insulin sensitivity. Nat Genet 1998; 20:284-287.
87. Franks S. Polycystic ovary syndrome. N Engl J Med 1995; 333:853-861.
88. Πανίδης Δ. Το Σύνδρομο των Πολυκυστικών Ωοθηκών. Ασπροβάλτα: Εκδόσεις "Μέλισσα"
1991.
89. Sharpe RM, Franks S. Environment, lifestyle and infertility - an inter-generational
issue. Nat Med 2002; 8(SI):s33-40.
90. Schuldiner AR, Yang R, Gong DW. Resistin, obesity and insulin resistance-the
emerging role of the adipocyte as an endocrine organ. N Engl J Med 2001; 345:1345-1346.
91. Ghosh S, Singh AK, Aruna B, Mukhopadhyay S, Ethesham NZ. The genomic organization
of mouse resistin reveals major differences from the human resistin: functional
implications. Gene 2003; 305:27-34.
92. Burnier M, Brunner HR. Angiotensin II receptor antagonists. Lancet 2000;
355:637-643.
93. Hotamisligil GS. The irresistible biology of resistin. J Clin Invest 2003;
2:173-174.