
Αντιμετώπιση
των μη σεμινωματωδών
καρκίνων όρχεως
A' ΜΕΡΟΣ
GRAME STEELE,
MBBCh, FCS, JEROME RICHIE MD, FACS
Brigham and Women's Hospital and Harvard Medical School
Digital Urology Journal
Mετάφραση: ΧΡΗΣΤΟΣ ΠΑΠΑΝΔΡΕΟΥ
Παρά το γεγονός ότι ο καρκίνος
των όρχεων αποτελεί μόνο το 1% όλων των κακοηθειών στους άνδρες, είναι η συχνότερη
κακοήθεια που προσβάλλει τους άνδρες μεταξύ 15 και 35 ετών. Ο τρόπος αντιμετώπισης
των όγκων από βλαστικά κύτταρα (GCT) των όρχεων έχει αποδειχτεί ότι αποτελεί
πρότυπο επιτυχίας σε ό,τι αφορά τους συμπαγείς όγκους. Αυτό οφείλεται στην καταπληκτική
πρόοδο κατά τη διάρκεια των τελευταίων δύο δεκαετιών, που άλλαξε την μέχρι τότε
κακή πρόγνωση των ασθενών με προχωρημένη νόσο[1]. Ο καρκίνος των όρχεων έχει
γίνει ένας από τους περισσότερο θεραπεύσιμους συμπαγείς όγκους. Τριάντα χρόνια
πριν, ενοχοποιούνταν για το 11.4% των θανάτων από καρκίνο στην ηλικία μεταξύ
25-34 ετών, με συνολικό ποσοστό πενταετούς επιβίωσης 64%[2].
Το πιο πρόσφατο ποσοστό πενταετούς επιβίωσης για το GCT που έχει αναφερθεί στις
ΗΠΑ, υπερβαίνει το 90%[3]. Τα βελτιωμένα αυτά ποσοστά σχετίζονται με την καλύτερη
κατανόηση της φυσικής ιστορίας του καρκίνου των όρχεων, τις βελτιωμένες μεθόδους
σταδιοποίησης και τις χειρουργικές τεχνικές, καθώς, επίσης, και με την εφαρμογή
της αποτελεσματικής, βασιζόμενης στην πλατίνη, συνδυασμένης χημειοθεραπείας[4].
Οι τροποποιήσεις στη χειρουργική αντιμετώπιση έχουν ελαττώσει σημαντικά τη νοσηρότητα,
σε σχέση με την κλασική, πλήρη, αμφοτερόπλευρη λεμφαδενεκτομή. Οι τροποποιημένες
(σχήμα) λεμφαδενεκτομές και η διατήρηση του συμπαθητικού πλέγματος (nerve sparing
technique) εφαρμόζονται σήμερα ως ρουτίνα, σε χαμηλού σταδίου, μη σεμινωματώδεις
όγκους από βλαστικά κύτταρα (NSGCT), παρέχοντας στον ασθενή το όφελος της ακριβούς
παθολογοανατομικής σταδιοποίησης, σε συνδυασμό με μειωμένη νοσηρότητα. Επιπρόσθετα,
οι nerve-sparing τεχνικές χρησιμοποιούνται για την εκτομή υπολειμματικής νόσου
μετά από χημειοθεραπεία[5].
Στο κεφάλαιο της χημειοθεραπείας, για τον GCT έχει σημειωθεί πολύ μεγάλη πρόοδος
κατά τη διάρκεια των προηγούμενων δεκαετιών. Στη δεκαετία του 1960, περιγράφτηκε
η πρώτη σημαντική πρόοδος στο μεταστατικό NSGCT: ο συνδυασμός χλωραμβουκίλης,
μεθοτρεξάτης και δακτινομυκίνης παρουσίασε 30% ποσοστό ανταπόκρισης[6].
Στη δεκαετία του 1970, συνδυασμένες θεραπείες όπως βινβλαστίνη και μπλεομυκίνη
έδωσαν ποσοστά 57% πλήρους ανταπόκρισης και 45% μακράς διάρκειας επιβίωσης χωρίς
νόσο[7].
Η ανακάλυψη της σισπλατίνης ως ένα πολύ αποτελεσματικό αντινεοπλαστικό παράγοντα
το 1965[8] και η χρήση της αργότερα στο GCT, ήταν μια ακόμα σημαντική πρόοδος.
Το 1974, ο συνδυασμός σισπλατίνης, βινβλαστίνης και μπλεομυκίνης εξετάστηκε
από την ομάδα της Indiana[9]. Από τους 47 ασθενείς στη φάση ΙΙ της μελέτης,
ανταπόκριση επιτεύχθηκε σε ποσοστό 100%. Τριανταπέντε ασθενείς (ποσοστό 74%)
παρουσίασαν πλήρη υποχώρηση, ενώ οι υπόλοιποι μερική υποχώρηση της νόσου. Το
1983, ο συνδυασμός μπλεομυκίνης, ετοποσίδης και σισπλατίνης (BEP) περιγράφτηκε
πρώτα από ομάδα ερευνητών στο Royal Marsden Hospital[10]. Αυτός ο συνδυασμός
συγκρίθηκε αργότερα σε τυχαιοποιημένες μελέτες, με το συνδυασμό σισπλατίνης,
βινπλαστίνης και μπλεομυκίνης (PVB) και βρέθηκε ότι είναι και οι δύο, λιγότερο
τοξικοί και περισσότερο αποτελεσματικοί. Η χρήση του ΒΕP αποτέλεσε ορόσημο στη
θεραπεία του GCT των όρχεων και χρησιμοποιείται ευρέως στη θεραπεία της μεταστατικής
νόσου[11-13].
Από το τέλος της δεκαετίας του '80, έχει γίνει η διάκριση μεταξύ της νόσου χαμηλού
κινδύνου (καλής πρόγνωσης) και νόσου υψηλού κινδύνου (φτωχής πρόγνωσης)[14,15].
Στους ασθενείς χαμηλού κινδύνου, σκοπός είναι η μείωση της τοξικότητας της θεραπείας,
με παράλληλη επίτευξη υψηλών ποσοστών πλήρους ανταπόκρισης. Από την άποψη αυτή,
τρεις κύκλοι BEP βρέθηκε ότι είναι τόσο αποτελεσματικοί, όσο τέσσερις κύκλοι
σε ασθενείς χαμηλού κινδύνου[14]. Από την άλλη, οι μελέτες σε ασθενείς υψηλού
σταδίου έχουν εστιαστεί στη βελτίωση της επιβίωσης και των ποσοστών ανταπόκρισης.
Πολυάριθμες μελέτες φάσης ΙΙ και ΙΙΙ δεν έχουν οδηγήσει σε πολύ σημαντική βελτίωση
της πρόγνωσης σε ασθενείς υψηλού κινδύνου, οι οποίοι ευτυχώς σπάνια συναντώνται
σήμερα[16-17].


Αρχές χειρουργικής
αντιμετώπισης του καρκίνου όρχεως
Οι αρχές που διέπουν τη μοντέρνα χειρουργική θεραπεία βασίζονται στο γεγονός
ότι ο καρκίνος των όρχεων επεκτείνεται προβλέψιμα και βαθμιαία, με εξαίρεση
το χοριοκαρκίνωμα.
Ο σπερματικός τόνος περιέχει τέσσερα έως οκτώ λεμφικά κανάλια, τα οποία ανέρχονται
στον οπισθοπεριτοναϊκό χώρο και εκβάλλουν προς τα έσω στην οπισθοπεριτοναϊκή
λεμφική άλυσο.
Η λεμφαδενική παροχέτευση του δεξιού όρχεως ιεραρχικά εντοπίζεται πρώτα στην
περιοχή μεταξύ αορτής και κάτω κοίλης φλέβας, στο ύψος του 2ου οσφυϊκού σπονδύλου,
ενώ του αριστερού όρχεως εντοπίζεται στην αριστερή παραορτική περιοχή, που ορίζεται
από τη νεφρική φλέβα προς τα άνω, την αορτή προς τα έσω, τον ουρητήρα προς τα
έξω και την έκφυση της κάτω μεσεντέριας αρτηρίας προς τα κάτω.
Μετά την αρχική διασπορά στις παραπάνω περιοχές, δεξιά ή αριστερή επέκταση μπορεί
να γίνει στη συνέχεια κατιόντως στους κοινούς λαγόνιους, έξω λαγόνιους και βουβωνικούς
λεμφαδένες, ή ανιόντως δια του θωρακικού πόρου στους υπερκλείδιους λεμφαδένες.
Παρά την προβλεψιμότητα των λεμφαδενικών μεταστάσεων στον καρκίνο των όρχεων,
το ποσοστό αποτυχίας είναι 5%, με ύπαρξη απομακρυσμένων μεταστάσεων μετά από
αρνητική οπισθοπεριτοναϊκή λεμφαδενεκτομή (RPL)[18].
Αυτό, πιθανόν να οφείλεται στο ότι τα λεμφαγγεία των όρχεων μπορεί να παρακάμπτουν
τους οπισθοπεριτοναϊκούς λεμφαδένες και να επικοινωνούν κατευθείαν με το θωρακικό
πόρο. Τα λεμφαγγεία της επιδιδυμίδας παροχετεύουν στους έξω λαγόνιους λεμφαδένες
και ως εκ τούτου, σε τοπικά προχωρημένη νόσο, η προσβολή της επιδιδυμίδας συνοδεύεται
με θετικούς πυελικούς λεμφαδένες.
Ο καρκίνος του όρχεως που διηθεί το όσχεο μπορεί να έχει ως συνέπεια μεταστάσεις
στους βουβωνικούς λεμφαδένες.
Η οσχεϊκή προσπέλαση για την αφαίρεση του καρκίνου του όρχεως έχει γενικά καταδικαστεί
ως επιβαρυντική για την πρόγνωση των ασθενών και για αυτό το λόγο, η βουβωνική
ορχεκτομή με υψηλή απολίνωση του σπερματικού τόνου, αποτελεί την καθιερωμένη
θεραπεία για την αρχική αντιμετώπιση του καρκίνου όρχεως για σχεδόν 100 χρόνια[20].
Εν τούτοις, σε πρόσφατη ανασκόπηση αναφορικά με τις επιπτώσεις της παραβίασης
του οσχέου στον καρκίνο του όρχεως των Capeluto και συν, σε μεταανάλυση 1.182
ασθενών, βρέθηκε ότι υπήρξε παραβίαση σε 206 ασθενείς, ενώ δε βρέθηκε στατιστικώς
σημαντική διαφορά στην επιβίωση ή την απομακρυσμένη υποτροπή, υποδηλώνοντας
ότι η παραβίαση του οσχέου πιθανόν δεν συνεπάγεται απαραίτητα χειρότερη πρόγνωση.
Απομακρυσμένες μεταστάσεις στον καρκίνο του όρχεως εντοπίζονται συχνότερα στους
πνεύμονες. Ακολουθούν ήπαρ, σπλάχνα, εγκέφαλος και οστά, με τις οστικές μεταστάσεις
να απαντώνται αργότερα στην πορεία της νόσου[21].
Συμπερασματικά, με την αξιοσημείωτη εξαίρεση της περίπτωσης του χοριοκαρκινώματος,
ο καρκίνος του όρχεως διασπείρεται γενικά κατά προβλέψιμο τρόπο. Αυτό έχει οδηγήσει
στην ανάπτυξη νέων χειρουργικών τεχνικών, οι οποίες παρέχουν ακριβή παθολογοανατομική
σταδιοποίηση και ταυτόχρονα θεραπευτικό όφελος. Αυτές οι τεχνικές, επίσης, συνοδεύονται
από μικρότερη νοσηρότητα, συγκρινόμενες με την κλασική πλήρη οπισθοπεριτοναϊκή
λεμφαδενεκτομή (RPL).
Πρόβλεψη πιθανής
μετάστασης
Γενικά, η επίπτωση των μικρομεταστάσεων στους οπισθοπεριτοναϊκούς λεμφαδένες,
σε ασθενείς κλινικού σταδίου I NSGCT, είναι 20-30%.
Επίσης, μελέτες παρακολούθησης αυτών των ασθενών έχουν δείξει ότι σπλαχνικές
μεταστάσεις εμφανίζονται σε ποσοστό περίπου 10%. Ως εκ τούτου, θεωρητικά, περίπου
το 70% των ασθενών με NSGCT κλινικού σταδίου Ι θα μπορούσαν να θεραπευτούν με
ριζική ορχεκτομή μόνο. Μελέτες με σκοπό την απάντηση αυτού του διλήμματος ξεκίνησαν
στη Μ. Βρετανία το 1979 και τη Δανία το 1980[22,23].
Αυτές οι μελέτες έδειξαν ότι το ποσοστό υποτροπής μετά από ορχεκτομή μόνο, ήταν
περίπου 30%. Περισσότερο από το 90% των υποτροπών εμφανίζεται μέσα στα 2 πρώτα
χρόνια μετά την ορχεκτομή, με μέσο χρόνο υποτροπής τους 4-5 μήνες.
Το 50% των υποτροπών συμβαίνει στον οπισθοπεριτοναϊκό χώρο και το 30% των υποτροπών
δε συνοδεύεται από αύξηση των καρκινικών δεικτών. Το 1/3 των υποτροπών εμφανίζεται
στους πνεύμονες, ενώ σε ποσοστό 12%, η αύξηση των καρκινικών δεικτών είναι η
μόνη ένδειξη υποτροπής του όγκου.
Διάφορες μελέτες έχουν διερευνήσει τους προγνωστικούς παράγοντες υποτροπής.
Μελέτη που έγινε στη Μ. Βρετανία περιέγραψε 4 προγνωστικούς παράγοντες24: την
αγγειακή διήθηση, τη λεμφική διήθηση, την παρουσία εμβρυϊκού καρκινώματος και
την απουσία όγκου λεκιθικού ασκού. Ασθενείς με 4 θετικούς προγνωστικούς παράγοντες
βρέθηκε να έχουν 46% κίνδυνο υποτροπής, 21% αυτοί με 2 θετικούς προγνωστικούς
παράγοντες και 16% αυτοί με 1 παράγοντα. Καμία υποτροπή δεν παρουσιάστηκε στους
ασθενείς χωρίς παράγοντες κινδύνου[25]. Επιπρόσθετα, η έκταση του πρωτοπαθούς
όγκου έχει προγνωστική σημασία4. Ο NSGCT κλινικού σταδίου Ι, επομένως, δεν αντιμετωπίζεται
πια ως ομοιογενής νόσος, αλλά η θεραπεία πρέπει να εξατομικεύεται ανάλογα με
την πιθανότητα ύπαρξης θετικών οπισθοπεριτοναϊκών λεμφαδένων.
Για τους ασθενείς χαμηλού κινδύνου ύπαρξης διηθημένων λεμφαδένων, υπάρχει η
επιλογή της ένταξης σε πρωτόκολλο παρατήρησης και αποφυγής της νοσηρότητας που
συνεπάγεται η επικουρική θεραπεία. Εν τούτοις, παρά τα προγνωστικά κριτήρια,
δεν είναι ακόμη εφικτός ο ακριβής διαχωρισμός των ασθενών που πρέπει, από αυτούς
που δεν πρέπει να λάβουν επικουρική θεραπεία.
Σε πρόσφατη έρευνα στην οποία μελετήθηκε προοπτικά η έκβαση των ασθενών με στάδιο
Ι NSGCT, βρέθηκε ότι μετά από μέσο χρόνο παρακολούθησης τα 11,3 χρόνια, το 74,3%
των ασθενών παρέμεινε ελεύθερο νόσου, ενώ το υπόλοιπο εμφάνισε υποτροπή. Όλες
οι υποτροπές εμφανίστηκαν μέσα σε 2 χρόνια και ο μέσος χρόνος υποτροπής ήταν
5 μήνες. Σημαντικοί δείκτες υποτροπής κατά τη διάρκεια της επιτήρησης ήταν ο
επικρατών ιστολογικός τύπος εμβρυϊκού καρκινώματος και η αγγειακή διήθηση. Σε
ασθενείς που δεν είχαν κανένα από αυτούς τους παράγοντες κινδύνου, το ποσοστό
υποτροπής ήταν 12%, ενώ κανείς από αυτούς τους ασθενείς δεν κατέληξε από τη
νόσο του[26].
Σταδιοποίηση
του καρκίνου του όρχεως
Υπάρχουν τόσο κλινικά, όσο και παθολογοανατομικά συστήματα σταδιοποίησης για
το NSGCT (πίνακες 1 και 2).
Τα περισσότερα συστήματα που χρησιμοποιούνται σήμερα αποτελούν παραλλαγές του
συστήματος που προτάθηκε από τους Boden και Gibb το 195127. H νόσος χαμηλού
σταδίου αναφέρεται στο κλινικό στάδιο Ι (Α) και ΙΙΑ (Β1), ενώ η νόσος υψηλού
σταδίου περιλαμβάνει τα στάδια ΙΙΒ (Β2), ΙIC (B3) και III (C). Aυτή η διάκριση
μεταξύ χαμηλού και υψηλού σταδίου είναι σημαντική, γιατί καθορίζει σε μεγάλο
βαθμό την επικουρική θεραπεία του ασθενούς. Ενώ η κλινική σταδιοποίηση βασίζεται
κυρίως στην αξονική τομογραφία και στην ακτινογραφία θώρακα, η παθολογοανατομική
βασίζεται στα χειρουργικά παρασκευάσματα και ευρήματα που αποκτώνται από τη
ριζική ορχεκτομή και οπισθοπεριτοναϊκή λεμφαδενεκτομή. Έτσι, το λάθος στη σταδιοποίηση,
που σχετίζεται με την κλινική σταδιοποίηση καλύπτεται από την αντίστοιχη παθολογοανατομική.
Οπισθοπεριτοναϊκή
λεμφαδενεκτομή (RPL) σε καρκίνο όρχεων από βλαστικά κύτταρα
RPL-I: Η εκτομή αυτή εκτελείται σε ασθενείς χωρίς κλινικά σημεία διασποράς στον
οπισθοπεριτοναϊκό χώρο και μη ορατή χειρουργικά νόσο (όπως στο κλινικό στάδιο
Ι). Η εφαρμοζόμενη χειρουργική τεχνική μπορεί είναι nerve sparing και γίνεται
εντός των ορίων που απεικονίζονται στο σχήμα 1. Επομένως, τα συμπαθητικά νεύρα
που είναι υπεύθυνα για την εκσπερμάτιση διατηρούνται, με αποτέλεσμα τη φυσιολογική
εκσπερματιστική λειτουργία σχεδόν σε όλους τους ασθενείς που υποβάλλονται στη
RPL-I.
RPL-II: Η επέμβαση αυτή εκτελείται σε ασθενείς με μικρό όγκο, κλινικά επιβεβαιωμένης
νόσου ή σε ασθενείς με ορατή νόσο κατά τη διάρκεια του χειρουργείου, όπως στα
κλινικά στάδια ΙΙΑ ή ΙΙΒ. Τα χειρουργικά όρια είναι γενικά ευρύτερα από ότι
στην RPL-I. Τα οσφυϊκά συμπαθητικά και υπογάστρια πλέγματα διατηρούνται προσεκτικά,
έχοντας ως αποτέλεσμα, σε έμπειρα χέρια, τη διατήρηση της εκσπερμάτισης σε ποσοστό
πάνω από 95% των ασθενών.
RPL-III: Η επέμβαση αυτή εκτελείται στους ασθενείς, στους οποίους έχει αποτύχει
η πρωταρχική θεραπεία -χημειοθεραπεία ή οπισθοπεριτοναϊκή λεμφαδενεκτομή- και
οι οποίοι είτε παρουσιάζουν υποτροπή οπισθοπεριτοναϊκά, είτε παραμένουσα μάζα
διαπιστωμένη συνήθως με CT scan. Σε επιλεγμένες περιπτώσεις μπορεί να εφαρμοστούν
nerve sparing τεχνικές.
Αντιμετώπιση
του κλινικού σταδίου Ι
Επιτήρηση έναντι (versus)
επικουρικής θεραπείας.
Η απόφαση να τεθεί ο ασθενής σε πρωτόκολλο επιτήρησης ή να προταθεί για επικουρική
θεραπεία (RPL-Ι ή χημειοθεραπεία) βασίζεται σε μια σειρά παραγόντων, όπως οι
παράγοντες κινδύνου για υποτροπή, η συμμόρφωση του ασθενή και η χειρουργική
εμπειρία.
Πλεονεκτήματα
της RPL-Ι:
1. Το 30% των ασθενών με κλινικό στάδιο Ι NSGCT έχουν παθολογοανατομικό στάδιο
ΙΙ.
2. Η ακριβής παθολογοανατομική σταδιοποίηση επιτρέπει το νωρίτερο καθορισμό
των περαιτέρω θεραπευτικών επιλογών.
3. H RPL-I είναι ταυτόχρονα θεραπευτική και σταδιοποιητική επέμβαση.
4. Η παρακολούθηση μετά από RPL-Ι είναι σημαντικά λιγότερο εντατική, απ' ότι
στους ασθενείς που εντάσσονται σε πρωτόκολλο επιτήρησης και ως εκ τούτου λιγότερο
δαπανηρή.
5. Η ανησυχία, που αναπόφευκτα συνοδεύει τις αβεβαιότητες που σχετίζονται με
τα πρωτόκολλα επιτήρησης, περιορίζεται με τη χειρουργική παρέμβαση.
Αντιμετώπιση
του κλινικού σταδίου ΙΙ
Η πιο κατάλληλη θεραπεία για ασθενείς κλινικού σταδίου II NSGCT είναι υπό αμφισβήτηση.
Η συζήτηση περιστρέφεται γύρω από το ρόλο της RPL-II έναντι της χημειοθεραπείας
και επίσης γύρω από το ρόλο της RPL μετά από τη χημειοθεραπεία.
Υπάρχει γενική συμφωνία ότι τα κλινικά στάδια IIC και III της νόσου πρέπει αρχικά
να αντιμετωπίζονται με χημειοθεραπεία και η χειρουργική επέμβαση να γίνεται
σε περιπτώσεις υπολειπόμενων οπισθοπεριτοναϊκών μαζών.
Αμφιλεγόμενη παραμένει η αρχική αντιμετώπιση των κλινικών σταδίων IIA και ΙΙΒ
της νόσου. Στο Brigham and Women's Hospital, οι περισσότεροι ασθενείς που παρουσιάζονται
με κλινικό στάδιο ΙΙΑ υποβάλλονται σε RPL-ΙΙ. Επιπλέον, οι ασθενείς με διηθημένους
λεμφαδένες <3cm επίσης υποβάλλονται σε RPL-II, ενώ η χημειοθεραπεία γενικά
συνιστάται σε ασθενείς με λεμφαδένες μεγέθους >3cm.
Επικουρική χημειοθεραπεία
μετά RPL-II
Ο ρόλος της επικουρικής χημειοθεραπείας μετά RPL-II, έναντι της αναμονής έχει
αναφερθεί από πολλούς ερευνητές[28,29]. Ο Richie ανασκόπησε 39 ασθενείς με παθολογοανατομικό
στάδιο ΙΙ, που παρακολουθήθηκαν προσεκτικά μετά την RPL-II. Υποτροπή εμφανίστηκε
μόνο στο 8% των ασθενών, όλοι εξ αυτών παρέμειναν ελεύθεροι νόσου με 3-4 κύκλους
χημειοθεραπείας[28].
Σε αυτή τη μελέτη, επομένως, η άμεση μετεγχειρητική χημειοθεραπεία θα είχε ωφελήσει
μικρό μόνο αριθμό ασθενών. Αντίθετα, τυχαιοποιημένη πολυκεντρική μελέτη ανέφερε
ποσοστό 48%, ασθενών με παθολογοανατομικό στάδιο ΙΙ, που υποβλήθηκαν μόνο σε
RPL-ΙΙ[30]. Αυτές οι δυο μελέτες επισημαίνουν το γεγονός ότι τα αποτελέσματα
από ιδρύματα όπου εκτελείται RPL μπορεί να μη συμβαδίζουν με τα αποτελέσματα
μεγάλων δοκιμών, στις οποίες κάποια κέντρα συμμετέχουν με σχετικά μικρό αριθμό
ασθενών.Μετά από RPL, η απόφαση να χορηγηθούν 2 κύκλοι χημειοθεραπείας εξαρτάται
από ένα αριθμό παραγόντων: το μέγεθος του όγκου, ο αριθμός των θετικών λεμφαδένων,
η παρουσία αγγειακής διήθησης στον πρωτοπαθή όγκο και ο ιστολογικός τύπος του
πρωτοπαθούς όγκου. Απλή παρακολούθηση - επιτήρηση είναι κατάλληλη για ασθενείς
με λιγότερο από 6 θετικούς λεμφαδένες (όλοι εκ των οποίων έχουν μέγεθος μικρότερο
από 2cm σε διάμετρο), χωρίς θετικά χειρουργικά όρια. Ασθενείς με περισσότερους
από 6 θετικούς λεμφαδένες ή μεγάλο όγκο νόσου, 2 κύκλοι χημειοθεραπείας χορηγούνται
μετά RPL-II[31]. Αυτό το πρωτόκολλο έχει αποδώσει εξαιρετικά ποσοστά υποχώρησης.
Για τους ασθενείς που αναπτύσσουν υποτροπή ενώ βρίσκονται σε παρακολούθηση,
η εφαρμοζόμενη χημειοθεραπεία σε αυτό το στάδιο παρέχει επίσης εξαιρετικά αποτελέσματα
υποχώρησης.
Χειρουργική
αντιμετώπιση του προχωρημένου NSGCT: RPL-III
Η RPL-IΙΙ σε ασθενείς με προχωρημένο NSGCT παρέχει σημαντικές πληροφορίες για
την περαιτέρω αντιμετώπιση αυτών των ασθενών.
- Εκτιμά την ανταπόκριση στη χημειοθεραπεία.
- Αφαιρεί βιώσιμο GCT, επιτυγχάνοντας έτσι πλήρη ανταπόκριση στη χημειοθεραπεία
και το χειρουργείο.
- Κατευθύνει την ανάγκη για περαιτέρω θεραπεία.
Περίπου το 30% των ασθενών με μεγάλο όγκο μεταστατικού NSGCT θα έχει μερική
υποχώρηση μετά από χημειοθεραπεία βασιζόμενη στην πλατίνη και είναι επομένως
υποψήφιοι για RPL-III, όπως και οι ασθενείς που υποτροπιάζουν στον οπισθοπεριτοναϊκό
χώρο μετά από ατελή εκτομή σε νόσο χαμηλού σταδίου.Μερική υποχώρηση ορίζεται
η ύπαρξη φυσιολογικών τιμών καρκινικών δεικτών, σε συνδυασμό με απεικονιστικά
ευρήματα νόσου στο θώρακα, την κοιλιά, το λαιμό ή αλλού.
Επιμένουσα ή
υποτροπιάζουσα οπισθοπεριτοναϊκή μάζα
Ιστοπαθολογία και συμπεράσματα
Παλαιότερες αναδρομικές μελέτες κατέδειξαν ότι η RPL προσδιορίζει τρεις κατηγορίες
ασθενών, βάσει της ιστοπαθολογίας των παρασκευασμάτων:
- 40% - νέκρωση/ίνωση
- 40% - τεράτωμα ενηλίκων
- 20% - υπολειπόμενο NSGCT[32,33].
Επομένως, περίπου το 60% των ασθενών με ύπαρξη υπολειπόμενης μάζας στις μετά
τη χημειοθεραπεία απεικονιστικές μελέτες, θα έχουν είτε τεράτωμα, είτε βιώσιμο
καρκίνο. Πιο πρόσφατη μελέτη έδειξε ότι η πιθανότητα κακοήθειας της αφαιρεθείσας
μάζας, μετά από χημειοθεραπεία είναι 13%, με το υπόλοιπο να αντιπροσωπεύει νέκρωση
ή τεράτωμα[34].Η ανεύρεση μόνο νεκρωτικού/ινώδους ιστού δεν απαιτεί περαιτέρω
θεραπεία[35], ενώ η ανεύρεση βιώσιμου GCT απαιτεί τη χορήγηση, επιπροσθέτως,
δύο κύκλων χημειοθεραπείας. Οι Fox και συν[36] δημοσίευσαν σειρά από 27 ασθενείς
αυτής της κατηγορίας, οι οποίοι έλαβαν επιπρόσθετη χημειοθεραπεία βασιζόμενη
στην πλατίνη και από 7 ασθενείς που δεν έλαβαν χημειοθεραπεία. Το ποσοστό επιβίωσης
ελεύθερης νόσου ήταν 70% για την ομάδα της χημειοθεραπείας, ενώ και οι 7 ασθενείς
που δεν έλαβαν χημειοθεραπεία υποτροπίασαν. Η λογική της εκτομής του τερατώματος
είναι πολυπαραγοντική. Πρώτον, με την εκτομή αποφεύγεται το σύνδρομο του αναπτυσσόμενου
τερατώματος, στο οποίο η ανώδυνη αύξηση του μεγέθους του προκαλεί επιπλοκές
από την πίεση σε γειτονικά όργανα[37]. Δεύτερον, η κακοήθης εξαλλαγή του ώριμου
τερατώματος σε σάρκωμα και αδενοκαρκίνωμα, το οποίο είναι ανθεκτικό στη χημειοθεραπεία,
έχει καλώς περιγραφεί[38]. Τρίτον, υπάρχει κίνδυνος βιώσιμου GCT στο τεράτωμα[39].
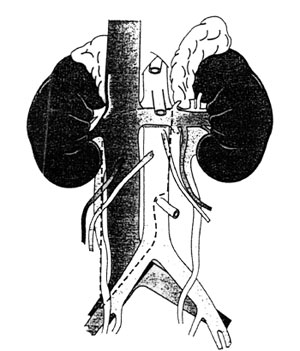
Τροποποιημένη οπισθοπεριτοναϊκή λεμφαδενεκτομή
για καρκίνο δεξιού όρχεως.
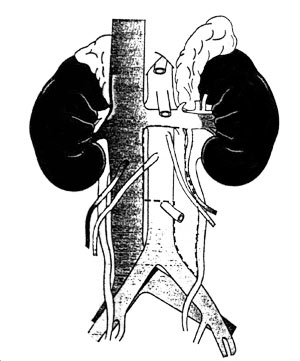
Τροποποιημένη οπισθοπεριτοναϊκή λεμφαδενεκτομή
για καρκίνο αριστερού όρχεως.
RPL-ΙΙΙ: Ενδείξεις
και επιλογή ασθενών
Παρά τους καλά περιγραφέντες κινδύνους παραμονής βιώσιμου υπολειπόμενου GCT
στον οπισθοπεριτοναϊκό χώρο μετά από χημειοθεραπεία, ή υποτροπής μετά από RPL-Ι
ή RPL-ΙΙ, οι ενδείξεις για RPL-ΙΙΙ είναι αμφιλεγόμενες και δεν υπάρχουν σαφείς
κατευθυντήριες γραμμές.
Η ύπαρξη αυξημένων καρκινικών δεικτών, ωστόσο, παραμένει η μόνη γενικώς αποδεκτή
αντένδειξη της επικουρικής χειρουργικής θεραπείας σε ασθενείς που έλαβαν χημειοθεραπεία[40].
Η αντιμετώπιση των ασθενών, των οποίων οι δείκτες επέστρεψαν στο φυσιολογικό
μετά από τη χημειοθεραπεία, ποικίλει από την παρατήρηση -ανεξάρτητα από τα αποτελέσματα
των απεικονιστικών μεθόδων- μέχρι το χειρουργείο, για όλους τους ασθενείς[41,42].
Η υπολειπόμενη μάζα, συνήθως, ανιχνεύεται με την αξονική τομογραφία, εντούτοις,
ο ορισμός της φυσιολογικής αξονικής τομογραφίας διαφέρει από κέντρο σε κέντρο.
Στους ορισμούς περιλαμβάνονται: μη ορατή μάζα, λεμφαδένες όχι μεγαλύτεροι από
1cm, λεμφαδένες με διάμετρο μικρότερη από 1.5-2cm[37]. Λαμβάνοντας υπόψη τις
επιπλοκές της RPL-ΙΙΙ, η επιλογή των ασθενών παίζει σημαντικό ρόλο, έτσι ώστε
να αποκλειστούν οι ασθενείς που είναι απίθανο να έχουν βιώσιμη νόσο. Οι Donohue
και συν43 βρήκαν ότι στις περιπτώσεις που δε βρέθηκαν στοιχεία τερατώματος στον
πρωτοπαθή όγκο και στις οποίες διαπιστώθηκε μεγαλύτερη από 90% μείωση του όγκου
της οπισθοπεριτοναϊκής νόσου με επαναλαμβανόμενες αξονικές τομογραφίες, δε βρέθηκε
βιώσιμος όγκος ή τεράτωμα στο εξαιρεθέν παρασκεύασμα. Οι Fossa και συν[42] ανέφεραν
37 ασθενείς που υποβλήθηκαν σε RPL-III, παρά τις αρνητικές αξονικές τομογραφίες
μετά από χημειοθεραπεία. Τεράτωμα ανευρέθη σε ποσοστό 30%, ενώ 3% των ασθενών
είχαν NSGCT. Ο όγκος του τερατώματος ήταν μικρός και ίσως κλινικά μη σημαντικός
για να δικαιολογήσει μια γενική πολιτική εκτέλεσης RPL-ΙΙΙ, παρά τα αρνητικά
ευρήματα της αξονικής τομογραφίας.Οι Toner και συν34 ανέφεραν μελέτη 185 ασθενών
που υποβλήθηκαν σε RPL-ΙΙΙ μετά χημειοθεραπεία. Σε αυτή τη σειρά, κανένας παράγοντας
δεν βρέθηκε που θα μπορούσε αξιόπιστα να προβλέψει τους ασθενείς που είχαν υπολειπόμενο
βιώσιμο όγκο ή τεράτωμα στον οπισθοπεριτοναϊκό χώρο. Λαμβάνοντας αυτό υπόψη,
η RPL-III συνιστάται σε όλους τους ασθενείς με υπολειπόμενη μάζα του οπισθοπεριτοναϊκού
χώρου στην αξονική τομογραφία και σε όλους τους ασθενείς με αρχική μάζα μεγέθους
πάνω από 3cm, ανεξάρτητα από τα απεικονιστικά ευρήματα μετά τη χημειοθεραπεία[32,33].
Επιπλοκές της
RPL-ΙΙΙ
Η RPL-III είναι μια πολύ απαιτητική επέμβαση, στην οποία μερικές φορές χρειάζεται
θωρακοκοιλιακή προσπέλαση. Σε πρόσφατη μελέτη, 25.9% των ασθενών ανέφερε απουσία
εκσπερμάτισης μετά RPL-ΙΙΙ. Σ' αυτή τη μελέτη, το μέγεθος του αφαιρεθέντος όγκου
ήταν μεγαλύτερο στους ασθενείς με απουσία εκσπερμάτισης, απ' ότι στους ασθενείς
με διατήρηση αυτής. Επιπρόσθετα, η απουσία εκσπερμάτισης ήταν σημαντικά συχνότερη
σε ασθενείς με όγκο δεξιά παρά την κάτω κοίλη και ανάμεσα στην κάτω κοίλη και
την αορτή (34.5%), απ' ότι στους ασθενείς με όγκο αριστερά παραορτικά (16.7%)[44].
Τεχνικές διατήρησης των νευρικών πλεγμάτων έχουν εφαρμοστεί επιτυχώς σε υποομάδες
ασθενών αυτής της κατηγορίας. Σε πρόσφατη μελέτη 472 ασθενών που υποβλήθηκαν
σε RPL-III, στους 93 (19.7%) έγινε nerve sparing τεχνική. Σ' αυτούς, ο μέσος
όγκος της υπολοιπόμενης νόσου στην προεγχειρητική αξονική τομογραφία ήταν 6.3cm.
Διαπιστώθηκε ποσοστό 76.5% φυσιολογικής εκσπερμάτισης, ενώ επιτεύχθηκαν και
10 κυήσεις. Καρκίνος όρχεως υποτροπίασε σε 6 ασθενείς, αλλά κανένας δεν ήταν
οπισθοπεριτοναϊκός. Επομένως, η nerve-sparing RPL-III φαίνεται να έχει θέση
σε υποκατηγορία ασθενών με νόσο περιορισμένου όγκου, χωρίς να διακινδυνεύει
την έκβαση, ενώ διατηρείται η εκσπερμάτιση. Περιστασιακά, είναι απαραίτητη η
εκτομή της κάτω κοίλης φλέβας κάτωθεν των νεφρικών φλεβών και έχει καλά περιγραφεί.
Επίσης, αορτικά μοσχεύματα μπορεί να απαιτηθούν προκειμένου να αντικαταστήσουν
τμήματα της αορτής που καταστρέφονται από εκτεταμένη εκτομή[47]. Ως εκ τούτου,
ο βαθμός των επιπλοκών σχετίζεται άμεσα με την πολυπλοκότητα της εκτομής, όπως
επίσης και η αθροιστική τοξικότητα των χημειοθεραπευτικών παραγόντων είναι ιδιαίτερης
σημασίας για τους ασθενείς που υποβάλλονται σε RPL-ΙΙΙ μετά από χημειοθεραπεία.
Ιδιαίτερης σημασίας, σε ασθενείς στους οποίους έχει προηγηθεί σχήμα χημειοθεραπείας
που περιλαμβάνει την μπλεομυκίνη, είναι οι πνευμονικές επιπλοκές. Το ποσοστό
θνησιμότητας που οφείλεται στην τοξικότητα της μπλεομυκίνης στους πνεύμονες
φτάνει το 50%. Σε πρόσφατη ανασκόπηση των Baniel και συν, μελετήθηκε η χειρουργική
νοσηρότητα 603 ασθενών που υποβλήθηκαν σε RPL μετά από χημειοθεραπεία για καρκίνο
όρχεως σταδίου ΙΙ και ΙΙΙ. Το ποσοστό επιπλοκών ήταν 20.7% και το ποσοστό θνησιμότητας
0.8%. Οι πνευμονικές επιπλοκές ήταν η συχνότερη αιτία σοβαρής νοσηρότητας. Έξι
ασθενείς εμφάνισαν σύνδρομο αναπνευστικής δυσχέρειας ενηλίκων, η υποκείμενη
αιτία του οποίου ήταν ο συνδυασμός πνευμονικής τοξικότητας της μπλεομυκίνης
και ο μεγάλος όγκος της αφαιρεθείσας πνευμονικής και οπισθοπεριτοναϊκής νόσου
σε αυτή την υποκατηγορία των ασθενών.
Βιβλιογραφία
1. Einhorn LH. Treatment of testicular cancer: a new and improved model. J Clin
Oncol 1990; 8:1.777.
2. Oliver RTD. Clues from the natural history and results of treatment supporting
the monoclonal origin of germ cell tumors. Cancer Surv 1990; 9:333.
3. Bosl GL, Motzer RJ. Testicular germ cell cancer. N Engl J Med 1997; 337:242.
4. Levin M. Prognostic features of primary and secondary germ cell tumors. Urol
Clin N Amer 1993; 20:39.
5. Coogan CL, Mohamed JP. Nerve sparing post-chemotherapy retroperitoneal lymph
node dissection for advanced testicular cancer. J Urol 1996; 156:1.656.
6. Li M, Whitmore W, Golbey R, Grabstald H. Effects of combined drug therapy
on metastatic cancer of the testis. JAMA 1960; 174:1.291.
7. Samuels ML, Johnson DE and Holoye PY. Continuous intravenous bleomycin therapy
with vinblastine in stage III testicular neoplasia. Cancer Chemother Rep 1975;
Part1, 59:563.
8. Rosenberg B, Van Camp L, Krigas T. Inhibition of cell division in E. coli
by electrolysis products from a platinum electrode. Nature 1965; 205:698.
9. Einhorn LH and Donohue J. Cis-diaminedichloroplatinum, vinblastine and bleomycin
combination chemotherapy in disseminated testicular cancer. Ann Inter Med 1977;
87:293.
10. Williams SD, Birch R, Einhorn LH, Irwin L, Greco FA, Loehrer P. Treatment
of disseminated germ cell tumors with cisplatin, bleomycin and either vinblastine
or etoposide. N Engl J Med 1987; 316:1.435.
11. Peckham M, Barrett A, Liew K, Hendry WF. The treatment of metastatic germ-cell
tesricular tumors with bleomycin, etopposide and cisplatin. Br J Cancer 1983;
47:613-619.
12. Williams SD, Birch R, Einhorn LH, Irwin L, Greco FA, Loehrer P. Treatment
of disseminated germ cell tumors with cisplatin, bleomycin and either vinblastine
or etoposide. N Engl J Med 1987; 316:1.435.
13. Bajorin DF, Geller NL, Weisen SF, Bosl GJ. Two drug therapy in patients
with metastatic germ cell tumors. Cancer 1991; 67:28.
14. Einhorn LH, Williams SD, Loehrer PJ, Greco FA. Evaluation of optimal duration
of chemotherapy in favourable prognosis disseminated germ cell tumors: a southeastern
cancer group protocol. J Clin Oncol 1989; 7:387.
15. Stoter G, Sleijfer DTH, Schornagel JH, Sylvester R. BEP versus VIP in intermrdiate
risk patients with disseminated nonseminomatous testicular cancer. Proc Am Soc
Clin Oncol 1993; 12:714.
16. Nichols CR, Williams SD, Loehrer PJ, Greco A, Crawford ED, Einhorn LH. Randomised
study of cisplatin dose intensity in poor risk germ cell tumors: A Southeastern
cancer study group and southwest oncology group protocol. J Clin Oncol 1993;
9:1.163.
17. Chevreau C, Droz JP, Rico JL, Biron P, Kerbrat P, Bouzy J. Early intensified
chemotherapy with autologous bone marrow transplantation in first line treatment
of poor risk nonseminomatous germ cell tumors. Eur Urol 1993; 23:213.
18. Whitemore WF. Germinal tumors of the testis: In proceedings of the Swedish
National Cancer Conference. Philadelphia JB Lipincott Co 1973; p485.
19. Donohue JP, Zachary JM, Maynard B. Distribution of nodal metastases in nonseminomatous
testis cancer. J Urol 1982; 128:315.
20. Keber GM. Sarcoma of the testicle, conclusion based upon 114 cases. Amer
J Med 1899; 117:535.
21. Johnson DE, Appele C, Samuels ML, Luna M. Metastasis from testicular carcinoma.
Urology 1976; 8:234.
22. Rorth M, Jacobsen GK, Maase H von der. Surveillance along versus radiotherapy
after orchiectomy for clinical stage I nonseminomatous testicular cancer. J
Clin Oncol 1991; 9:1.543.
23. Read G, Stenning SP, Cullen MH. Medical Recearch Council prospective study
of surveillance for stage I testicular cancer. J Clin Oncol 1992; 10:1.761-1.768.
24. Peckham MJ, Barret A, Horwich A, Hendry WF. Orchiectomy alone for stage
I testicular nonseminoma. Br J Urol 1983; 55:754.
25. Freedman LS, Parkinson MC, Jones WG. Histopathology in the prediction of
relapse in patients with stage I testicular teratoma treated by orchidectomy
alone. Lancet 1987; 2:294.
26. Sogani PC, Perrotti M, Herr H, Fair WR, Thaler HT, Bosl G. Clinical stage
I testis cancer: Long term outcome of patient on surveillance. J Urol 1988;
159:885.
27. Boden G, Gibb R. Rathiotherapy and testicular neoplasms. Cancer 1951; 2:294-297.
28. Richie JP, Kantoff PW. Is adjuvant chemotherapy necessary for patients with
stage BI testicular cancer. J Clin Oncol 1991; 9(8):1.393-1.398.
29. Pizzocaro G, Monfardin N. Adjuvant chemotherapy in selected patients with
pathologic stage II NSGCT. J Urol 1983; 31:667.
30. Williams SD, Stablain DM, Einhorm LM. Immediate adjuvant chemotherapy versus
observation with treatment at relapse in pathological stage II testicular cancer.
N Engl J Med 1987; 317:1.433.
31. Weisbach L, Mamhapp JP. Adjuvant chemotherapy for metastatic stage NSGCT
of the testis. J Urol 1991; 146:1.295.
32. Brenner J, Vugrin D, Whitmore WF. Cytoreductive surgery for advanced nonseminomatous
germ cell tumors of the testis. Urology 1982; 19:571-575.
33. Einhorn LH, Williams SD, Mandelbaum I, Donohue JP. Surgical resection in
disseminated testicular cancer following cytoreduction. Cancer 1981; 48:904-908.
34. Toner G, Panicek DM, Heelan RY, Geller NL, Bosl GJ. Adjunctive surgery after
chemotherapy for nonseminomatous germ cell tumors: recommendations for patient
selection. J Clin Oncol 8:1.638-1.694, 199.
35. Law TM, Motzer RJ, Bajorin DF, Bosl GJ. The management of patients with
advanced germ cell tumors. Urol Clin North Amer 1994; 24:773.
36. Fox EP, Weathers T, Einhorn LH. Outcome analysis for patients with persistent
nonteratomatous germ cell tumor in postchemotherapy retroperitoneal lymph node
dissections. J Clin Oncol 1993; 11:1.294.
37. Logothetis CJ, Samuels ML, Trindade A, Johnson DE. The growing teratoma
syndrome. Cancer 1982; 50:1.629.
38. Loehrer PJ, Mui S, Majdu SI. Teratoma following cisplatin based chemotherapy
for nonseminomatous germ cell tumors. A clinicopathologic correlation. J Urol
1986; 135:1.189.
39. Herr HM, LaQuaglia MP. Managementof teratoma. Urol Clin of North Amer 1993;
20:145.
40. Bajorin DF, Herr HW, Motzer RJ, Bosl GJ. Current perspectives on the role
of adjunctive surgery in combined modality treatment of patient with germ cell
tumors. Semin Oncol 1992; 145:158.
41. Levitt MD, Reynolds PM, Steiner M. Nonseminomatous germ cell testicular
tumors: residual masses after chemotherapy. Br J Surg 1985; 72:1.902.
42. Fossa SD, Ous S, Lien HH, Steinwig AE. Postchemotherapy lymph node histology
in radiologically normal patients with metastatic nonseminomatous testicular
cancer. J Urol 1989; 141:557-559.
43. Donohue JP, Foster RS. Management of retroperitoneal reccurences: seminoma
and nonseminoma. Urol Clin North Amer 1993; 21:761-772.
44. Gels ME, Nijboer AP, Hoekstra HL. Complications of post chemotherapy resection
of retroperitoneal residual tumor mass in patient with NSGCT. Br J Urol 1997;
79: 263.
45. Donohue JP, Thornhill JA, Foster RS, Bihrle R. Resection of the inferior
vena cava or intraluminal vena caval tumor thrombectomy during retroperitoneal
lymph node dissection for metastatic germ cell cancer: indications and results.
J Urol 1991; 146:346.
46. Donohue JP, Thornhill JA, Foster RS, Bihrle R. Vascular considerations in
post chemotherapy retroperitoneal lymph node dissection: part I - vena cava.
World J Urol 1994; 12:182-186.
47. Donohue JP, Thornhill JA, Foster RS, Bihrle R. Vascular considerations in
post chemotherapy retroperitoneal lymph node dissection: part II World J Urol
1994; 12:187.