Φυσιολογία της στύσης
Στοιχεία φυσιολογικής στυτικής λειτουργίας,
ανάλυση νεότερων δεδομένων
[1]ΓΕΩΡΓΙOΣ ΠΑΡΑΝΥΧΙΑΝΑΚΗΣ, [2]ΑΝΔΡΕΑΣ ΜΠOΥΡΔOΥΜΗΣ
[1]Χειρουργός Oυρολόγος, Πάτρα, [2]Χειρουργική Κλινική ΓΝ Αιγίου
Εισαγωγή
Το πέος αποτελείται από τρεις κυλινδρικές ράβδους στυτικού ιστού που περιβάλονται
απο την περιτονία του Buck, το ζεύγος των σηραγγωδών σωμάτων και το μονήρες
σπογγιώδες σώμα που περιβάλλει την ουρήθρα και επεκτείνεται για να σχηματίσει
τη βάλανο[1].
Τα σηραγγώδη σώματα περικλείονται προ της περιτονίας του Buck απο ινώδη χιτώνα
(tunica albuginea), ο οποίος χωρίζεται σε έσω κυκλοτερή και έξω επιμήκη στοιβάδα,
που συγκλίνουν στο ινώδες διάφραγμα. Από το έσω τμήμα προέρχεται το δίκτυο δοκίδων
ινοελαστικού ιστού που περιέχει λείες μυϊκές ίνες και μαζί με αγγειακούς κόλπους
σχηματίζουν το στυτικό ιστό[2].
Η αιμάτωση παρέχεται από την έσω αιδοιική αρτηρία (κλάδο της έσω λαγονίου αρτηρίας)
μέσω των πεϊκών αρτηριών (ραχιαία αρτηρία, βολβοουρηθρική αρτηρία και σηραγγώδεις
αρτηρίες). Oι τελευταίες καταλήγουν στις ελικοειδείς αρτηρίες, που αρδεύουν
τους αγγειακούς κόλπους του στυτικού ιστού (στην ουσία πρόκειται για εκτεταμένα
αρτηριοφλεβικά shunts εντός των σηραγγωδών σωμάτων, που κλείνουν κατά τη στύση,
επιτυγχάνοντας τη διάτασή τους). Η παροχέτευση γίνεται από την εν τω βάθει ραχιαία
φλέβα προς το περιπροστατικό πλέγμα[1].

Νευρικό σύστημα
Η νεύρωση του πέους επιτελείται από τα σηραγγώδη νεύρα εκ του πυελικού νευρικού
πλέγματος. Η πορεία τους διαγράφεται αρχικά υπό του προστάτη, ακολούθως δια
του ουρογεννητικού διαφράγματος στη ραχιαία επιφάνεια του πέους. Oι τελικοί
κλάδοι νευρώνουν τις ελικοειδής αρτηρίες και τις λείες μυϊκές ίνες των σηραγγωδών
σωμάτων. Το νωτιαίο κέντρο της στύσης βρίσκεται στα νευροτόμια Θ11-O3 και Ι2-Ι4.
Παρασυμπαθητικές ίνες από τα Ι2-Ι4 ελέγχουν την αγγειοδιαστολή των κολπειδών
και τη στύση, ενώ συμπαθητικές ίνες από τα Θ11-O3 τη χάλαση και την εκσπερμάτιση.
Το περιφερικό νευρικό σύστημα συμμετέχει δια του αιδοιικού νεύρου με κινητικές
ίνες προς το βολβοσηραγγώδη και τον ισχιοσηραγγώδη μυ, με νωτιαίο κέντρο τον
πυρήνα του Onuf στο πρόσθιο κέρας του Ι2-Ι4 νευροτομίου (βολβοσηραγγώδες αντανακλαστικό).
Μαζί με τις κεντρομόλες ίνες από τους αισθητήρες της βαλάνου, δημιουργείται
το νωτιαίο αντανακλαστικό τόξο της στύσης (εικόνα 2) ("αντανακλαστική στύση").
Η σημασία του αποδεικνύεται από το γεγονός ότι στύση μπορεί να συμβεί μετά άμεσο
ερεθισμό του πέους σε ασθενείς με διατομή του νωτιαίου μυελού πάνω από την ιερή
μοίρα[4].
Το κεντρικό νευρικό σύστημα προκαλεί στύση ("ψυχογενής στύση") με
βάση οπτικο-ακουστικά ή ψυχικά (φαντασίωση) ερεθίσματα που αναλύονται και συσχετίζονται
στον εγκεφαλικό φλοιό με δεδομένα παλαιότερων εμπειριών δημιουργώντας τη σεξουαλική
επιθυμία (libido), αλλά έχει και ρυθμιστικό χαρακτήρα επί των νωτιαίων οδών.
Ως ανώτερα κέντρα ελέγχου έχουν αναγνωριστεί τμήμα του πρόσθιου κροταφικού λοβού
(θυμικός λοβός του Broca), η έσω προ-οπτική περιοχή και ο παρακοιλιακός πυρήνας
στον υποθάλαμο, η φαιά ουσία της περί των υδραγωγό περιοχής του μεσεγκεφάλου
και ο παραγιγαντοκυτταρικός πυρήνας στον προμήκη μυελό - δικτυωτός σχηματισμός
(McKenna, 1998). Έτσι, περιγράφονται 3 τύποι στύσης: 1. Ερεθισματογενής (genital-stimulated),
2.Ψυχογενής (central-stimulated) και 3. Νυκτερινή (central-originated), που
παρατηρείται κατά τη φάση REM του ύπνου. O ακριβής μηχανισμός που διέπει τη
νυκτερινή στύση παραμένει αδιευκρίνιστος, παραταύτα είναι γνωστό ότι υπάρχει
σαφής ελάττωση αριθμού και διάρκειας στύσεων σε ασθενείς με υπογοναδισμό και
σε ασθενείς υπό αντιανδρογονική θεραπεία, ενώ παράλληλα το νωτιαίο κέντρο δείχνει
να παίζει κρίσιμο ρόλο στη νυκτερινή στυτική δραστηριότητα, όπως φάνηκε μετά
συγκριτική μελέτη ατόμων με διατομή του νωτιαίου μυελού στην αυχενική και θωρακική
μοίρα (Suh DD, Yang CC et al, 2003).
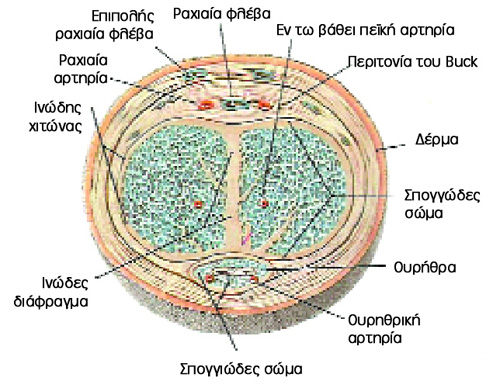
Εικόνα 1. Πέος, εγκάρσια τομή.
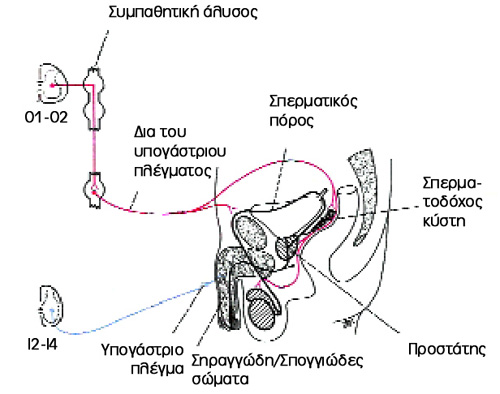
Εικόνα 2. Το αντανακλαστικό τόξο.
Στοιχεία αιμοδυναμικής
Κατόπιν διεγέρσεως (ψυχικό ή σωματικό ερέθισμα) επιτελείται αγγειοδιαστολή των
αγγειακών κόλπων των σηραγγωδών σωμάτων (παρασυμπαθητικό) και πλήρωσή τους με
αρτηριακό αίμα. Αυτή η φαινομενικά απλή διαδικασία επιτυγχάνεται μετά από σειρά
αιμοδυναμικών αλλαγών υπό τον έλεγχο βιοχημικών αλληλεπιδράσεων, οι οποίες μπορεί
να συνοψιστούν σε 6 διαδοχικές φάσεις[3]:
1. Φάση ηρεμίας (αρχική): Ελάχιστη αιματική ροή (2.5-8ml/100g/min - Wagner and
Uhrenholt, 1980).
2. Φάση πλήρωσης: Αύξηση ροής αιδοιικής αρτηρίας ομοίως κατά τη συστολή/διαστολή.
Η ενδοσηραγγώδης πίεση παραμένει αμετάβλητη. Ελαφρά πεϊκή επιμήκυνση.
3. Φάση διόγκωσης: Αυξανόμενη ενδοσηραγγώδης πίεση μέχρι πλήρους στύσης. Σφύζουσα,
διασταλμένη δομή. Με την άνοδο της ενδοσηραγγώδους πίεσης πάνω από τη διαστολική,
η ροή συμβαίνει πλέον μόνο κατά τη συστολή.
4. Φάση πλήρους στύσης: Ενδοσηραγγώδης πίεση και πίεση αιδοιικής αρτηρίας πλησίον
συστολικής (80-90%). Η ροή είναι μικρότερη από τη φάση 2 αλλά μεγαλύτερη της
φάσης 1. Επέκταση των σηραγγωδών κόλπων με πίεση του ινώδους χιτώνα (ινώδης
δοκίδες) έχει ως αποτέλεσμα την παρακώλυση της φλεβικής αποχέτευσης (φλεβοαποφρακτικός
μηχανισμός).
5. Φάση άκαμπτης στύσης: Σύσπαση ισχιοσηραγγώδους μυός και άνοδος ενδοσηραγγώδους
πίεσης πάνω από τη συστολική. Η παύση ροής στη σηραγγώδη αρτηρία είναι μικρής
διάρκειας, ώστε να μην επέλθει ισχαιμία και ιστική κάκωση (μυοσκελετικό στάδιο
- αιδοιικό νεύρο).
6. Φάση αποπλήρωσης: Μετά την εκσπερμάτιση επέρχεται αύξηση του τόνου του συμπαθητικού,
συστολή των λείων μυϊκών ινών του στυτικού ιστού και αποσυμφόρηση των αγγειακών
κόλπων, φλεβική αποχέτευση και επιστροφή στη φάση ατονίας.
Η συσχέτιση πίεσης/ροής στα σηραγγώδη σώματα απεικονίζεται χαρακτηριστικά στην
εικόνα 3, όπως προέκυψε μετά από μελέτη προκλητής στύσης σε πιθήκους[3].
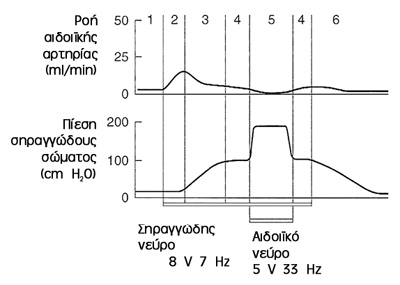
Εικόνα 3. Διάγραμμα ροής-πίεσης.
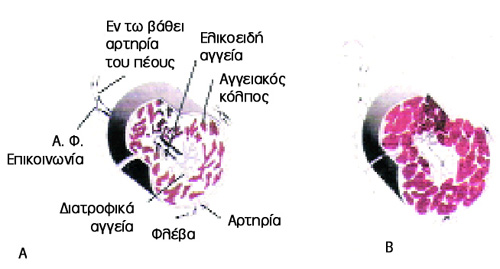
Εικόνα 4. Α. Φάση ατονίας.
Β. Στύση.
Nευροδιαβιβαστικά
συστήματα
O έλεγχος της αιμοδυναμικής του στυτικού ιστού γίνεται από το αυτόνομο νευρικό
σύστημα. Κεντρικό σημείο είναι η ρύθμιση του τόνου των λείων μυϊκών ινών των
σηραγγωδών σωμάτων, που επιτυγχάνεται τόσο δια της αλληλεπίδρασης συμπαθητικού-παρασυμπαθητικού
όσο και από τη δράση ορμονών και τοπικών παραγόντων.
Oι χολινεργικοί νευρώνες που εκκρίνουν ακετυλοχολίνη προκαλούν χάλαση των λείων
μυϊκών ινών, είτε με αναστολή των αδρενεργικών νευρώνων μέσω διάμεσων νευρώνων
είτε με τη σύνθεση και έκκριση μονοξειδίου του αζώτου (ΝO) από το ενδοθήλιο
των σηραγγωδών σωμάτων.
Η δέσμευση της ακετυλοχολίνης στον υποδοχέα του ενδοθηλίου έχει ως αποτέλεσμα
την αύξηση του ενδοκυττάριου ασβεστίου, μέσω της οδού της φωσφατιδυλινοσιτόλης,
που φωσφορυλιώνει και ενεργοποιεί τη ΝO συνθάση (eNOS), μέσω G πρωτεϊνών (3
ισοένζυμα ΝO συνθάσης: ενδοθηλιακή (e), νευρωνική (n) και προκλητή (i) NOS)[3],
ώστε να καταλύσει μόρια L- αργινίνης σε κιτρουλλίνη και μονοξείδιο του αζώτου
(ΝO: EDRF - Moncada, 1990), το οποίο αυξάνει το ενδοκυττάριο cGMP στο λείο μυϊκό
κύτταρο ενεργοποιώντας τη γουανυλική κυκλάση (εικόνα 6). Το μόριο του cGMP μειώνει
το ενδοκυττάριο ασβέστιο ενεργοποιώντας συγκεκριμένες κινάσες (PK-B,-C,-A,-G)
και ιοντικούς διαύλους, με αποτέλεσμα τη χαλάρωση των λείων μυϊκών ινών και
τη διάταση των σηραγγωδών σωμάτων. [Σημ.: Αύξηση του ενδοκυττάριου ασβεστίου
στο λείο μυ συνεπάγεται τη δημιουργία του συμπλέγματος καλμοδουλίνης-4/ασβεστίου
που ενεργοποιεί την κινάση της ελαφράς αλύσου της μυοσίνης. Η κινάση αυτή στη
συνέχεια φωσφορυλιώνει την ελαφρά άλυσο, η οποία παύει να παρακωλύει την αλληλεπίδραση
ακτίνης-μυοσίνης, με αποτέλεσμα τη μυϊκή συστολή (εικόνα 5)]. Η αδρανοποίηση
του cGMP γίνεται από ομάδα ειδικών φωσφοδιεστερασών. Η φωσφοδιεστεράση-5 είναι
ειδική για το cGMP, έτσι ειδικοί αναστολείς των φωσφοδιεστερασών βελτιώνουν
τη στύση (Viagra - σιλδεναφίλη)[3].
Oι αδρενεργικοί νευρώνες εκκρίνουν νοραδρεναλίνη, που δρα στους μετασυναπτικούς
α-1 υποδοχείς και στους προ- και μετα-συναπτικούς α-2 υποδοχείς προκαλώντας
συστολή των λείων μυϊκών ινών και πεϊκή χάλαση. Διακρίνονται 3 προσυναπτικοί
μηχανισμοί ρύθμισης του τόνου των λείων μϊκών ινών (Saenz de Tejada et al, 2000).
Πρώτον, η παλίνδρομη ανασταλτική δράση της νοραδρεναλίνης (ΝΑ) των αδρενεργικών
νευρώνων προσυναπτικά μέσω των α-2 προσυναπτικών υποδοχέων (negative feedback).
Δεύτερον, η δέσμευση ΝΑ στους προσυναπτικούς NANC (μη αδρενεργικούς - μη χολινεργικούς)
νευρώνες μέσω α-2 υποδοχέων, που αναστέλλει τη σύνθεση και έκκριση ΝO. Τρίτον,
η δράση των χολινεργικών νευρώνων που προσυναπτικά αναστέλουν την έκκριση ΝΑ
και διεγείρουν ταυτόχρονα την παραγωγή ΝO από τους NANC νευρώνες. Oι NANC νευρώνες
έχει αποδειχθεί ότι συνθέτουν ΝO με τη βοήθεια της νευρωνικής ΝO συνθάσης και
μέσω συστήματος δεύτερου αγγελιοφόρου (cGMP) προκαλούν πεϊκή αγγειοδιαστολή
(Saenz de Tejada et al, 1988).
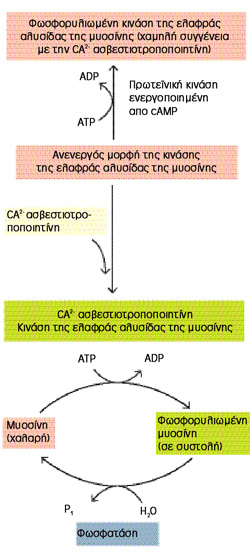
Εικόνα 5. Η σχέση ATP-Ca+2.
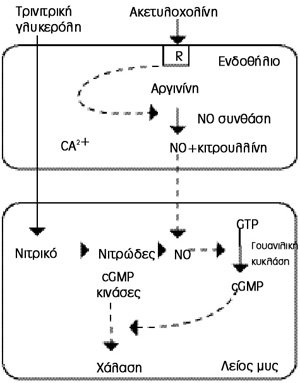
Εικόνα 6. Η βιοχημική οδός
της χάλασης.
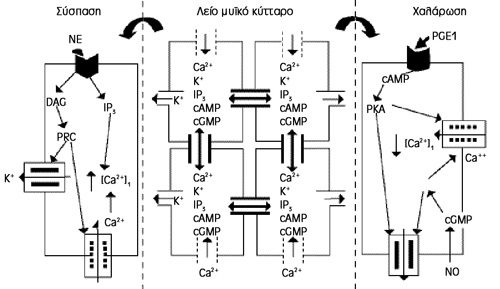
Εικόνα 7. Συνοπτικά η συνύπαρξη
ιοντικών διαύλων - χασματοσυνδέσεων.
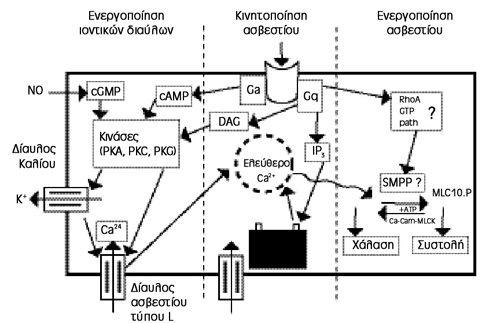
Εικόνα 8. Σχηματική συνολική
απεικόνιση της ρύθμισης του τόνου των λείων μυϊκών ινών στα σηραγγώδη σώματα.
Ιοντικοί δίαυλοι
- χασματοσυνδέσεις
Είναι γνωστό ότι
οι ιοντικοί δίαυλοι έχουν ρυθμιστικό χαρακτήρα στη συστολή και στον έλεγχο του
τόνου των λείων μυϊκών ινών, καθορίζοντας το δυναμικό της μεμβράνης. Η παροδική
ρύθμιση της ευερεθιστότητας του μυοκυττάρου εξαρτάται από το δυναμικό της μεμβράνης
που καθορίζεται από την έξοδο ιόντων Κ+ μέσω διαύλων Κ+. Η έναρξη, η διατήρηση
και η μεθόδευση της συσταλτικότητας εξαρτώνται από αλλαγές του επιπέδου του
ενδοκυττάριου ασβεστίου καθώς και από τη διακυτταρική μεταφορά (χασματοσυνδέσεις
- gap junctions) ασβεστίου και άλλων ιόντων (Moreno et al, 1993). Έξοδος ιόντων
Κ+ προκαλεί υπερπόλωση της κυτταρικής μεμβράνης, μειώνοντας έτσι τη δραστηριότητα
των εξαρτώμενων από το δυναμικό διαύλων ασβεστίου τύπου L. Συνεπάγεται μείωση
διαμεμβρανικής μεταφοράς ασβεστίου, άρα μείωση ολικού ενδοκυττάριου Ca+2 και
μειωμένη μυοκυτταρική συσταλτικότητα και τόνος. Έρευνες έχουν αναδείξει 4 τύπους
διαύλων καλίου στα μυοκύτταρα των σηραγγωδών σωμάτων: I) Μεγάλης αγωγιμότητας
(maxi-K+), II) Μεταβολικά ρυθμιζόμενοι (K+ATP), III) Καθυστερούμενης επανόρθωσης,
και V) Ταχέoς ρεύματος IA (Christ GJ et al, 1993). Πειραματικά και κλινικά στοιχεία
από μελέτη ανθρώπινου δείγματος σηραγγωδών σωμάτων έχουν αναδείξει την παρουσία
μόνο δυο (2)[5,6] υποτύπων διαύλων Κ+ με φυσιολογικό αντίκτυπο: 1) Δίαυλοι ΚATP
(μεταβολικά-ρυθμιζόμενοι δίαυλοι καλίου) και 2) ΚCa (δίαυλοι καλίου ευαίσθητοι
στο ασβέστιο, γνωστοί και ως maxi-Κ+ ή μεγάλης αγωγιμότητας). O δίαυλος ΚΑΤΡ
είναι ένα ετεροπολυμερές που αποτελείται από μία εσωτερική υπομονάδα επανόρθωσης
(Kir, ομόλογο τετραμερές) και την υπομονάδα του υποδοχέα της σουλφονυλουρίας
(SUR, το στόχο φαρμάκων όπως η γλιβενκλαμίδη). Η υπομονάδα SUR με την υπομονάδα
Kir στοιχειομετρώνται 1:17. Η τετραμερική δομή της Kir αναπαριστά την πορώδη
επιφάνεια του διαύλου και απουσία της SUR δεν διαμορφώνει λειτουργικό δίαυλο.
O δίαυλος maxi-Κ+ είναι ένα ετεροπολυμερές που αποτελείται από α- και β-υπομονάδες
που στοιχειομετρώνται 1:1. Η α-υπομονάδα (πορογενής) είναι ομόλογο τετραμερές.
Το cDNA του έχει κλωνοποιηθεί και αναφέρεται ως hSlo. Η παρουσία της α-υπομονάδας
σε ανθρώπινα σηραγγώδη σώματα έχει καταγραφεί[8]. Σε αντίθεση με την Kir6.2
, η α-υπομονάδα είναι γνωστό ότι μπορεί να δημιουργήσει λειτουργικό δίαυλο αν
εκφραστεί μόνη της. Η β-υπομονάδα είναι το ρυθμιστικό στοιχείο του διαύλου maxi-Κ+
και δεν μπορεί να δημιουργήσει λειτουργικό δίαυλο αν εκφραστεί μόνη της, άρα
παίζει ρόλο ρυθμιστή των λειτουργιών της α-υπομονάδας, όσων αφορά στην ευαισθησία
και τη δραστηριότητα του διαύλου, π.χ. για το ασβέστιο (Ca+2)[9,11]. Συγκεκριμένα,
cGMP κινάσες με φωσφορυλίωση ενεργοποιούν τους maxi-K+ διαύλους και δια υπερπολώσεως
της μεμβράνης του μυοκυττάρου μειώνεται το ενδοκυττάριο ασβέστιο και συμβαίνει
μυοχάλαση (Archer SL, 2002). Η συστολή ή χάλαση του μυοκυττάρου αντιστοιχεί
σε άνοδο ή πτώση των επιπέδων του ολικού ενδοκυττάριου Ca+2, που διαμορφώνεται
τόσο από ενδοκυτταρική αποδέσμευση (εκ του ενδοπλασματικού δικτύου δια του συστήματος
της τριφοσφωρικής ινοσιτόλης - IP3) όσο και από τη διαμεμβρανική μεταφορά Ca+2,
που αποτελεί και το στόχο της ρύθμισης των διαύλων K+.
Με ανάλογο τρόπο λειτουργεί και το μόριο του cAMP (ως δεύτερος αγγελιοφόρος
με σύστημα πρωτεϊνης G δια των Κ+-ευαίσθητων διαύλων ασβεστίου - Christ et al,
2000). Το cAMP φαίνεται να δρα ως δεύτερος αγγελιοφόρος επίσης για την προσταγλανδίνη
Ε1, το VIP και το πεπτίδιο το σχετιζόμενο με το γονίδιο της καλσιτονίνης (CGRP)[3],
αν και ο ρόλος των διαφόρων πεπτιδίων δεν έχει πλήρως διασαφηνιστεί. Πάντως,
ουσίες που προκαλούν ή αναστέλλουν τη στύση στον άνθρωπο είναι γνωστές και συνοψίζονται
στο πίνακα 1.
Η διακυτταρική επικοινωνία δια των χασματοσυνδέσεων αποτελεί σημαντική δίοδο
μετάδοσης μηνυμάτων πρακτικά σε όλους τους ιστούς, συμπεριλαμβανομένου και του
πέους[12-14]. Η χασματοσύνδεση ενός κυττάρου αποτελείται από εξαγωνικά οργανωμένα
συνδετόνια (connexons) και η ένωση ενός ζευγαριού δημιουργεί τη λειτουργική
χασματοσύνδεση[14]. Oι χασματοσυνδέσεις τοποθετημένες σε σειρά αποτελούν τα
διακυτταρικά κανάλια που έχουν παρατηρηθεί in vitro και in vivo[15,16] στα μυοκύτταρα
των σηραγγωδών σωμάτων (εικόνα 7). Συγκεκριμένα η παρουσία της πρωτεΐνης συνδετίνη
43 (connexin 43 - Cx43) ως δομικό στοιχείο των χασματοσυνδέσεων έχει περιγραφεί
στον ανθρώπινο στυτικό ιστό[8,15,16], ενώ ηλεκτροφυσιολογικές μελέτες επί της
Cx43 ανέδειξαν το ρόλο της στη στυτική λειτουργία[17,18]. Επιπλέον, επιλεκτική
διακοπή της σύνδεσης με επτανόλη, in vitrο[19] και in vivο[20], είχε ως συνέπεια
μείωση της συσταλτικότητας των σηραγγωδών σωμάτων.
Συγκυτιακή τριάδα -
Η θέση της γονιδιακής θεραπείας
Δεδομένου του ότι σε διάφορα όργανα οι μηχανισμοί ενδο- και διακυτταρικής επικοινωνίας
είναι παραπλήσιοι αλλά λειτουργούν με διαφορετικό τρόπο, προσδίδοντας έτσι την
ιδιαιτερότητα του κάθε οργάνου, δημιουργήθηκε το θεώρημα της "συγκυττιακής
ιστικής τριάδας"[13,14], με βάση την αυτόνομη νεύρωση, την ενδοκυτταρική
αγωγή του σήματος και τη διακυτταρική επικοινωνία δια των χασματοσυνδέσεων (εικόνα
7). Το θεώρημα αυτό επιτρέπει τη χρήση της γονιδιακής θεραπείας ως αντικειμένου
θεραπευτικής στρατηγικής κατά της στυτικής δυσλειτουργίας, όπως έχει τεκμηριωθεί
μετά μελέτες in vivo σε ποντικούς[21]. Ενδοσηραγγώδης ένεση πλασμιδιακού hSlo
DNA (pcDNA3) προβλέπεται να αποβεί θεραπευτική βάσει των κάτωθι γεγονότων: 1)
Λόγω των χασματοσυνδέσεων, μόνο ένας μικρός αριθμός μυοκυττάρων χρειάζεται να
τροποποιηθεί. 2) O δίαυλος maxi-Κ+ είναι γνωστό ότι συμβάλλει στη στυτική λειτουργία.
3) cDNA τοποθετούμενο σε εμπορικά διαθέσιμο DNA ξενιστή/φορέα (π.χ. Invitrogen)
απορροφάται από σηραγγώδη μυοκύτταρα, αν και με μεγάλη απόκλιση αποτελεσματικότητας
(0,01-80%). 4) Η πρόσληψη γίνεται πιθανόν με ενδοκύτωση και το DNA διατηρεί
την ικανότητα της μη ολικής εξομοίωσης στον πυρήνα του μυοκυττάρου (~1:1016/μόριο
DNA)[21]. Μια ήπια υπερέκφραση του maxi-Κ+ είναι δυνατό να επιφέρει σημαντικές
φυσιολογικές αλλαγές. Ενδοσηραγγώδης ένεση 100μg pcDNA/ hSlo cDNA ήταν αρκετή
ώστε να βελτιώσει τη μείωση της απόκρισης της ενδοσηραγγώδους πίεσης στο νευρικό
ερέθισμα, που ως συνιστάμενες είχε την ηλικία και την παρουσία διαβήτη[22].
Η εξομοίωση βρέθηκε να διαρκεί έως 3-4 μήνες[23,24]. Τεχνικές PT-PCR επιβεβαίωσαν
την ύπαρξη αντίγραφου hSlo σε ζώα με βελτιούμενη απόκριση, ενώ δεν ανέδειξαν
κάποια δραστηριότητα ως αποτέλεσμα της δράσης του ξενιστή και μόνο[23]. Αυτό,
για την πρώτη διαπίστωση, σημαίνει οτι η υπερέκφραση του maxi-Κ+ είναι ήπια
και μάλλον συμβαίνει σε μικρό αριθμό μυοκυττάρων. Η γονιδιακή θεραπεία με τη
χρήση του ιοντικού διαύλου hSlo (α-υπομονάδα του maxi-Κ+) εκμεταλλεύεται 3 στοιχεία
της στυτικής φυσιολογίας: 1) Το ρόλο του maxi-Κ+, 2) τις χασματοσυνδέσεις, που
παρέχουν την ανατομική συνέχεια και 3) τις λεπτές ισορροπίες της συσταλτικότητας,
η διαταραχή των οποίων οδηγεί σε στυτική δυσλειτουργία. Η ήπια υπερέκφραση του
maxi-Κ+ στους ποντικούς οδηγεί σε μεμβρανική υπερπόλωση ορισμένων μυοκυττάρων,
η οποία διαδίδεται δια των χασματοσυνδέσεων σε όλο τον ιστό. Έτσι, ακόμα και
σε μειωμένο νευρικό ερέθισμα (π.χ. διαβήτης)[81] η υπερπόλωση οδηγεί τελικά
σε μείωση του ενδοκυττάριου ασβεστίου και σε χαλάρωση των λείων μυϊκών ινών
των σηραγγωδών σωμάτων.
Νεότερα δεδομένα (Hashitani et al, 2002) με τη χρήση νιφεδιπίνης σε λεία μυϊκά
κύτταρα σηραγγώδους σώματος ινδικού χοιριδίου ενισχύουν τη σχέση δεύτερων αγγελιοφόρων
(cAMP - cGMP) και ασβεστίου. Επιπλέον, φαίνεται ότι στη διατήρηση της στύσης
συμβάλλει η ίδια η αιματική ροή στα σηραγγώδη σώματα, καθώς η τάση της ροής
στα τοιχώματα του ενδοθηλίου προκαλεί την ουδό της φωσφατιδυλινοσιτόλης με συνέπεια
παραγωγή eNOS και μονοξειδίου του αζώτου (Burnett etal, 2004), ενώ παράλληλα
σημαντικό ρόλο στην ενεργοποίηση των κινασών, ιδιαίτερα της υπο-οικογένειας
RhoA που έχει αναμειχθεί πρόσφατα στη πρόκληση πεϊκής αγγειοσύσπασης (Rees RW
et al, 2002), παίζει και η αναδιαμόρφωση του κυτταροσκελετού (μικροσωλινίσκοι)
συνέπεια της τάσης (shear stress) (Putnam et al, 2003).
Συμπέρασμα
Συνοψίζοντας, μπορούμε να μιλήσουμε για 3 παραμέτρους που διέπουν τη στυτική
λειτουργία, το αυτόνομο νευρικό σύστημα, την ενδοκυττάρια απάντηση στους νευροδιαβιβαστές
και τη διακυτταρική επικοινωνία. Κεντρικό ρόλο παίζει η δράση του ΝO, ο λόγος
cAMP/cGMP που δημιουργείται συνεπεία του συστήματος πρωτεΐνης G, η εξαρτώμενη
από το δυναμικό ιοντική μετακίνηση ιδίως του ασβεστίου και η ανεξάρτητη δυναμικού
διακυτταρική μετακίνηση ιόντων και άλλων μορίων μέσω των χασματοσυνδέσεων, που
εξασφαλίζουν τη λειτουργική συνέχεια του στυτικού ιστού (εικόνα 8).
Η φυσιολογία της στύσης αποτελεί εδώ και χρόνια αντικείμενο εξειδικευμένης μελέτης
και έρευνας, καθώς αποτελεί τον ακρογωνιαίο λίθο στην προσπάθεια για την εξέλιξη
της αντιμετώπισης της στυτικής δυσλειτουργίας. Παράλληλα με τη δημιουργία νεότερων
φαρμακευτικών σκευασμάτων, γίνεται και απόπειρα εφαρμογής γενετικής θεραπείας
(Christ GJ et al, 2003). Η γνώση της φυσιολογίας αποτελεί αναπόσπαστο τμήμα
της θεραπευτικής προσέγγισης με απώτερο σκοπό τη βελτίωση της ποιότητας ζωής.
Βιβλιoγραφία
1. Hollinshead, Rosse, Textbook
of anatomy. 4th ed. Lippincott 1985. ISBN 0-06-141263-5.
2. Wheater's Functional histology. 3rd ed. Ch. Livingstone 1994. ISBN 0-443-04691-3.
3. Smith's General Urology. 15th ed. Lange 2000. ISBN 0-07-112006-8.
4. Snell RS. Clinical Neuroanatom. 3rd ed. Little/Brown 1992. ISBN 0-316-80244-1.
5. Fan SF, Brink PR, Melman A, Christ GJ. An analysis of the maxi-K+ channel
in cultured human corporal smooth muscle cells. J Urol 1995; 153:818-25.
6. Lee SW, Wang HZ, et al. Characterization of ATP-sensitive K+ channels in
human corporal smooth muscle cells. Int J Impot Res 1999; 11:189-9.
7. Aguilar-Bryan L, Clement JP, et al. Toward understanding the assembly and
structure of K+ ATP channels. Phys Rev 1998; 78:227-45.
8. Christ GJ, Wang HZ, Venkateswarlu K, et al. Ion channels and gap junction:
Their role in erectile physiology, dysfunction and future therapy. Mol Urol
1999; 3:61-74.
9. Starret IE, Dworetzky SI, Grbkoff VK. Modulation of large conductance calcium-activated
potassium channels as potential therapeutic targets. Curr Pharm Des 1996; 2:413-28.
10. Adelman JP, Shen KZ, et al. Calcium-activated potassium channels expressed
from cloned complementary DNAs. Neuron 1992; 9:209-16.
11. Butler A, et al. hSlo, a complex mouse gene encoding "maxi" calcium-activated
potassium channels. Science 1993; 261:221-4.
12. Gilula NB (Ed). Gap junction-mediated intercellular signalling in health
and disease. John Wiley and Sons. New York 1999.
13. Christ GJ. "The syncytial tissue triad": The mechanistic basis
for integrative tissue physiology. Einstein Quatrerly J Biol Med 1999; 15:179-91.
14. Christ GJ, Spray DC, et al. Gap junctions in vascular tissues: Evaluating
the role of intercellular communication to the modulation of vasomotor tone.
Circ Res 1996; 79:631-46.
15. Christ GJ, Melman A. Molecular studies of human corporal smooth muscle:
Implications for the understanding, diagnosis and treatment of erectile dysfunction.
Mol Urol 1997; 1:45-54.
16. Campos de Carvalho AC, Moreno AP,et al. Gap junctions formed of connexin
43 interconnect smooth muscle cells of the human corpus cavernosum. J Urol 1993;
149:1568-75.
17. Moreno AP, Campos de Carvalho AC, Christ GJ ,Spray DC. Gap junctional communication
between human corpus cavernosum smooth muscle cells in culture: Gating behaviour
and single channel events. Am J Physiol 1993; 264:C80-92.
18. Brine PR, Ramanan SV, Christ GJ. Human connexin 43 gap junction channel
gating: Evidence for mode shifts and/or heterogeneity. Am J Physiol 1996; 271:C321-C331.
19. Christ GJ, Moreno AP, et al. Intercellular communication through gap junctions:
A potential role in pharmacomechanical coupling and syncytial tissue contraction
in vascular smooth muscle isolated from the human corpus cavernosum. Life Sci
1991; 49:PL-195-200.
20. Zhao W, Christ GJ. Evidence that gap junctions participate in neurostimulation-induced
intracavernous pressure responses (ICP) in F-344 rats in vivo. FASEB J 1999:A422.
21. Christ GJ. A new frontier: Gene therapy for erectile dysfunction. In: Current
Concepts in the treatment of Erectile Dysfunction. Morales A (Ed). Martin Dunitz
Publishers. London 1998:209-30.
22. Feldman HA, Goldstein I, Hatzichristou DG, et al. Construction of a surrogate
variable for impotence in the Massachusetts Male Aging Study. J Clin Epidimiol
1994; 47:457-67.
23. Christ GJ, Rehman J, et al. Transfection of rat corporal tissue in vivo
with hSlo cDNA is associated with physiologically relevant alterations in erectile
function. Am J Physiol 1998; 275:H600-H608.
24. Christ GJ, Smith WL, Santizo C, et al. K+ channel gene therapy is associated
with increased nerve-stimulated intracavernous pressure (ICP) responses despite
diminished neuronal innervation following 3-4 months of experimental diabetes
in rats. FASEB J 1999:A192.
25. Rehman J, Chenven E,Brink PR, et al. Diminished neurogenic but not pharmacologic-induced
intracavernous pressure responses in the 3 month Streptozocin-diabetic rat.
Am J Physiol 1997; 272:H1960-H1971.
26. Archer SL. Potassium channels and erectile dysfunction. Vascul Pharmacol
2002 Jan; 38(l):61-71. ISSN: 1537-1891.
27. Burnett AL, et al. Novel no signaling mechanisms regulate the erectile response.
Int J Impot Res 2004; (Suppl 16)I:S15-19. ISSN: 0955-9930.
28. Christ GJ, et al: The role of gap junctions and ion channels in the modulation
of electrical and chemical signaling in human corpus cavernosum smooth muscle.
Int J Impot Res 1993; 5:77.
29. Christ GJ, et al. Gap junctions and ion channels: relevance to erectile
dysfunction. Int J Impot Res 2000; (Suppl 14):SI5-25.
30. Christ GJ, et al. Frontiers in gene therapy for erectile dysfunction. Int
J Impot Res 2003; 15(Suppl 5):S33-40. ISSN: 0955-9930.
31. Hashitani H, Fukuta H, Dickens EJ, Suzuki H. Cellular mechanisms of nitric
oxide-induced relaxation of corporeal smooth muscle in the guinea-pig. J Physiol
2002 Jan 15; 538(Pt 2):573-81. ISSN: 0022-3751.
32. Ignarro LJ, et al. NO and cGMP formaton upon electrical stimulation cause
relaxation of corpus cavernosus smooth muscle. Biochem Biophys Res Commun 1990;
170:843.
33. McKenna KE. Central control of penile erection. Int J Impot Res 1998; (Suppl
1):S25.
34. Moncada S. The 1[st] Robert Furchgott lecture: From endothelin-dependent
relaxation to the L-arginine: NO pathway. Blood Vessels 1990; 27:208.
35. Moreno AP, et al. Gap junctions between human corpus cavernosus cells: Gating
properties and urinary conductance. Am J Physiol 1993; 264:C80.
36. Murray RK. Muscle. In: Harper's Biochemistry. 24th ed. Appleton & Lange
1996.
37. Putnam AJ, Cunningham JJ, Pillemer BB, Mooney DJ. External mechanical strain
regulates membrane targeting of Rho GTPases by controlling microtubule assembly.
Am J Physiol Cell Physiol 2003 Mar; 284(3):C627-39. ISSN: 0363-6143.
38. Rees RW, et al. Human and rabbit cavernosal smooth muscle cells express
Rho-kinase. Int J Impot Res 2002 Feb; 14(1):1-7. ISSN: 0955-9930.
39. De Tejada S, et al. Cholinergic neurotransmission in human corpus cavernosum.
I. Response in isolated tissue. Am J Physiol 1988a; 254:H459.
40. De Tejada S, et al. Regulation of pre-synaptic alpha adrenergic activity
in corpus cavernosum. Int J Impot Res 2000; 12(Suppl 1):820-25.
41. Suh DD, et al. Nocturnal penile tumescence and effects of complete spinal
cord injury: possible physiologic mechanisms. J Urol 2003; 61(1):184-189.