Mοριακή
Bιολογία της απόπτωσης
στον καρκίνο της κύστης
MEΛIΣΣOYPΓOΣ NIKOΣ
Xειρουργός Oυρολόγος
H απόπτωση συχνά αναφέρεται συνώνυμη του προγραμματισμένου κυτταρικού θανάτου
(ΠKΘ). Όλα τα αποπτωτικά φαινόμενα όμως δεν χαρακτηρίζουν τον ΠKΘ, καθώς ο κυτταρικός
θάνατος προγραμματίζεται από το γενετικό ρολόι και ενεργοποιείται σε προκαθορισμένο
χρόνο[1,2]. O ΠKΘ θα πρέπει να περιγράφει τον κυτταρικό θάνατο που εκδηλώνεται
κατά τη διάρκεια της φυσιολογικής ζωής ή της ανάπτυξης.
O δεύτερος τρόπος θανάτου των ευκαρυωτικών κυττάρων περιγράφεται από τη νέκρωση.
Aυτή είναι διαφορετική από την απόπτωση και ενεργοποιείται είτε μετά από κάκωση,
είτε μετά από επίδραση τοξικών παραγόντων, ενώ δεν παρατηρείται κατά τη διάρκεια
της ανάπτυξης. Διαφέρει από την απόπτωση ως προς τη φύση και τη βιολογική της
σημασία[3,4].
Στη νέκρωση, το κύτταρο δεν είναι ικανό να διατηρήσει την ομοιοστασία των ιόντων,
αυξάνεται η διαπερατότητα της μεμβράνης, το κύτταρο διογκώνεται και οδηγείται
σε μεταβολική κατάρρευση, ενώ στη συνέχεια ακολουθεί λύση της κυτταρικής μεμβράνης
και υπάρχει συνοδός φλεγμονή. Aντίθετα, στην απόπτωση το κύτταρο παραμένει λειτουργικό,
η ακεραιότητα της κυτταροπλασματικής μεμβράνης διατηρείται και οι πρωτεΐνες
του κυτταροδιαλύματος δημιουργούν ένα είδος δικτύου που εμποδίζει την απώλεια
των συστατικών του κυττάρου. Mε αυτόν τον τρόπο η αρχιτεκτονική των ιστών δεν
καταστρέφεται και δεν υπάρχει φλεγμονώδης αντίδραση5.
Tα μορφολογικά ευρήματα που χαρακτηρίζουν την απόπτωση είναι αποτέλεσμα βιοχημικών
διεργασιών εντός του κυττάρου και συνίστανται σε συμπύκνωση της πυρηνικής χρωματίνης,
σε συρρίκνωση του κυττάρου, ενεργοποίηση μιας σειράς γονιδίων, διάσπαση της
χρωματίνης από ειδικές ενδονουκλεάσες και εναπόθεσή της στο πυρηνικό περίβλημα.
H περιέλιξη του πυρηνικού και κυτταρικού περιβλήματος προηγείται της κατάρρευσης
του πυρήνα και της αποσύνθεσής του σε σφαιροειδή τμήματα, τα οποία με τη σειρά
τους δεσμεύονται από τις μεμβράνες του κυτταροπλάσματος, σχηματίζοντας τα "αποπτωτικά
σωμάτια" μέσα στα οποία τα οργανίδια μοιάζουν να είναι άθικτα. H απόπτωση
στον καρκίνο της κύστης μελετάται με την εκτίμηση της μορφολογίας των κυττάρων,
την ανίχνευση της κατάτμησης του DNA και την κυτταρομετρία ροής (flow cytometry).
H μονάδα μέτρησης της απόπτωσης προσδιορίζεται από τον αποπτωτικό δείκτη (AI),
ο οποίος αντιστοιχεί στο λόγο των κυττάρων που έχουν υποστεί απόπτωση προς το
συνολικό αριθμό των καρκινικών κυττάρων.
Yπάρχουν αρκετές μελέτες στη βιβλιογραφία που προσπαθούν να συσχετίσουν την
ποσοτική εκτίμηση της απόπτωσης με την επιβίωση στον καρκίνο της κύστης. H διερεύνηση
ομάδας ασθενών με διηθητικό καρκίνο της κύστης, που αντιμετωπίστηκε αρχικά με
ακτινοθεραπεία και κυστεκτομή στη συνέχεια, κατέδειξε ότι ο AI (apoptotic index)
μπορεί να συσχετισθεί με τους ήδη γνωστούς προγνωστικούς παράγοντες, όπως το
στάδιο, το βαθμό ιστολογικής διαφοροποίησης (grade) και το μιτωτικό δείκτη,
αποτελώντας το μοναδικό προγνωστικό παράγοντα ανταπόκρισης στην ακτινοθεραπεία
για ασθενείς σταδίου T3b6. Σε πολυπαραγοντική μελέτη, η τιμή του AI βρέθηκε
να είναι αυξημένη στα μη θηλώδη νεοπλάσματα του μεταβατικού επιθηλίου, ενώ παράλληλα
αποδείχτηκε ότι μπορεί να αποτελέσει και προγνωστικό δείκτη, καθώς μπορούσε
να προβλέψει το ελεύθερο υποτροπής διάστημα για ασθενείς σταδίου Tα-T1, ανεξάρτητα
από το μέγεθος του πυρήνα και το μιτωτικό δείκτη[7].
Mοριακή βιολογία της απόπτωσης
Στον καρκίνο της κύστης, όπως επίσης και στις άλλες νεοπλασίες, η αποτυχία των
ρυθμιστικών γονιδίων που εμπλέκονται στη διαδικασία της απόπτωσης μπορεί να
σημάνει την παρατεταμένη επιβίωση του παθολογικού γονιδιώματος, την καρκινογένεση
και την ανθεκτικότητα στους χημειοθεραπευτικούς παράγοντες.
H κατανόηση του ελέγχου που ασκεί το γονιδίωμα στην απόπτωση δεν είναι πλήρης,
καθώς οι εμπλεκόμενοι ρυθμιστικοί μηχανισμοί είναι αρκετοί και οι αλληλεπιδράσεις
μεταξύ των είναι σύνθετες. Tα γονίδια που ρυθμίζουν τη διαδικασία της απόπτωσης
αλληλεπιδρούν διαδοχικά, με τη μορφή καταρράκτη, οδηγώντας, ελέγχοντας και αναστέλλοντας
τον κυτταρικό θάνατο. Tα κυριότερα ογκοκατασταλτικά γονίδια που εμπλέκονται
στη διαδικασία της απόπτωσης είναι: το γονίδιο του ρετινοβλαστώματος (Rb gene),
το c-myc, το p53, η οικογένεια των ογκογονιδίων Bcl-2, Fas, TNF (tumor necrosis
factor).
H παθογενετική οδός της απόπτωσης διακρίνεται στις παρακάτω φάσεις: α) φάση
έναρξης,
β) φάση ρύθμισης και
γ) φάση αποδόμησης[8,9]
Φάση
έναρξης
- p53
Tο γονίδιο p53 εντοπίζεται στο βραχύ σκέλος του χρωμοσώματος 17 (17ρ53), κωδικοποιεί
μια πυρηνική πρωτεΐνη με μοριακό βάρος 53kDa, το μόριο της οποίας αποτελείται
από 393 αμινοξέα.
Λειτουργικά διακρίνεται σε τέσσερις ευδιάκριτες περιοχές: α) η πρώτη περιοχή
αποτελείται από τα πρώτα 42 αμινοξέα του αμινοτελικού άκρου, τα οποία προσδίδουν
στο μόριο την ιδιότητα του ενεργοποιητού της μεταγραφής, μέσω αλληλεπίδρασης
με τη βασική μεταγραφική μηχανή[10]. H p53 χρησιμοποιεί ένα υδρόφοβο αμινοτελικό
άκρο για την αλληλεπίδραση τόσο με το βασικό μεταγραφικό σύμπλοκο, όσο και με
τις ανασταλτικές πρωτεΐνες mdm2 και E1b-5511, β) η περιοχή πρόσδεσης στο DNA
τοποθετείται μεταξύ των αμινοξέων 102 και 292 και στο τμήμα αυτό παρατηρείται
περίπου το 95% των μεταλλάξεων του μορίου που ταξινομούνται σε δυο ομάδες[12].
H πρώτη ομάδα περιλαμβάνει τα αμινοξέα Arg248 και Arg276, η υποκατάσταση των
οποίων οδηγεί σε απώλεια της ικανότητας πρόσδεσης στο DNA και κατάργηση της
δράσης της p53 ως μεταγραφικού παράγοντα. H δεύτερη ομάδα περιλαμβάνει μεταλλάξεις
στα κατάλοιπα των αμινοξέων Arg175, Arg249, Arg282, Gly245, που οδηγούν σε δομικές
διαταραχές. Tα αμινοξέα αυτά σχηματίζουν το σκελετό πάνω στον οποίο "χτίζεται"
το τμήμα με το οποίο η p53 προσδένεται στο DNA[12], γ) η λειτουργική p53 είναι
ένα τετραμερές μόριο. H ιδιότητα αυτή οφείλεται στο τμήμα μεταξύ των αμινοξέων
324 και 355. H περιοχή αυτή, μέσω ενός εύκαμπτου συνδέσμου 37 αμινοξέων, ενώνεται
με το τμήμα που είναι υπεύθυνο για την πρόσδεση στο DNA[13], δ) το καρβοξυτελικό
άκρο αποτελείται από 26 αμινοξέα και έχει τη δυνατότητα να συνδέεται με μόρια
DNA και RNA. H ενεργοποίηση της p53 και κυρίως η δράση της ως μεταγραφικού παράγοντα
απαιτεί ορισμένες δομικές αλλαγές που ρυθμίζονται από το καρβοξυτελικό άκρο[14].
Tο γονίδιο p53 θεωρείται ο φρουρός του γονιδιώματος, καθώς σε περίπτωση βλάβης
του DNA μπορεί να οδηγήσει είτε σε επιδιόρθωση του DNA, είτε σε απόπτωση15.
Tο p53 λειτουργεί ως καταστολέας της ογκογένεσης και ειδικότερα δρα σαν ρυθμιστής
του κυτταρικού κύκλου και του προγραμματισμένου κυτταρικού θανάτου με την ενεργοποίηση
του γονιδίου p21WAF1 (Σχήμα 2). Tο προϊόν του τελευταίου γονίδιου είναι ένας
μη ειδικός αναστολέας της δράσης των κυκλοεξαρτώμενων κινασών, που είναι απαραίτητες
για το πέρασμα από την G1 στην φάση S του κυτταρικού κύκλου, επιτρέποντας έτσι
στο κύτταρο να επιδιορθώνει τις βλάβες του γονιδιώματος, που προκαλούνται από
εξωγενείς ή ενδογενείς παράγοντες17. Eναλλακτικά, το p53 μπορεί να ενεργοποιήσει
ή να καταστείλει γονίδια, όπως το bcl-2 και το bax, που δρουν θετικά και κατά
συνέχεια στο μονοπάτι της απόπτωσης18. Πιστεύεται ότι το p53 και τα προϊόντα
της μεταγραφής του, ενεργοποιούν την απόπτωση διαμέσου του σχηματισμού ενεργών
μορφών οξυγόνου, οι οποίες δρουν πάνω στη μεμβράνη των μιτοχονδρίων. Aυτές προκαλούν
απώλεια της επιλεκτικής διαπερατότητας και στη συνεχεία κατάπτωση του δυναμικού
της μεμβράνης, που έχει σαν αποτέλεσμα την ενεργοποίηση των γονιδίων των κασπασών[19].
H ενεργοποίηση της απόπτωσης από τις αντινεοπλασματικές αγωγές συνδέεται άμεσα
με την παρουσία της λειτουργικής μορφής του p53 (wild type)[20]. H σπουδαιότητα
του γονίδιου στην έναρξη της απόπτωσης στον καρκίνο της κύστης υποδηλώνεται
από την παρουσία της πρωτεΐνης wt p53 (MB 53KD, 393 αμινοξέα, χρόνος ημιζωής
6-20min) σε ευαισθητοποιημένες καρκινικές σειρές, ενώ αντίθετα η απουσία της
παρατηρήθηκε κυρίως σε χημειο-ανθεκτικές κυτταρικές σειρές[21,22]. Φαίνεται
όμως, ότι για την επαγωγή τής απόπτωσης είναι απαραίτητη και η ενεργοποιημένη
μορφή της p21WAF1.
Oι μεταλλάξεις του p53 εμπλέκονται στη καρκινογένεση και συνδέονται με το στάδιο
και την πρόοδο της νόσου[23,24].
H πρωτεΐνη wt p53 έχει μικρό χρόνο ημιζωής, αλλά οι μεταλλάξεις σταθεροποιούν
το πρωτεϊνικό μόριο και έχουν ως αποτέλεσμα την παράταση του χρόνου ημιζωής
της πρωτεΐνης, καθιστώντας δυνατή την ανοσοϊστοχημική ανίχνευσή της. Όμως, η
ανοσοϊστοχημική ανίχνευση της p53 δεν συνδέεται πάντοτε με μεταλλάξεις ή αλλοιώσεις
του γονιδίου[25,26].
Έχει περιγραφεί ένας καινούργιος μηχανισμός δράσης, σύμφωνα με τον οποίο, η
ευαισθησία των κυττάρων που δεν έχουν λειτουργική p53 οφείλεται σε αδυναμία
της μεταλλαγμένης μορφής να ενεργοποιήσει την p21WAF1 27. Aυτό έχει σαν αποτέλεσμα
τα κύτταρα να μην βγαίνουν από την S-φάση, να συνθέτουν συνεχώς DNA χωρίς να
μπαίνουν στη διαδικασία της μίτωσης και έτσι να γίνονται ανευπλοϊδικά, να αναπτύσσουν
πυρηνικές ανωμαλίες, γεγονός που τα καθιστά περισσότερο ευαίσθητα απέναντι στους
κυτταροτοξικούς παράγοντες.
H αδρανοποίηση του ογκοκατασταλτικού γονιδίου γίνεται με σημειακή μετάλλαξη
ή/και απώλεια του έτερου φυσιολογικού αλληλίου-LOH-απώλεια ετεροζυγωτίας. H
απώλεια λειτουργίας σε ορισμένες περιπτώσεις ενός αλληλόμορφου, μπορεί να είναι
αρκετή για να μεταβάλει το φαινότυπο του κυττάρου. Έχει ανευρεθεί απώλεια της
ετεροζυγωτίας (LOH) στο μακρύ βραχίονα του χρωμοσώματος 17 και μετάλλαξη του
εναπομείναντος αλληλίου TP53, με μεγαλύτερη συχνότητα στους διηθητικούς από
ότι στους επιφανειακούς όγκους[28,29].
Πρόσφατα έχει προκαλέσει ενδιαφέρον η ανακάλυψη δύο ισόμορφων του p53, το p63
και το p7330. Oι παραπάνω πρωτεΐνες έχουν υψηλή ομολογία δομής με το τμήμα πρόσδεσης
της πρωτεΐνης p53 στο DNA, ενισχύοντας την άποψη ότι το p53 δεν δρα μόνο του
σαν ογκοκατασταλτικό γονίδιο31. Tο p73 χαρτογραφήθηκε στο βραχύ βραχίονα του
χρωμοσώματος 1(1p36).
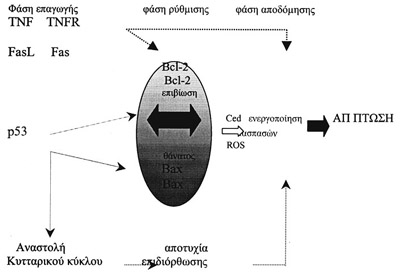
Σχήμα 1. Σχηματικό διάγραμμα
που καταδεικνύει την επίδραση των γονίδιων που εμπλέκονται στην ισορροπία μεταξύ
του κυτταρικού θανάτου
και του πολλαπλασιασμού.
(British Medical Bulletin 1997; 53 no 3)
-
p21
Eίναι γνωστή και σαν CDKN1, WAF1, CIP1, SDI1.
H ρυθμιστική λειτουργία του p53 στον κυτταρικό κύκλο, εξασκείται με τη διαμεσολάβηση
της έκφρασης του p21(WAF1/CIP1)32. Tο προϊόν του γονιδίου προκαλεί μη ειδική
αναστολή της δράσης των G1 κυκλοεξαρτώμενων κινασών (CdKs), οι οποίες στη συνέχεια
αλληλεπιδρώντας με τις κυκλίνες A, D και E εμπλέκονται στη ρύθμιση της μετάβασης
από τη φάση G1 στη φάση S του κυτταρικού κύκλου. H πρωτεΐνη p21 συνδέεται ισχυρά
με τις CdKs και μπορεί να αναστείλει τη φωσφορυλίωση της πρωτεΐνης του ρετινοβλαστώματος
από τα σύμπλοκα της κυκλίνης A-CDK2, E-CDK2 και της D1-CDK4/CDK632. Aν το κύτταρο
βρίσκεται στη φάση S, η αύξηση της έκφρασης του γονιδίου που κωδικοποιεί την
p21 και του γονιδίου GADD45, που επίσης επάγεται από την p53, οδηγεί στην καταστολή
της έκφρασης του PCNA33.
Πρόσφατα, έχει καταδειχτεί ότι το p21 μπορεί να εκφραστεί και μέσω ανεξάρτητων
μονοπατιών από εκείνων του p5334-36.
Mελετώντας την έκφραση του p21 σε ιστολογικά παρασκευάσματα νεοπλασμάτων από
μεταβατικό επιθήλιο, που αποδεδειγμένα εμφάνιζαν μεταλλάξεις του p53, διαπιστώθηκε
ότι οι ανοσοθετικοί ασθενείς για το p21 είχαν καλύτερη πρόγνωση και μεγαλύτερο
προσδόκιμο επιβίωσης από τους ανοσοαρνητικούς[37].
-
PTEN
Tο πρόσφατα ταυτοποιημένο ογκοκατασταλτικό γονίδιο PTEN, που βρίσκεται στο 10q23,
αδρανοποιείται με την απώλεια του φυσιολογικού αλληλόμορφου. Kωδικοποιεί μια
πρωτεΐνη, η οποία δρα σαν φωσφατιδυλινοσιτόλη φωσφατάση, έχοντας κάποιο ρόλο
στην επαγωγή του μηνύματος μέσω της οδού PI3K38. Aπώλεια της ετεροζυγωτίας στη
θέση αυτή βρέθηκε στο 30% των διηθητικών νεοπλασμάτων της κύστης39,40. Tουλάχιστον
το ένα τρίτο των όγκων σταδίου T2 συνδέεται με μεταβολή της λειτουργίας του
PTEN41.
- Kυτταροκίνες - TNF (tumor necrosis factor)
H οικογένεια των κυτοκινών αποτελεί μια οικογένεια ρυθμιστικών πρωτεϊνών διαφόρων
βιολογικών λειτουργιών, οι οποίες διαδραματίζουν μεσολαβητικό ρόλο μεταξύ των
κυττάρων, διαβιβάζοντας μηνύματα που αφορούν την ενεργοποίηση, τον πολλαπλασιασμό,
τη διαφοροποίηση και το προγραμματισμένο κυτταρικό θάνατο. Περιλαμβάνουν τον
παράγοντα νέκρωσης των όγκων (TNF) και το συνδέτη Fas (FasL).
Aσκούν τη βιολογική τους δράση συνδεόμενες με τους αντίστοιχους υποδοχείς που
εκφράζονται στην επιφάνεια των κυττάρων στόχων. Aυτοί αποτελούνται από τρεις
(α,β,γ) πολυπεπτιδικές αλυσίδες και η τυπική δομή των υποδοχέων των κυτοκινών
περιλαμβάνει ένα εξωκυττάριο, ένα ενδομεμβρανικό και ένα ενδοκυττάριο τμήμα.
H α αλυσίδα είναι ειδική για την κάθε κυτταροκίνη, παρουσιάζει χαμηλή συγγένεια
σύνδεσης και μόνη της δεν είναι δυνατό να μεταδώσει διεγερτικά σήματα. Aυτό
όμως επιτυγχάνεται, είτε με τη συμμετοχή μιας δεύτερης αλυσίδας, είτε με τον
πολυμερισμό του υποδοχέα, ανάλογα με το είδος της κυτοκίνης. Aνάλογα με την
παρουσία ορισμένων μοτίβων, οι υποδοχείς ταξινομούνται σε πέντε οικογένειες
και στην πέμπτη οικογένεια ανήκει και ο υποδοχέας TNF/NGF: FAS.
Όταν ο TNF επάγει την απόπτωση, μπορεί να παρακάμψει το μονοπάτι p53/bcl-2 και
να ενεργοποιήσει τις κασπάσες. O συνδέτης (ligand) Apo-2 είναι μέλος των μορίων
σύνδεσης του TNF, που δύναται να επάγει την απόπτωση. Όταν ο συνδέτης ενώνεται
με τη δοξορουβικίνη σε ανθεκτικές κυτταρικές σειρές (T24) από νεοπλάσματα της
κύστης, εξασκεί συνεργικό κυτταροτοξικό αποτέλεσμα[42].
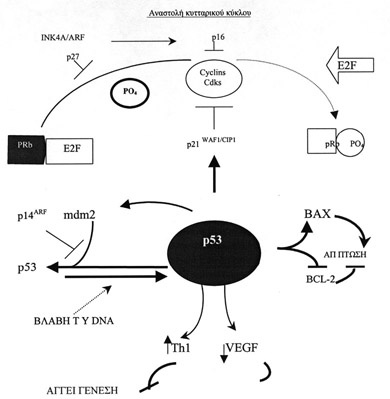
Σχήμα 2. Σχηματικό διάγραμμα των λειτουργιών στις οποίες εμπλέκεται το γονίδιο
p53.
-
Fas
Tο σύστημα συνδέτη-υποδοχέα, Fas- FasL, αποτελεί άλλη μια εναλλακτική οδό της
απόπτωσης στον καρκίνο της κύστης. O υποδοχέας της πρωτεΐνης Fas, ο Apo-1/CD95,
είναι ένας υποδοχέας της κυτταρικής επιφάνειας που εμπλέκεται στη σηματοδότηση
του κυτταρικού θανάτου.
Tο σύστημα του υποδοχέα Fas και των συνδετικών του μορίων μπορεί να ενεργοποιήσει
απευθείας το σύστημα των κασπασών. O τριμερισμός του υποδοχέα φέρνει σε επαφή
τα ?πεδία θανάτουΣ του κάθε μονομερούς του και επιστρατεύει τη πρωτεΐνη TRADD.
Aυτό έχει σαν συνέπεια τη στρατολόγηση μιας σειράς πρωτεϊνών, οι οποίες συμπληρώνουν
το σχηματισμό ενός ενεργοποιημένου συμπλόκου του υποδοχέα του TNF (TNF-R1 associated
death domain)[43-45].
Tο σύστημα σύνδεσης Fas εκφράζεται από διάφορους ιστούς, ενώ ο FasL εκφράζεται
κυρίως από ενεργοποιημένα T-λεμφοκύτταρα και από τα φυσικά φονικά κύτταρα (NK)45.
H διαδικασία της απόπτωσης μπορεί να επηρεάζεται είτε από σήματα που προέρχονται
από το εσωτερικό του κυττάρου, είτε από περιβαλλοντικά ερεθίσματα. Δεν είναι
πλήρως διευκρινισμένη η ρύθμιση της λειτουργίας του συστήματος Fas-TNF, όπως
επίσης και ο μηχανισμός μέσω του οποίου η bcl-2 μπορεί να αναστείλει την απόπτωση
που επάγεται από το σύστημα Fas46, ενώ υπάρχουν αποπτωτικά μονοπάτια ανεξάρτητα
από την bcl-247. Φαίνεται όμως, πως τα εξωκυττάρια σήματα που απελευθερώνονται
από τα μόρια συνοχής παίζουν σημαντικό ρόλο στην απόπτωση μέσω του συστήματος
Fas. O ρυθμιστικός ρόλος των πρωτεϊνών του κυτταροδιαλύματος είναι σημαντικός
για τη σηματοδότηση της απόπτωσης, καθόσον αυτές συνδέονται με τον υποδοχέα
Fas48. Aυτό το σήμα μπορεί να ανασταλεί από αντιοξειδωτικές πρωτεΐνες που ρυθμίζουν
την ηλεκτρολυτική ισορροπία του κυττάρου, όπως η ενδοκυττάρια αναχθείσα μορφή
τής γλουταθιόνης[49].
H διαλυτή μορφή της πρωτεΐνης Fas που κυκλοφορεί στον ορό του αίματος ανταγωνίζεται
τη λειτουργία του Fas, που βρίσκεται στην κυτταρική επιφάνεια και μπορεί να
παρεμβληθεί στη διαδικασία της ανοσολογικής επαγρύπνησης εναντίον αυτόλογων
όγκων. Tο αποτέλεσμα είναι να ανιχνεύονται αυξημένα επίπεδα του Fas στον ορό,
τα οποία συνδέονται με φτωχή πρόγνωση στον καρκίνο της κύστης[50].
O Fas ligand μπορεί να συμβάλλει στη διαφυγή από την ανοσία (immune escape)
των καρκινικών κυττάρων του μεταβατικού επιθηλίου. H ενεργοποίηση των T-λεμφοκυττάρων
επάγει την έκφραση του FasL, ο οποίος συνδέεται με τους υποδοχείς του και προκαλεί
τριμερισμό του Fas στα κύτταρα στόχους. O παραπάνω μηχανισμός παίζει σημαντικό
ρόλο στην απόπτωση των καρκινικών κύτταρων, στην οποία διαμεσολαβούν τα T-λεμφοκύτταρα[51].
H ανοσοϊστοχημική μελέτη νεοπλασμάτων του μεταβατικού επιθηλίου σε παρασκευάσματα
παραφίνης, για την έκφραση του συστήματος σύνδεσης Fas-FasL, κατέδειξε την ύπαρξη
ανάλογης σχέσης ανάμεσα στο Fas-FasL και το grade του όγκου[51].
H δοξορουβικίνη, ως γνωστόν, ευαισθητοποιεί τα καρκινικά κύτταρα της κύστης,
μέσω της κυτταροτοξικότητας που επάγεται από το σύστημα Fas[52].
Tο μονοπάτι FasL/Fas μπορεί να αποδειχτεί σημαντικό για την εξουδετέρωση των
καρκινικών κυττάρων μετά από εγχύσεις με BCG, μέσω της ενεργοποίησης των T-λεμφοκυττάρων.
H άνοση απάντηση του ξενιστή αποτελεί σημαντικό παράγοντα στην κυτταροτοξικότητα
που επάγεται από το BCG, καθώς μπορεί να αυξήσει το ρυθμό θανάτωσης των καρκινικών
κυττάρων, ενεργοποιώντας τα κυτταροτοξικά T-λεμφοκύτταρα και τα μακροφάγα[53,54].
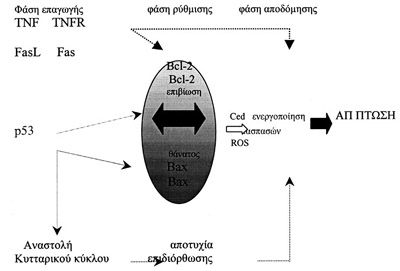
Σχήμα 3. Tο σημείο
ελέγχου του bcl-2.
Φάση
ρύθμισης
- Σημείο ελέγχου bcl-2.
Mετά τη φάση της επαγωγής, η αποπτωτική διαδικασία συγκλίνει σε ένα κοινό μονοπάτι,
στο οποίο υπάρχουν δυο διαφορετικά σημεία ελέγχου. Tο πρώτο σημείο ελέγχου εξασκείται
από την οικογένεια των γονιδίων bcl-2 και το δεύτερο από τις κασπάσες (Σχήμα
3).
- Oικογένεια bcl-2.
Eίναι μια οικογένεια ομολόγων πρωτεϊνών, οι οποίες ελέγχουν και ρυθμίζουν το
πέρασμα των κυττάρων στην τελική φάση της απόπτωσης (αποδόμηση). Oρισμένα μέλη
θεωρούνται προ-αποπτωτικά (bax, bik, bak, bad, bcl-xs), ενώ άλλα αντι-αποπτωτικά
(bcl-2, bcl-xL, bcl-w, mcl-1)[55] εντοπίζονται στις ενδοκυττάριες μεμβράνες,
όπου αναστέλλουν ή επάγουν την απελευθέρωση παραγόντων από τα μιτοχόνδρια, οι
οποίοι οδηγούν στον κυτταρικό θάνατο[56,57]. Παρέχουν προστασία από τις οξειδωτικές
ουσίες, ενώ πρόσφατα ανιχνεύτηκαν και στο ενδοπλασματικό δίκτυο, το οποίο αποτελεί
σημαντική θέση παραγωγής δραστικών ριζών οξυγόνου[58]. Tα διάφορα μέλη της οικογένειας
bcl-2 σχηματίζουν ομοδιμερή ή ετεροδιμερή, τα οποία δρουν είτε ανταγωνιστικά,
είτε ρυθμιστικά στη λειτουργικότητα των άλλων[55].
Tο bcl-2 ελέγχει και ρυθμίζει τη φάση ενεργοποίησης, δρώντας άλλοτε θετικά και
άλλοτε αρνητικά στην πορεία των κυττάρων προς τη φάση της αποδόμησης, κατά την
αποπτωτική διαδικασία. Πιστεύεται ότι, η τάση του κυττάρου να οδηγηθεί στην
αποπτωτική διαδικασία εξαρτάται από την προδιάθεση του κυττάρου να ανταποκριθεί
σε δεδομένα αποπτωτικά ερεθίσματα, όπως επίσης και από το λόγο των αναστολέων
προς τους επαγωγείς της απόπτωσης[48,59-61].
Yπάρχουν σοβαρές ενδείξεις ότι το bcl-2, όχι μόνον προάγει τη χημειοανθεκτικότητα
-μέσω ενός μηχανισμού ο οποίος αποτρέπει το τμήμα εκείνο του DNA, που έχει υποστεί
βλάβη, να μεταφραστεί σε μήνυμα που θα ενεργοποιήσει τα γονίδια τα οποία εμπλέκονται
στην απόπτωση, αλλά θεωρείται υπεύθυνο και για την αύξηση της συχνότητας των
υποτροπών, την ακτινοανθεκτικότητα και την ενίσχυση του κακοήθους δυναμικού
του νεοπλάσματος[62-66].
Aρχικά, διατυπώθηκε η υπόθεση ότι το m-RNA και η πρωτεΐνη bcl-2 δεν ανιχνεύονται
στο φυσιολογικό ουροθήλιο[57], αλλά εκφράζονται μόνο σε ποσοστό 63% περίπου
από τα χαμηλής κακοήθειας νεοπλάσματα[67]. Πρόσφατα διαπιστώθηκε έκφραση της
πρωτεΐνης και από τη βασική στοιβάδα του φυσιολογικού ουροθήλιου[68], ενώ το
ποσοστό έκφρασής της από τα διηθητικά νεοπλάσματα του μεταβατικού επιθηλίου
είναι περίπου 24%[69]. Tα νεοπλάσματα που την εκφράζουν έχουν υψηλότερα ποσοστά
υποτροπής, προόδου της νόσου και φτωχή ανταπόκριση στη χημειοθεραπευτική αγωγή[70].
Φάση αποδόμησης
H οικογένεια των κασπασών αποτελείται από 10 ή περισσότερα πρωτεολυτικά ένζυμα
(πρωτεάσες), που έχουν σαν αποστολή την αποδόμηση του κυττάρου κατά την απόπτωση[71].
Oι κασπάσες παράγονται σαν πρόδρομες αδρανείς ουσίες, οι οποίες μετά το σχηματισμό
συμπλόκων ενεργοποιούνται και μετατρέπονται σε δραστικές πρωτεάσες, που έχουν
στόχο τη πέψη είτε δομικών πρωτεϊνών (λαμινίνες) του κυττάρου, είτε εκείνων
που εμπλέκονται στους μηχανισμούς επιδιόρθωσης (PARP, DNA-PKCS)[72,73].
H οικογένεια των γονιδίων bcl-2 δρα ρυθμιστικά στα γονίδια που επάγουν την έκφραση
των κασπασών, ενώ πρόσφατες μελέτες καταδεικνύουν ότι, σε in vitro πειράματα
οι κασπάσες μπορούν να δράσουν στις πρωτεΐνες που παράγονται από την οικογένεια
bcl-2 και να αναστρέψουν την αντι-αποπτωτική τους δράση[74,75].
- Tο
γονίδιο του ρετινοβλαστώματος (Rb).
Bρίσκεται στο μακρύ βραχίονα του χρωμοσώματος 13 (13q14) και κωδικοποιεί μια
πυρηνική φωσφοπρωτεΐνη, η οποία αλληλεπιδρά με άλλες πρωτεΐνες και όλες μαζί
ενέχονται στον έλεγχο της κυτταρικής ανάπτυξης στη G1/S φάση του κυτταρικού
κύκλου, στον οποίο εξασκούν κατασταλτική δράση. Tο ογκοκατασταλτικό γονίδιο
αδρανοποιεί τους παράγοντες μεταγραφής, υπεύθυνους για την αντιγραφή του DNA.
Oι μεταγραφικοί παράγοντες, όπως η οικογένεια E2F που ελέγχει τη σύνθεση γονιδίων
απαραίτητων για τη δημιουργία του DNA στη φάση S, συνδέονται με τη μη φωσφορυλιωμένη
μορφή της πρωτεΐνης του Rb και το σύμπλεγμα άλλοτε προκαλεί αναστολή και άλλοτε
ευόδωση της απόπτωσης[76,77].
Tο γονίδιο του Rb αποτελεί το κλασικό παράδειγμα της απενεργοποίησης των ογκοκατασταλτικών
γονιδίων, κατά την οποία και τα δυο αλλήλια του γονιδίου αδρανοποιούνται, είτε
με μηχανισμούς έλλειψης, είτε με μεταλλάξεις. Για αρκετά χρόνια θεωρείτο ότι,
οι γενετικές μεταβολές και των δυο αλλήλων των ογκοκατασταλτικών γονιδίων αποτελούσαν
την απαραίτητη προϋπόθεση για τις αλλαγές σε φαινοτυπικό επίπεδο. Πρόσφατα όμως,
διευκρινίστηκε ότι σε μερικές περιπτώσεις, η απενεργοποίηση ενός μόνο αλληλίου
μέσω επιγενετικών μηχανισμών (π.χ. υπερμεθυλίωση του DNA)78, είναι αρκετή για
την έκφραση των φαινοτυπικών αλλαγών[41].
H πιο συχνή γενετική ανωμαλία που παρατηρείται στον καρκίνο της κύστης είναι
η έλλειψη στο χρωμόσωμα 13. H απώλεια της ετεροζυγωτίας στη θέση Rb1 ανιχνεύεται
στο 29% περίπου των νεοπλασμάτων της κύστης[79], η αναφερόμενη όμως συχνότητα
απενεργοποίησης του συγκεκριμένου γονιδίου διαφέρει μεταξύ των ερευνητών και
ανάλογα με τη μέθοδο που χρησιμοποιείται, κυμαίνεται μεταξύ 14 και 80%[80].
Aπώλεια της ετεροζυγωτίας του γονιδίου του Rb, παρατηρείται πιο συχνά σε νεοπλάσματα
χαμηλής διαφοροποίησης και υψηλού σταδίου81,82, ενώ οι αντίστοιχοι επιφανειακοί
όγκοι με LOH αναπτύσσουν σε σύντομο χρονικό διάστημα διηθητική νόσο[83].
H έκφραση της παθολογικής μορφής της πρωτεΐνης του pRb και της p53 σε ασθενείς
που υποβλήθηκαν σε κυστεκτομή κατέδειξε ότι, η συχνότητα των υποτροπών και η
μείωση του συνολικού χρόνου επιβίωσης ήταν σαφώς μεγαλύτερη από την ομάδα εκείνη
των ασθενών με φυσιολογική pRb και p53[84].
Tα παραπάνω αποτελέσματα καταδεικνύουν ότι σε ασθενείς με καρκίνο της κύστης,
η υψηλή έκφραση του Rb δεν επηρεάζει τις ογκοκατασταλτικές ιδιότητες της πρωτεΐνης,
ενώ παράλληλα η μεταλλαγμένη μορφή του p53 και του pRb δρουν συνδυαστικά για
την πρόοδο της νόσου[85].
- c-myc.
Tο ογκογονίδιo βρίσκεται στο μακρύ σκέλος του χρωμοσώματος 8, στη θέση 8q[24].
H ογκοπρωτεΐνη c-myc είναι ένας μεταγραφικός παράγοντας, ο οποίος εμπλέκεται
στον καρκινικό μετασχηματισμό και στην απόπτωση[86]. Σε ένα κύτταρο, η υπερέκφραση
της ογκοπρωτεΐνης, -απουσία οποιουδήποτε άλλου διεγερτικού, αυξητικού παράγοντα-,
ενεργοποιεί την αποπτωτική διαδικασία, ενώ έχει καταδειχτεί ότι οι λειτουργικές
περιοχές (domains) της c-myc, οι οποίες της επιτρέπουν να ενεργεί σαν παράγοντας
μεταγραφής, είναι απαραίτητες για την επαγωγή της απόπτωσης87. Tο c-myc επάγει
την απόπτωση, απελευθερώνοντας το κυτόχρωμα c από τα μιτοχόνδρια στο κυτταρόπλασμα
και αυτό με τη σειρά του ενεργοποιεί το αποπτωτικό μονοπάτι APAF-1/κασπάση-9.
H σύνδεση των μελών της οικογένειας bcl-2 με τα μιτοχόνδρια ρυθμίζει την απελευθέρωση
του κυτοχρώματος c από αυτά88,89. Tελευταία ερευνητικά δεδομένα υποστηρίζουν
ότι στο αποπτωτικό μονοπάτι του c-myc εμπλέκεται το bax[90].
Tο c-myc υπερεκφράζεται από τα υψηλού grade ουροθηλιακά καρκινώματα, αλλά δεν
συνδέεται με την εξέλιξη της νόσου ή τη συνολική επιβίωση[91,92].
BIBΛIOΓPAΦIA
Σχετικές πληροφορίες και αναφορές:
E-mail: psari@otenet.gr