Άρθρο ενημέρωσης
Θεραπεία ορμονικής υποκατάστασης
και καρκίνος του μαστού
Μ. Ζαφράκας
Δ.Γ. Γουλής
Ι. Παπαδήμας
Ι. Μπόντης
Α΄ Μαιευτική
- Γυναικολογική Κλινική Α.Π.Θ., Γ.Ν.Θ. "Παπαγεωργίου".
Αλληλογραφία:
Μ. Ζαφράκας
Α΄ Μαιευτική - Γυναικολογική Κλινική
Α.Π.Θ.
Γενικό Νοσοκομείο "Παπαγεωργίου"
Περιφερειακή Οδός Θεσσαλονίκης
N. Ευκαρπία
56403 Θεσσαλονίκη
τηλ: 2310-693131
email: mzafrakas@hotmail.com
Κατατέθηκε: 08/2/05
Εγκρίθηκε: 20/6/05
Περίληψη
Η θεραπεία ορμονικής υποκατάστασης
(ΘΟΥ) μετά την εμμηνόπαυση είναι αναμφισβήτητα αποτελεσματική για τον έλεγχο
των αγγειοκινητικών συμπτωμάτων και της ουρογεννητικής ατροφίας, καθώς και για
την πρόληψη των καταγμάτων σε έδαφος οστεοπόρωσης. Ωστόσο, η ΘΟΥ δεν προφυλάσσει
από τα νοσήματα του καρδιαγγειακού συστήματος, όπως πιστευόταν μέχρι πρόσφατα,
ενώ ορισμένες μορφές της αυξάνουν τον κίνδυνο εμφάνισης καρκίνου του μαστού.
Λίγα μόνο από τα διαθέσιμα δεδομένα σχετικά με τη χορήγηση ΘΟΥ, τόσο σε γυναίκες
με ελεύθερο ιστορικό όσο και σε ασθενείς με καρκίνο του μαστού, προέρχονται
από προοπτικές, τυχαιοποιημένες μελέτες με αποτέλεσμα πολλά ερωτήματα να μην
έχουν ακόμη απαντηθεί οριστικά. Τα μέχρι σήμερα δεδομένα από τη βασική έρευνα
και τις κλινικές μελέτες συγκλίνουν στο ότι η ΘΟΥ με συνδυασμό οιστρογόνου -
προγεσταγόνου και σε μικρότερο βαθμό η μονοθεραπεία με οιστρογόνα προκαλούν
αύξηση του κινδύνου εμφάνισης καρκίνου του μαστού σε γυναίκες με ελεύθερο ιστορικό.
Αν και για την τιμπολόνη υπάρχουν λίγα μόνο δεδομένα, η συνθετική αυτή ουσία
δεν θα πρέπει να θεωρείται εκ των προτέρων ασφαλής. Το εάν η ΘΟΥ προκαλεί νέες
περιπτώσεις καρκίνου ή απλώς επιταχύνει την εξέλιξη όγκων που προϋπάρχουν, καθώς
και το εάν επηρεάζει την πρόγνωση του καρκίνου του μαστού είναι ερωτήματα που
δεν έχουν ακόμη απαντηθεί. Σε γυναίκες με ιστορικό καρκίνου του μαστού η ανάγκη
χορήγησης ΘΟΥ αποτελεί συχνά ένα δυσεπίλυτο πρόβλημα, κυρίως σε περιπτώσεις
που η ασθενής λαμβάνει ορμονική θεραπεία που προκαλεί ή επιδεινώνει τα συμπτώματα
της εμμηνόπαυσης. Ανεξάρτητα από το ιστορικό, η χορήγηση ΘΟΥ θα πρέπει να γίνεται
εξατομικευμένα με πλήρη ενημέρωση της ασθενούς, ενώ δεν θα πρέπει να παραλείπεται
η ενημέρωση για εναλλακτικές θεραπευτικές προσεγγίσεις και γενικά μέτρα αντιμετώπισης
των εκάστοτε συμπτωμάτων.
Λέξεις ευρετηρίου: θεραπεία ορμονικής υποκατάστασης, καρκίνος μαστού, συνδυασμένη θεραπεία οιστρογόνου - προγεσταγόνου, μονοθεραπεία με οιστρογόνα, τιμπολόνη.
ΕΙΣΑΓΩΓΗ
Η θεραπεία ορμονικής υποκατάστασης
(ΘΟΥ) άρχισε να χορηγείται από τη δεκαετία του '50 με σκοπό την αντιμετώπιση
των συμπτωμάτων της εμμηνόπαυσης(1). Τα πρώτα σκευάσματα που χρησιμοποιήθηκαν
περιείχαν μόνο οιστρογόνα, αλλά ήδη από τη δεκαετία του 1970 έγινε φανερό ότι
η μονοθεραπεία με οιστρογόνα αυξάνει τον κίνδυνο υπερπλασίας και καρκίνου του
ενδομητρίου(2-4). Για να μειωθεί ο κίνδυνος για τις παραπάνω παθήσεις άρχισαν
να χρησιμοποιούνται σκευάσματα που περιέχουν τόσο οιστρογόνα όσο και προγεσταγόνα(5,6).
Έτσι, σε γυναίκες που έχουν υποστεί υστερεκτομή μπορεί να χορηγηθεί μονοθεραπεία
με οιστρογόνα, ενώ σε αυτές που διατηρούν ακόμη τη μήτρα προτιμάται ο συνδυασμός
οιστρογόνου - προγεσταγόνου(7).
Η αποτελεσματικότητα των οιστρογόνων για την αντιμετώπιση των συμπτωμάτων της
εμμηνόπαυσης είναι αδιαμφισβήτητη. Τα οιστρογόνα βελτιώνουν σημαντικά τα αγγειοκινητικά
συμπτώματα (εξάψεις, εφίδρωση, αίσθημα παλμών, διαταραχές ύπνου) και την ουρογεννητική
ατροφία, με επακόλουθο τη μείωση της συχνότητας των λοιμώξεων του κατώτερου
ουροποιητικού συστήματος, της ξηρότητας του κόλπου και της δυσπαρεύνειας. Επιπρόσθετα,
πρόσφατες μελέτες επιβεβαίωσαν ότι η ΘΟΥ ελαττώνει τον κίνδυνο καταγμάτων σε
ασθενείς με οστεοπόρωση(8). Αντίθετα, η ΘΟΥ δεν προφυλάσσει από τη στεφανιαία
νόσο και τα αγγειακά εγκεφαλικά επεισόδια, όπως πιστευόταν έως πρόσφατα(9,10)
και επιπλέον φαίνεται να αυξάνει τον κίνδυνο εμφάνισης καρκίνου του μαστού(11-13).
Φαίνεται μάλιστα ότι ο κίνδυνος είναι μεγαλύτερος σε γυναίκες που λαμβάνουν
συνδυασμό οιστρογόνου - προγεσταγόνου και αυξάνεται με τη διάρκεια της θεραπείας(14,15).
ΘΟΥ και κίνδυνος
καρκίνου του μαστού σε γυναίκες χωρίς προηγούμενο ιστορικό της νόσου
Ο υπολογισμός
του κινδύνου εμφάνισης καρκίνου του μαστού σε γυναίκες χωρίς προηγούμενο ιστορικό
της νόσου που λαμβάνουν ΘΟΥ στηρίζεται σε θεωρητικές προσεγγίσεις, στοιχεία
που προέρχονται από πειραματικές μελέτες της βασικής έρευνας και μελέτες παρατήρησης
(observational studies), ενώ λίγα μόνο είναι τα στοιχεία από προοπτικές, τυχαιοποιημένες
μελέτες με ομάδα ελέγχου (randomized controlled trials).
Σε ό,τι αφορά στη θεωρητική προσέγγιση του θέματος, κατ' αρχήν θα πρέπει να
ληφθεί υπόψη ο ρόλος που παίζουν διάφοροι ενδοκρινικοί παράγοντες στην εμφάνιση
του καρκίνου του μαστού. Συγκεκριμένα, η πρόωρη εμμηναρχή, η καθυστερημένη εμμηνόπαυση
και η ατοκία συνδέονται με αυξημένο κίνδυνο εμφάνισης της νόσου(16-22). Επίσης,
θα πρέπει να ληφθούν υπόψη και στοιχεία που προέρχονται από μελέτες της βασικής
έρευνας. Εργασίες σε φυσιολογικά επιθηλιακά κύτταρα μαστού μετά από πλαστικές
εγχειρήσεις για τη μείωση του μεγέθους κατά τα άλλα φυσιολογικών μαστών ή σε
υλικό από νεκροτομές έδειξαν ότι η αύξηση των κυττάρων αυτών βρίσκεται κάτω
από τον έλεγχο των οιστρογόνων και της προγεστερόνης. Στην αναπαραγωγική ηλικία
τα φυσιολογικά επιθηλιακά κύτταρα της τελικής λοβιακής μονάδας του μαζικού αδένα
πολλαπλασιάζονται κατά την παραγωγική φάση του κύκλου υπό την επίδραση των οιστρογόνων.
Κατά την εκκριτική φάση η συνδυασμένη δράση οιστρογόνων - προγεστερόνης διπλασιάζει
έως τριπλασιάζει το ρυθμό πολλαπλασιασμού, ο οποίος φτάνει στο υψηλότερο σημείο
του στο τέλος αυτής της φάσης. Όταν δεν ακολουθήσει κύηση, τα επίπεδα της προγεστερόνης
μειώνονται απότομα και τα πλεονάζοντα επιθηλιακά κύτταρα εισέρχονται στη διαδικασία
της αποπτώσης (προγραμματισμένος κυτταρικός θάνατος), για να ακολουθήσει ένας
νέος κύκλος πολλαπλασιασμού κατά τον επόμενο εμμηνορρυσιακό κύκλο(23-28). Όπως
είναι γνωστό, όσο μεγαλύτερος είναι ο κυτταρικός πολλαπλασιασμός σε έναν ιστό,
τόσο μεγαλώνει και η πιθανότητα συσσώρευσης γενετικών ανωμαλιών που μπορεί να
οδηγήσουν σε κακοήθη εξαλλαγή και σε ανάπτυξη κακοήθους νεοπλασίας(29-35). Έτσι,
από τα δεδομένα της βασικής έρευνας φαίνεται ότι η ενεργοποίηση του κυτταρικού
πολλαπλασιασμού στο μαζικό αδένα από τη δράση των οιστρογόνων και ιδιαίτερα
από τη συνδυασμένη δράση οιστρογόνων - προγεστερόνης θεωρητικά θα πρέπει να
οδηγεί σε αύξηση του κινδύνου εμφάνισης καρκίνου του μαστού. Αυτό πράγματι επιβεβαιώνεται
μέχρι ενός βαθμού από τις υπάρχουσες κλινικές μελέτες.
Ανάμεσα στις κλινικές μελέτες για τον υπολογισμό του κινδύνου εμφάνισης καρκίνου
του μαστού σε γυναίκες χωρίς προηγούμενο ιστορικό της νόσου που λαμβάνουν ΘΟΥ
δύο κατέχουν πολύ σημαντική θέση: η Women's Health Initiative (WHI) και η Million
Women Study (MWS). H WHI ξεκίνησε ως πολυκεντρική μελέτη στις ΗΠΑ την περίοδο
1991-1992 και περιλάμβανε υγιείς γυναίκες μετά την εμμηνόπαυση, οι οποίες τυχαιοποιήθηκαν
σε τρεις ομάδες: εικονικό φάρμακο (placebo), μονοθεραπεία με οιστρογόνο και
συνδυασμένη ΘΟΥ (οιστρογόνο και προγεσταγόνο). Η κύρια παράμετρος έκβασης της
μελέτης ήταν η στεφανιαία νόσος(36). Η ΜWS είναι η μεγαλύτερη μέχρι σήμερα μελέτη
παρατήρησης, η οποία ξεκίνησε στη Μεγάλη Βρετανία το 1996 για να διερευνήσει
τη σχέση ανάμεσα στις διάφορες μορφές ΘΟΥ και στη νοσηρότητα και θνησιμότητα
από καρκίνο του μαστού(37). Στη μελέτη συμμετείχαν γυναίκες ηλικίας 50-64 ετών,
οι οποίες ρωτήθηκαν λεπτομερώς για το κοινωνικό, δημογραφικό, γενικό και γυναικολογικό
ιστορικό και τη λήψη φαρμάκων(11). Το πλεονέκτημα της WHI είναι το ότι πρόκειται
για τη μεγαλύτερη μέχρι σήμερα τυχαιοποιημένη μελέτη, ενώ το πλεονέκτημα της
MWS είναι ο μεγάλος αριθμός γυναικών που περιλήφθηκαν.
Ο κίνδυνος εμφάνισης καρκίνου του μαστού σε υγιείς γυναίκες που λαμβάνουν ΘΟΥ
με τη μορφή μονοθεραπείας με οιστρογόνα δεν φαίνεται να είναι ιδιαίτερα αυξημένος.
Μία παλαιότερη, ευρέως γνωστή μελέτη(38), στην οποία έγινε επανεκτίμηση 51 μέχρι
τότε εργασιών με συνολικά 52.705 γυναίκες με καρκίνο του μαστού και 108.411
χωρίς καρκίνο του μαστού, έδειξε ότι ο κίνδυνος για καρκίνο του μαστού μετά
από μονοθεραπεία με οιστρογόνα δεν είναι αυξημένος κατά τα πρώτα πέντε χρόνια
της ΘΟΥ, αυξάνεται ελαφρά μετά από πέντε χρόνια χρήσης (σχετικός κίνδυνος 1,35),
αλλά αυτή η αύξηση υποχωρεί μετά τη διακοπή της ΘΟΥ. Ωστόσο, μία νεότερη ανάλυση,
η οποία συμπεριλάμβανε τις περισσότερες από τις παραπάνω μελέτες, έθεσε σε αμφισβήτηση
αυτά τα ευρήματα(39). Θα πρέπει επίσης να σημειωθεί ότι η αξία των παραπάνω
διαπιστώσεων περιορίζεται από το γεγονός ότι οι εργασίες που επανεκτιμήθηκαν
ήταν κυρίως μελέτες παρατήρησης. Στο σκέλος της WHI με μονοθεραπεία με οιστρογόνο
σε σύγκριση με placebo φάνηκε απρόσμενα ότι ο σχετικός κίνδυνος καρκίνου του
μαστού μειώνεται κατά 23%, χωρίς ωστόσο αυτή η μείωση να είναι στατιστικά σημαντική.
Το γεγονός αυτό προκάλεσε πολλές συζητήσεις και από πολλούς θεωρήθηκε ως τυχαίο
εύρημα(40). Από την άλλη μεριά, στην MWS φάνηκε μία αύξηση του σχετικού κινδύνου
για καρκίνο του μαστού σε γυναίκες που λάμβαναν μονοθεραπεία με οιστρογόνα (σχετικός
κίνδυνος 1,3)(11).
Σε ό,τι αφορά τη ΘΟΥ με τη μορφή συνδυασμού οιστρογόνου - προγεσταγόνου, τα
μέχρι σήμερα δεδομένα συγκλίνουν στο ότι ο κίνδυνος καρκίνου του μαστού είναι
αυξημένος και μάλιστα περισσότερο από ό,τι σε μονοθεραπεία με οιστρογόνα. Το
σκέλος της WHI που αφορούσε τη σύγκριση συνδυασμένης ΘΟΥ έναντι placebo σε περισσότερες
από 10.000 γυναίκες διακόπηκε πρόωρα τον Ιούλιο του 2002, μετά από μέσο διάστημα
παρακολούθησης 5,2 ετών, επειδή η συχνότητα καρκίνου του μαστού στην ομάδα αυτή
ήταν απαράδεκτα υψηλή (σχετικός κίνδυνος 1,3)(13). Αντίθετα, το σκέλος της μελέτης
που αφορούσε τη σύγκριση της μονοθεραπείας με οιστρογόνα έναντι placebo και
περιλάμβανε 10.000 γυναίκες συνεχίστηκε και τελικά διακόπηκε πρόωρα το Φεβρουάριο
του 2004, για λόγους άσχετους με τον κίνδυνο καρκίνου του μαστού. Ο λόγος της
διακοπής ήταν η αυξημένη συχνότητα αγγειακών εγκεφαλικών επεισοδίων στην ομάδα
που λάμβανε τη μονοθεραπεία με οιστρογόνα, ενώ όπως αναφέρθηκε ο κίνδυνος καρκίνου
του μαστού ήταν απρόσμενα μειωμένος(9). Σε ό,τι αφορά τη MWS, τα κύρια ευρήματα
της μελέτης ήταν η αυξημένη συχνότητα καρκίνου του μαστού σε γυναίκες που συνεχίζουν
να λαμβάνουν οποιαδήποτε μορφή ΘΟΥ (σχετικός κίνδυνος 1,66), ιδιαίτερα σε αυτές
που λαμβάνουν συνδυασμό οιστρογόνου - προγεσταγόνου (σχετικός κίνδυνος 2,00).
Γυναίκες όμως που διέκοψαν τη ΘΟΥ δεν έχουν αυξημένο κίνδυνο (σχετικός κίνδυνος
1,01), ανεξάρτητα από τη μορφή και τη διάρκεια λήψης της θεραπείας και ανεξάρτητα
από το χρονικό διάστημα που πέρασε από τη διακοπή, με εξαίρεση τη διακοπή ένα
χρόνο πριν από τη διάγνωση καρκίνου του μαστού(11).
Ως προς τη χρήση της τιμπολόνης, μέχρι σήμερα υπάρχουν πολύ λιγότερα στοιχεία
από ό,τι για τη μονοθεραπεία με οιστρογόνα ή για τη συνδυασμένη ΘΟΥ. H τιμπολόνη
είναι ένα συνθετικό στεροειδές, που εμφανίζει ευεργετική δράση στα αγγειοκινητικά
συμπτώματα της εμμηνόπαυσης και στην οστεοπόρωση, ενώ δεν εμφανίζει αρνητική
δράση στο ενδομήτριο(41,42). In vivo μελέτες σε πειραματόζωα και in vitro μελέτες
σε κυτταροκαλλιέργειες από ανθρώπινα κύτταρα καρκίνου του μαστού έδειξαν ότι
η τιμπολόνη προάγει την απόπτωση και αναστέλλει τον κυτταρικό πολλαπλασιασμό(43,44),
ενώ κλινικές μελέτες σε γυναίκες έδειξαν ότι δεν επηρεάζει την πυκνότητα του
μαστού στη μαστογραφία(45,46). Η εταιρεία παραγωγής της ανέλυσε τα στοιχεία
από κλινικές μελέτες φάσης ΙΙΙ και IV, στις οποίες συμμετείχαν συνολικά 4.537
γυναίκες, και κατέληξε στη διαπίστωση ότι ο σχετικός κίνδυνος για την εμφάνιση
καρκίνου του μαστού ήταν μειωμένος, χωρίς όμως το αποτέλεσμα να είναι στατιστικά
σημαντικό(47). Αντίθετα, η MWS έδειξε μία μικρή αύξηση του κινδύνου σε γυναίκες
που συνεχίζουν τη θεραπεία (σχετικός κίνδυνος 1,45), ελάχιστα μεγαλύτερη από
ό,τι στη μονοθεραπεία με οιστρογόνα (σχετικός κίνδυνος 1,3) και σαφώς μικρότερη
από ό,τι στη συνδυασμένη ΘΟΥ (σχετικός κίνδυνος 2,0). Ωστόσο, αυτό το αποτέλεσμα
μπορεί να είναι τεχνητό, αφού το ποσοστό των γυναικών που έλαβαν τιμπολόνη στη
MWS ήταν μικρό (6%) και υπάρχει η πιθανότητα η τιμπολόνη να χορηγήθηκε επιλεκτικά
σε γυναίκες με αυξημένο κίνδυνο καρκίνου του μαστού, λόγω της μεγαλύτερης θεωρητικής
ασφάλειας της τιμπολόνης (48-50).Η MWS έγινε πρόσφατα αντικείμενο ισχυρής κριτικής
για μία σειρά από μεθοδολογικές ελλείψεις και περιορισμούς: ένας σημαντικός
αριθμός γυναικών είχε πάρει περισσοτέρες από μία μορφές ΘΟΥ, υπήρχε σύγχυση
ως προς τη σύνθεση των σκευασμάτων που λήφθηκαν και τα ερωτηματολόγια που δόθηκαν
στις λήπτριες, ο χρόνος της παρακολούθησης ήταν βραχύς, ο αριθμός των θανάτων
πολύ μικρός και τα αποτελέσματα ήταν μόνο οριακά στατιστικά σημαντικά(48,49).
Ένα άλλο σημείο κριτικής, το οποίο αφορά τόσο τη MWS όσο και άλλες νεότερες
μελέτες, σχετίζεται με το γεγονός ότι οι γυναίκες σε αυτές τις μελέτες υποβλήθηκαν
συστηματικά σε μαστογραφία. Το ερώτημα που τίθεται είναι το κατά πόσο τα αποτελέσματα
αυτών των εργασιών επηρεάστηκαν από το γεγονός ότι η ευαισθησία (sensitivity)
και η ειδικότητα (specificity) της μαστογραφίας μειώνονται μετά από εξωγενή
χορήγηση συνδυασμού οιστρογόνου - προγεσταγόνου(12,48,51,52).
Tα στοιχεία από τις παραπάνω κλινικές μελέτες συγκλίνουν στο ότι η ΘΟΥ (κυρίως
η συνδυασμένη) προκαλεί μία μικρή αύξηση του κινδύνου εμφάνισης καρκίνου του
μαστού. Ωστόσο, το βασικό ερώτημα που δεν έχει ακόμα απαντηθεί είναι το κατά
πόσο η ΘΟΥ προκαλεί νέες περιπτώσεις καρκίνου ή απλώς επιταχύνει την ανάπτυξη
όγκων που προϋπάρχουν(48,49). Υπέρ της πιθανότητας η ΘΟΥ να προάγει την αύξηση
ήδη σχηματισμένων όγκων συνηγορούν το γεγονός ότι ο κίνδυνος καρκίνου του μαστού
παύει να είναι αυξημένος μετά από διακοπή της θεραπείας και η σχετικά γρήγορη
διάγνωση καρκίνου του μαστού μετά την έναρξη της ΘΟΥ 48.
Ένα άλλο ερώτημα που παραμένει χωρίς απάντηση είναι το εάν η πρόγνωση του καρκίνου
του μαστού που εμφανίζεται μετά από ΘΟΥ επηρεάζεται από την ίδια τη ΘΟΥ. Στη
MWS διαπιστώθηκε μικρή αύξηση της θνησιμότητας σε γυναίκες που συνέχιζαν να
λαμβάνουν ΘΟΥ όταν τέθηκε η διάγνωση καρκίνου του μαστού, αλλά αυτή η αύξηση
δεν ήταν στατιστικά σημαντική. Αντίθετα, μία σειρά από παλαιότερες μελέτες έδειξε
ότι η συνολική επιβίωση μετά από τη διάγνωση καρκίνου του μαστού δεν επηρεάζεται
από το εάν οι γυναίκες έχουν λάβει ΘΟΥ ή όχι και μάλιστα ορισμένες εργασίες
έδειξαν καλύτερη επιβίωση μετά από ΘΟΥ(48). Ανάλυση των στοιχείων από δέκα διαφορετικές
εργασίες, μεταξύ αυτών και της μελέτη της American Cancer Society με τη συμμετοχή
περίπου 500.000 γυναικών, έδειξε ότι τα καρκινώματα που διαγνώστηκαν σε γυναίκες
που λάμβαναν ΘΟΥ είχαν ιστολογικούς τύπους με ευνοϊκή πρόγνωση, ενώ τόσο η συχνότητα
των μεταστάσεων, όσο και η θνησιμότητα ήταν μικρότερες(53). Πρέπει πάντως και
πάλι να σημειωθεί ότι και οι δέκα εργασίες ήταν μελέτες παρατήρησης, γεγονός
που περιορίζει σημαντικά την αξία των παραπάνω ευρημάτων. Επιπρόσθετα, το σκέλος
της WHI με συνδυασμένη θεραπεία οιστρογόνου - προγεσταγόνου δεν επιβεβαίωσε
αυτά τα ευρήματα.

ΘΟΥ και κίνδυνος
καρκίνου του μαστού σε γυναίκες με ιστορικό της νόσου
Η θεραπευτική αντιμετώπιση
του καρκίνου του μαστού με κυτταροτοξική χημειοθεραπεία και ορμονική θεραπεία
με "αντι-οιστρογόνα" και GnRH-ανάλογα μπορεί να προκαλέσει ιατρογενή
ανεπάρκεια των ωοθηκών και εμφάνιση πρόωρης εμμηνόπαυσης ή επιδείνωση προϋπαρχόντων
συμπτωμάτων εμμηνόπαυσης. Η αντιμετώπιση των συμπτωμάτων αυτών αποτελεί σημαντικό
κλινικό πρόβλημα, αφού το ιστορικό καρκίνου του μαστού αποτελεί γενικά αντένδειξη
για όλες τις μορφές ΘΟΥ, συμπεριλαμβανομένης και της τιμπολόνης. Το μέγεθος
του προβλήματος γίνεται καλύτερα αντιληπτό αν σκεφτεί κανείς ότι το 70% των
καρκινωμάτων του μαστού είναι θετικά για οιστρογονικούς και/ή προγεστερονικούς
υποδοχείς και ότι στις περιπτώσεις αυτές η ορμονική θεραπεία που ενδείκνυται
έχει δράση εκ διαμέτρου αντίθετη από αυτή της ΘΟΥ. Ωστόσο, στην κλινική πράξη
ορισμένα φάρμακα είναι δυνατόν να χορηγηθούν κατ' εξαίρεση, παρά την ύπαρξη
αντένδειξης, εφόσον υπάρχει σαφής ένδειξη, προηγηθεί πλήρης ενημέρωση της ασθενούς
και ληφθεί η έγγραφη συγκατάθεσή της.
Ο υπολογισμός του κινδύνου υποτροπής σε γυναίκες με ιστορικό καρκίνου του μαστού
που λαμβάνουν ΘΟΥ στηρίζεται, όπως και στην περίπτωση των γυναικών χωρίς προηγούμενο
ιστορικό της νόσου, κυρίως σε στοιχεία από μελέτες παρατήρησης, μελέτες της
βασικής έρευνας και θεωρητικές προσεγγίσεις και λιγότερο από προοπτικές τυχαιοποιημένες
μελέτες. Ο αριθμός των ασθενών στις μέχρι σήμερα εργασίες είναι πάντως σχετικά
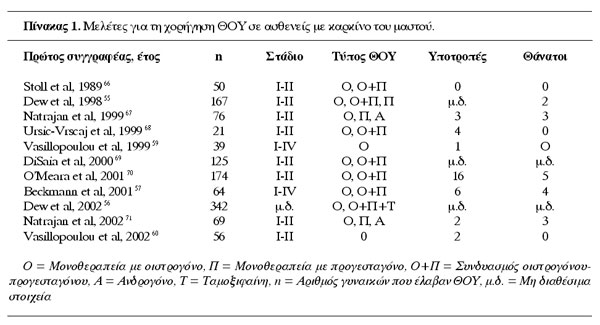
μικρός, ώστε να μπορούν να εξαχθούν οριστικά συμπεράσματα. Στον πίνακα 1 γίνεται
μία συνοπτική παρουσίαση κλινικών μελετών για τη χορήγηση ΘΟΥ σε ασθενείς με
ιστορικό καρκίνου του μαστού.
Πολύ γνωστή είναι μία μελέτη από την Αυστραλία, η οποία ξεκίνησε το 1992 και
συνεχίζεται μέχρι σήμερα και στην οποία γίνεται σύγκριση μιας ομάδας γυναικών
με ιστορικό καρκίνου του μαστού που λαμβάνει συνδυασμένη ΘΟΥ με μία ομάδα ελέγχου.
Σε καμία από τις διαδοχικές δημοσιεύσεις από αυτή τη μελέτη (με αριθμό ασθενών
300 και 1000 αντίστοιχα) δεν ανακοινώθηκε αύξηση του κινδύνου υποτροπής(54-56).
Σε μία αναδρομική μελέτη από τη Γερμανία, η χορήγηση τόσο μονοθεραπείας με οιστρογόνο
όσο και συνδυασμένης ΘΟΥ σε ασθενείς με καρκίνο του μαστού, δε φάνηκε να επηρεάζει
τη νοσηρότητα και τη θνησιμότητα(57). Ωστόσο, όπως και οι ίδιοι οι ερευνητές
τονίζουν, τα αποτελέσματα αυτά θα πρέπει να τα δούμε με επιφυλακτικότητα και
η ΘΟΥ θα πρέπει πάντα να χορηγείται σε ασθενείς με καρκίνο του μαστού εξατομικευμένα.
Οι Col και συν.(58) υπολόγισαν το σχετικό κίνδυνο τοπικής υποτροπής καρκίνου
του μαστού μετά τη χορήγηση ΘΟΥ με βάση τα αποτελέσματα 11 συνολικά μελετών
και δε διαπίστωσαν αύξηση του κινδύνου υποτροπής. Ωστόσο, όπως και οι ίδιοι
οι συγγραφείς αναφέρουν, μόνο στις τέσσερεις από αυτές τις μελέτες υπήρχε ομάδα
ελέγχου. Σε καμία πάντως από τις μέχρι σήμερα μελέτες δεν αποδείχτηκε αύξηση
της συχνότητας τοπικής υποτροπής μετά από ΘΟΥ.
Πολύ σημαντικά είναι τα αποτελέσματα από δύο προοπτικές μελέτες που πραγματοποίησε
μία ομάδα ερευνητών στις ΗΠΑ(59,60). Ιδιαίτερη αναφορά αξίζει να γίνει στη δεύτερη
από αυτές, η οποία είναι ουσιαστικά μετεξέλιξη της πρώτης και που αποτελεί τη
μοναδική μέχρι σήμερα προοπτική, τυχαιοποιημένη μελέτη με ομάδα ελέγχου στην
οποία χορηγήθηκε ΘΟΥ σε ασθενείς με καρκίνο του μαστού(60). Η μελέτη αφορά μόνο
μία μικρή ομάδα ασθενών με καρκίνο του μαστού και η χορήγηση ΘΟΥ έγινε μόνο
για βραχύ χρονικό διάστημα. Αυτά τα χαρακτηριστικά θα μπορούσαν εκ πρώτης όψεως
να θεωρηθούν ως μειονεκτήματα, αλλά αντίθετα η αυστηρή επιλογή των ασθενών και
η βραχυχρόνια χορήγηση ΘΟΥ αποτελούν τα μεγάλα πλεονεκτήματα της μελέτης. Οι
ασθενείς που εξετάστηκαν ήταν μόνο ασθενείς με καρκίνο του μαστού σταδίου Ι
ή ΙΙ και είτε αρνητικούς ορμονικούς υποδοχείς και διάστημα ελεύθερο νόσου τουλάχιστον
δύο ετών είτε με άγνωστη κατάσταση ως προς τους ορμονικούς υποδοχείς και διάστημα
ελεύθερο νόσου τουλάχιστον δέκα ετών. Ασθενείς με όγκους με θετικούς υποδοχείς
αποκλείσθηκαν από τη μελέτη. Όλες οι ασθενείς έλαβαν ΘΟΥ μόνο με οιστρογόνο,
χωρίς την προσθήκη προγεσταγόνου και παρακολουθήθηκαν κατά μέσο όρο για 71 μήνες.
Στην ομάδα που έλαβε ΘΟΥ (n=56) υπήρξαν τοπικές υποτροπές σε ποσοστό 3,6%, έναντι
13,5% στην ομάδα ελέγχου (n=243), ενώ δεν υπήρχαν σημαντικές διαφορές ως προς
τη θνησιμότητα. Οι δύο ομάδες δεν διέφεραν σε χαρακτηριστικά όπως το μέγεθος
του όγκου, ο αριθμός των προσβεβλημένων λεμφαδένων, η κατάσταση των ορμονικών
υποδοχέων και το διάστημα ελεύθερο νόσου. Έτσι, το συμπέρασμα είναι ότι ΘΟΥ
ως μονοθεραπεία με οιστρογόνα θα μπορούσε πιθανότατα να χορηγηθεί βραχυπρόθεσμα,
σε επιλεγμένες ασθενείς με καρκίνο του μαστού, εφόσον υπάρχουν οι απαραίτητες
ενδείξεις(60). Ωστόσο, μέχρι να επιβεβαιωθούν τα αποτελέσματα αυτής της μελέτης
σε μεγαλύτερο αριθμό ασθενών και με μεγαλύτερο χρόνο παρακολούθησης, η χορήγηση
ΘΟΥ αντενδείκνυται σε ασθενείς με καρκίνο του μαστού έξω από το πλαίσιο κλινικών
μελετών.
Δύο άλλες προοπτικές, τυχαιοποιημένες αλλά όχι τυφλές μελέτες ξεκίνησαν στη
Σκανδιναβία με σκοπό να εκτιμήσουν το κατά πόσο είναι ασφαλής η χορήγηση ΘΟΥ
σε ασθενείς με ιστορικό καρκίνου του μαστού. Ωστόσο και οι δύο διακόπηκαν πρόωρα.
Η μελέτη HABITS (Hormonal replacement therapy After Breast cancer - Is iT Safe?)
ξεκίνησε το 1997, αλλά διακόπηκε πρόωρα το Φεβρουάριο του 2004, μετά από μέσο
διάστημα παρακολούθησης 2,1 ετών. Ο λόγος της διακοπής ήταν το ότι διαπιστώθηκε
σημαντικά αυξημένος κίνδυνος τοπικής υποτροπής στην ομάδα που λάμβανε ΘΟΥ (14,9%
έναντι 4,1%, n=174 και 171 αντίστοιχα), αν και δεν παρατηρήθηκε ανάλογη αύξηση
της θνησιμότητας. Στην άλλη μελέτη δεν διαπιστώθηκε αυξημένος κίνδυνος υποτροπής,
αλλά διακόπηκε εξαιτίας προβλημάτων στη στρατολόγηση ασθενών για συμμετοχή στη
μελέτη. Ικανοποιητικά στοιχεία για τη χορήγηση τιμπολόνης σε γυναίκες με ιστορικό
καρκίνου του μαστού δεν υπάρχουν ακόμα. Μία προοπτική διπλή - τυφλή τυχαιοποιημένη
μελέτη με τη χορήγηση τιμπολόνης σε γυναίκες με καρκίνο του μαστού και συμπτώματα
εμμηνόπαυσης ξεκίνησε στη Γερμανία τον Αύγουστο του 2002 και τα αποτελέσματά
της θα γίνουν γνωστά πολύ αργότερα.
Συμπεράσματα
και εναλλακτικές λύσεις
Από τα παραπάνω γίνεται φανερό ότι η ενημέρωση των γυναικών ως προς τη σχέση
της ΘΟΥ με τον καρκίνο του μαστού, ανεξάρτητα από το εάν υπάρχει ιστορικό της
νόσου ή όχι, δεν μπορεί να βασισθεί αποκλειστικά στις μέχρι σήμερα κλινικές
εργασίες, καθώς δεν υπάρχουν αρκετά στοιχεία από προοπτικές, τυχαιοποιημένες
μελέτες.
Έτσι, η ενημέρωση θα πρέπει να στηριχθεί και στα αποτελέσματα της βασικής έρευνας
και στη θεωρητική προσέγγιση του θέματος, που υπαγορεύουν ότι τα οιστρογόνα
και ακόμη περισσότερο ο συνδυασμός τους με προγεσταγόνα προάγουν τον πολλαπλασιασμό
των επιθηλιακών κυττάρων του μαστού. Από τη μια μεριά, ο αυξημένος πολλαπλασιασμός
των φυσιολογικών επιθηλιακών κυττάρων του μαστού δημιουργεί τις προϋποθέσεις
κακοήθους εξαλλαγής. Από την άλλη, τα οιστρογόνα και τα προγεσταγόνα μπορεί
να προάγουν τον πολλαπλασιασμό ήδη εξαλλαγμένων κυττάρων, τόσο στις περιπτώσεις
που υπάρχει ιστορικό καρκίνου του μαστού, όσο και προτού η νόσος καταστεί κλινικά
εμφανής.
Σε κάθε περίπτωση, η ΘΟΥ είναι αποδεδειγμένα αποτελεσματική στην πρωτογενή πρόληψη
των οστεοπορωτικών καταγμάτων μετά την εμμηνόπαυση(8), ενώ υπάρχουν στοιχεία
από τυχαιοποιημένες μελέτες και μελέτες παρατήρησης που δείχνουν ότι προφυλάσσει
και από τον καρκίνο του ορθού(1,38,61). Αντίθετα, υπάρχουν σημαντικά δεδομένα
που δείχνουν ότι η ΘΟΥ μπορεί να οδηγήσει σε απειλητικές για τη ζωή καταστάσεις,
όπως το αγγειακό εγκεφαλικό επεισόδιο, η φλεβική θρομβοεμβολική νόσος και ο
καρκίνος του μαστού(9,11-13). Έτσι, οι νεότερες κατευθυντήριες γραμμές (guidelines),
τόσο σε ευρωπαϊκές χώρες όσο και στις ΗΠΑ, συγκλίνουν στη σύσταση η ΘΟΥ να χορηγείται
εξατομικευμένα, στη μικρότερη δυνατή δόση και για τη μικρότερη δυνατή χρονική
περίοδο, με τακτικό επανέλεγχο των γυναικών(48,49).
Κατά την ενημέρωση της γυναίκας δεν θα πρέπει να παραλείπεται και η πληροφόρηση
ως προς τις διάφορες εναλλακτικές θεραπευτικές λύσεις. Ειδικά στις περιπτώσεις
που υπάρχει ιστορικό καρκίνου του μαστού, η ΘΟΥ δεν θα πρέπει να χορηγείται
για πρόληψη, παρά μόνο για την αντιμετώπιση των συμπτωμάτων της εμμηνόπαυσης
και αυτό όταν όλες οι εναλλακτικές λύσεις έχουν δοκιμασθεί και αποτύχει.
Για τον έλεγχο των αγγειοκινητικών συμπτωμάτων μπορούν να χορηγηθούν δοκιμαστικά
μεθυλντόπα και βιταμίνη Ε, που όμως έχουν μικρή μόνο αποτελεσματικότητα. Η κλονιδίνη
σε ημερήσια δόση 0.1mg είναι σχετικά αποτελεσματική για τον έλεγχο των εξάψεων,
ιδιαίτερα όταν αυτές προέρχονται από τη χορήγηση ταμοξιφαίνης(62).
Πιο αποτελεσματική θεραπεία είναι η χορήγηση ψυχοφαρμάκων, όπως οι νεότεροι
αναστολείς επαναπρόσληψης σεροτονίνης (serotonine re-uptake inhibitors). Σε
αυτή την κατηγορία ανήκουν η φλουοξετίνη και η βενφλαξίνη, που είναι πολύ συχνά
αποτελεσματικές κατά των εξάψεων, αλλά συνδέονται με μία σειρά ανεπιθύμητων
ενεργειών, όπως ναυτία, δυσκοιλιότητα και ξηρότητα του στόματος(63). Βέβαια
κανείς δε θα πρέπει να ξεχνά και τα γενικά μέτρα για την αντιμετώπιση των αγγειοκινητικών
συμπτωμάτων, πολλά από τα οποία συμβάλλουν και στη διατήρηση της γενικότερης
υγείας. Τέτοια μέτρα είναι η μείωση της καφεΐνης και του οινοπνεύματος, η διακοπή
του καπνίσματος, η ισορροπημένη διατροφή, η ελάττωση του σωματικού βάρους σε
γυναίκες με παχυσαρκία, η σωματική άσκηση, η κατάλληλη ενδυμασία και η αποφυγή
έκθεσης σε ακραίες θερμοκρασίες.
Τα πολύ συχνά εμφανιζόμενα ενοχλήματα από την ουρογεννητική ατροφία μπορούν
να αντιμετωπισθούν με τοπική ορμονική θεραπεία, με ιδιαίτερη προσοχή ώστε να
αποφεύγεται κατάχρηση και υπέρβαση της δοσολογίας.
Η συστηματική μονοθεραπεία με προγεσταγόνα, που χορηγείται κυρίως στις ΗΠΑ αντί
των άλλων μορφών ΘΟΥ, είναι πολύ συχνά αναποτελεσματική και οι κίνδυνοι που
περικλείει άγνωστοι.
Για την πρόληψη της οστεοπόρωσης μπορεί να χορηγηθούν σκευάσματα όπως το ασβέστιο,
η βιταμίνη D, η ραλοξιφαίνη και τα διφωσφονικά.
Η ραλοξιφαίνη ανήκει στους εκλεκτικούς τροποποιητές των οιστρογονικών υποδοχέων
(selective estrogen-receptor modulators - SERMs) και είναι εγκεκριμένη για την
πρόληψη της οστεοπόρωσης, καθώς οδηγεί σε ελάττωση της συχνότητας των σπονδυλικών
καταγμάτων κατά 30-50%, όχι όμως και σε ελάττωση της συχνότητας των εξωσπονδυλικών
καταγμάτων(64).
Η ραλοξιφαίνη έχει το επιπλέον πλεονέκτημα ότι μπορεί να προφυλάσσει από τον
καρκίνο του μαστού(65), ωστόσο δεν έχει καμία επίδραση στα αγγειοκινητικά συμπτώματα
της εμμηνόπαυσης. Τέλος, τα διφωσφονικά εμφανίζουν ιδιαίτερη αποτελεσματικότητα
στην θεραπεία της οστεοπόρωσης, τόσο σε ασθενείς χωρίς ιστορικό καρκίνου του
μαστού όσο και σε ασθενείς με ιστορικό της νόσου.
Summary
Zafrakas Μ, Goulis DG, Papadimas I, Bontis I.
Hormone replacement therapy and breast cancer.
Hellen Obstet Gynecol 17(3):273-281, 2005
Hormone replacement therapy (HRT) after menopause is undoubtedly effective in controlling vasomotor symptoms and urogenital atrophy, as well as in preventing osteoporotic fractures. However, HRT does not protect as previously thought against cardiovascular disease and it seems that at least some forms of it increase breast cancer risk. Only a few of existing HRT data in women without previous history of breast cancer or breast cancer survivals are derived from prospective, randomized trials. Thus many questions remain unanswered and many controversies exist. Data from basic science and clinical trials suggest that combined HRT and to a lesser extend estrogen monotherapy lead to an increased risk of breast cancer in women with no previous history of the disease. Although only few data exist concerning tibolone, this synthetic compound should not be considered safe a priori. The questions whether HRT causes new cases of breast cancer or simply induces the growth of pre-existing tumors and whether HRT has an effect on breast cancer prognosis still remains unanswered. HRT in breast cancer patients is often a difficult problem, particularly when patients are under additional hormonal therapy causing or aggravating menopausal symptoms. Irrespective of previous history, HRT should be given on an individual basis, after providing the patient with thorough information, including information on alternative therapeutic approaches.
Keywords: hormone replacement therapy, breast cancer, combined estrogen-progestagen therapy, estrogen monotherapy, tibolone.
Βιβλιογραφία
1. Beral V, Banks E, Reeves
G, Appleby P. Use of HRT and the subsequent risk of cancer. J Epidemiol Biostat
1999; 4:191-210.
2. Smith DC, Prentice R, Thompson DJ, Herrmann WL. Association of exogenous
estrogen and endometrial carcinoma. N Engl J Med 1975; 293:1164-1167.
3. Ziel HK, Finkle WD. Increased risk of endometrial carcinoma among users of
conjugated estrogens. N Engl J Med 1975; 293:1167-1170.
4. Grady D, Gebretsadik T, Kerlikowske K, Ernster V, Petitti D. Hormone replacement
therapy and endometrial cancer risk: a meta-analysis. Obstet Gynecol 1995; 85:304-313.
5. Pike MC, Peters RK, Cozen W, Probst-Hensch NM, Felix JC, Wan PC, et al. Estrogen-progestin
replacement therapy and endometrial cancer. J Natl Cancer Inst 1997; 89:1110-1116.
6. Weiderpass E, Adami HO, Baron JA, Magnusson C, Bergstrom R, Lindgren A, et
al. Risk of endometrial cancer following estrogen replacement with and without
progestins. J Natl Cancer Inst 1999; 91:1131-1137.
7. Million Women Study Collaborators. Patterns of use of hormone replacement
therapy in one million women in Britain 1996-2000. BJOG 2002; 109:1319-1330.
8. Banks E, Beral V, Reeves G, Balkwill A, Barnes I. Million Women Study Collaborators.
Fracture incidence in relation to the pattern of use of hormone therapy in postmenopausal
women. JAMA 2004; 291:2212-2220.
9. Anderson GL, Limacher M, Assaf AR, Bassford T, Beresford SA, Black H, et
al. Women's Health Initiative Steering Committee. Effects of conjugated equine
estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative
randomized controlled trial. JAMA 2004; 291:1701-1712.
10. Hulley S, Grady D, Bush T, Furberg C, Herrington D, Riggs B, et al. Randomized
trial of estrogen plus progestin for secondary prevention of coronary heart
disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study
(HERS) Research Group. JAMA 1998; 280:605-613.
11. Beral V. Million Women Study Collaborators. Breast cancer and hormone-replacement
therapy in the Million Women Study. Lancet 2003; 362:419-427.
12. Chlebowski RT, Hendrix SL, Langer RD, Stefanick ML, Gass M, Lane D, et al.
WHI Investigators. Influence of estrogen plus progestin on breast cancer and
mammography in healthy postmenopausal women: the Women's Health Initiative Randomized
Trial. JAMA 2003; 289:3243-3245.
13. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick
ML, et al. Writing Group for the Women's Health Initiative Investigators. Risks
and benefits of estrogen plus progestin in healthy postmenopausal women: principal
results From the Women's Health Initiative randomized controlled trial. JAMA
2002; 288:321-333.
14. Schairer C, Lubin J, Troisi R, Sturgeon S, Brinton L, Hoover R. Menopausal
estrogen and estrogen-progestin replacement therapy and breast cancer risk.
JAMA 2000; 283:485-491.
15. Li CI, Malone KE, Porter PL, Weiss NS, Tang MT, Cushing-Haugen KL, et al.
Relationship between long durations and different regimens of hormone therapy
and risk of breast cancer. JAMA 2003; 289:3254-3263.
16. Feinlieb M. Beast cancer and artificial menopause: A cohort study. J Natl
Cancer Inst 1968; 41:315-329.
17. MacMahon B, Cole P, Lin TM, Lowe CR, Mirra AP, Ravnihar B, et al. Age at
first birth and breast cancer risk. Bull WHO 1970; 43:209-211.
18. Trichopoulos D, McMahon B, Cole P. Menopause and breast cancer risk. J Natl
Cancer Inst 1972; 48:605-613.
19. Brinton LA, Schairer C, Hoover RN, Fraumeni JF Jr. Menstrual factors and
risk of breast cancer. Cancer Investigation 1988; 6:245-254.
20. Hsieh C-C, Trichopoulos D, Katsouyani K, Yuasa S. Age at menarche, age at
menopause, height and obesity as risk factors for breast cancer: Associations
and interactions in an international case-control study. Int J Cancer 1990;
46:796-780.
21. Ewertz M, Duffy S, Adami H-O, Kvale G, Lund E, Meirik O, et al. Age at first
birth, parity and risk of cancer: A meta-analysis of 8 studies from the Nordic
countries. Int J Cancer 1990; 46:597-603.
22. Kelsey JL, Gammon MD, John EM. Reproductive factors and breast cancer. Epidemiol
Rev 1993; 15:36-47.
23. Meyer JC. Cell proliferation in normal human breast ducts, fibroadenomas
and other duct hyperplasias, measured by nuclear labeling with tritiated thymidine.
Hum Pathol 1977; 8:67-81.
24. Anderson TJ, Ferguson DJP, Raab GM. Cell turnover in the "resting"
human breast: Influence of parity, contraceptive pill, age and laterality. Br
J Cancer 1982; 46:376-382.
25. Pike MC, Krailo M, Henderson B, Casagrande JT, Hoel DG. "Hormonal"
risk factors, "breast tissue age" and the age-incidence of breast
cancer. Nature 1983; 303:767-770.
26. Longacre TA, Bartow SA. A correlative morphologic study of human breast
and endometrium in the mestrual cycle. Am J Surg Pathol 1986; 10:382-393.
27. Batersby A, Anderson TJ. Proliferative and secretory activity in the lactating
human breast. Virchows Arch A Pathol Anat 1988; 413:189-196.
28. Williams G, Anderson E, Howell A, Watson R, Coyne J, Roberts SA, et al.
Oral contraceptive (OCP) use increases proliferation and decreases oestrogen
receptor content of epithelial cells in the normal human breast. Int J Cancer
1991; 48:206-210.
29. Knudson AG. Mutation and cancer: Statistical study of retinoblastoma. Proc
Nat Acad Sci USA 1971; 68:820-823.
30. Nowell PC. The clonal evolution of tumor cell populations. Science 1976;
194:23-27.
31. Knudson AG. Hereditary cancer, oncogenes, and antioncogenes. Cancer Res
1985; 45:1437-1443.
32. Vogelstein B, Fearon ER, Hamilton SR, Kern SE, Preisinger AC, Leppert M,
et al. Genetic alterations during colorectal tumor development. N Engl J Med
1988; 319:525-532.
33. Weinberg RA. Oncogenes and antioncogenes, and the molecular basis of multistep
carcinogenesis. Cancer Res 1989; 49:3713-3721.
34. Hartwell LH, Kastan MB. Cell cycle control and cancer. Science 1994; 266:1821-1828.
35. Rabbits TH. Chromosomal tranlocations in human cancer. Nature 1994; 372:143-149.
36. The Women's Health Initiative Study Group. Design of the Women's Health
Initiative clinical trial and observational study. Control Clin Trials 1998;
19: 61-109.
37. The Million Women Study Collaborative Group. The Million Women Study: design
and characteristics of the study population. Breast Cancer Res 1999; 1:73-80.
38. Collaborative Group on Hormonal Factors in Breast Cancer, Beral V. Breast
cancer and hormone replacement therapy: collaborative reanalysis of data from
51 epidemiological studies of 52,705 women with breast cancer and 108,411 women
without breast cancer 1997; 350:1047-1059.
39. Garbe E, Levesque L, Suissa S. Variability of breast cancer risk in observational
studies of hormone replacement therapy: a meta-regression analysis. Maturitas
2004; 47:175-183.
40. Hulley SB, Grady D. The WHI estrogen-alone trial - do things look any better?
JAMA 2004; 291:1769-1771.
41. Hammar M, Christau S, Nathorst-Boos J, Rud T, Garre K. A double-blind, randomised
trial comparing the effects of tibolone and continuous combined hormone replacement
therapy in postmenopausal women with menopausal symptoms. Br J Obstet Gynaecol
1998; 105: 904-911.
42. Gallagher JC, Baylink DJ, Freeman R, McClung M. Prevention of bone loss
with tibolone in postmenopausal women: results of two randomised double-blind,
placebo controlled, dose finding studies. J Clin Endocrinol Metab 2001; 86:4717-4726.
43. Van de Ven J, Donker GH, Sprsrong Μ, Βlankenstein ΜΑ, Τhijssen JΗΗ. Effect
of tibolone (Οrg ΟD14) and its metabolites on aromatase and strone sulfatase
activity in human breast adipose stromal cells and in MCF-17 and T47D breast
cancer cells. J Steroid Biochem Molec Biol 2002; 81:237-247.
44. Gompel A, Siromachkova M, Lombet A, Kloosterboer HJ, Rostene W. Tibolone
actions on normal and breast cancer cells. Eur J Cancer 2000; 36:76-77.
45. Valdivia I, Ortega D. Mammographic density in postmenopausal women treated
with tibolone, estriol or conventional hormone replacement therapy. Clin Drug
Invest 2000; 20:101-107.
46. Colacurci N, Fornaro F, De Franciscis P, Palermo M, del Vecchio W. Effects
of different types of hormone replacement therapy on mammographic density. Maturitas
2001; 40:159-164.
47. Helmond FA, Kloosterboer HJ. Safety and tolerability profile of Livial.
In: Genazzani AR (ed). Hormone Replacement Therapy and Cancer. The Current Status
of Research and Practice. Boca Raton: The Parthenon Publishing Group 2002.
48. Speroff L. The Million Woman study and breast cancer. Maturitas 2003; 46:1-6.
49. Grambacciani M, Genazzani AR. The study with a million women (and hopefully
fewer mistakes). Gynecol Endocrinol 2003; 17:359-362.
50. Olsson H. What can we learn from the Million Women study. Maturitas 2003;
46:87-89.
51. Laya MB, Gallagher JC, Schreiman JS, Larson EB, Watson P, Weinstein L. Effect
of postmenopausal hormonal replacement therapy on mammographic density and parenchymal
pattern. Radiology 1995; 196:433-437.
52. Kavanagh AM, Mitchell H, Giles GG. Hormone replacement therapy and accuracy
of mammographic screening. Lancet 2000; 355:270-274.
53. Nanda K, Bastian LA, Schulz K. Hormone replacement therapy and the risk
of death from breast cancer: a systematic review. Am J Obstet Gynecol. 2002;
186:325-334.
54. Eden J. Should women who have had breast cancer take hormone replacement
therapy? Maturitas 1995; 22:69-70.
55. Dew J, Eden J, Beller E, Magarey C, Schwartz P, Crea P, et al. A cohort
study of hormone replacement therapy given to women previously treated for breast
cancer. Climacteric 1998; 1:137-142.
56. Dew JE, Wren BG, Eden JA. Tamoxifen, hormone receptors and hormone replacement
therapy in women previously treated for breast cancer: a cohort study. Climacteric
2002; 5:151-155.
57. Beckmann MW, Jap D, Djahansouzi S, Nestle-Kramling C, Kuschel B, Dall P,
et al. Hormone replacement therapy after treatment of breast cancer: effects
on postmenopausal symptoms, bone mineral density and recurrence rates. Oncology
2001; 60:199-206.
58. Col NF, Hirota LK, Orr RK, Erban JK, Wong JB, Lau J. Hormone replacement
therapy after breast cancer: a systematic review and quantitative assessment
of risk. J Clin Oncol 2001; 19:2357-2363.
59. Vassilopoulou-Sellin R, Asmar L, Hortobagyi GN, Klein MJ, McNeese M, Singletary
SE, et al. Estrogen replacement therapy after localized breast cancer: clinical
outcome of 319 women followed prospectively. J Clin Oncol 1999; 17:1482-1487.
60. Vassilopoulou-Sellin R, Cohen DS, Hortobagyi GN, Klein MJ, McNeese M, Singletary
SE, et al. Estrogen replacement therapy for menopausal women with a history
of breast carcinoma: results of a 5-year, prospective study. Cancer 2002; 95:1817-1826.
61. Beral V, Banks E, Reeves G. Evidence from randomised trials on the long-term
effects of hormone replacement therapy. Lancet 2002; 360:942-924.
62. Pandya KJ, Raubertas RF, Flynn PJ, Hynes HE, Rosenbluth RJ, Kirshner JJ,
et al. Oral clonidine in postmenopausal patients with breast cancer experiencing
tamoxifen-induced hot flashes: a University of Rochester Cancer Center Community
Clinical Oncology Program study. Ann Intern Med 2000; 132:788-793.
63. Loprinzi CL, Kugler JW, Sloan JA, Mailliard JA, La Vasseur BI, Barton DL,
et al. Venlafaxine in management of hot flashes in survivors of breast cancer:
a randomised controlled trial. Lancet 2000; 356:2059-2063.
64. Ettinger B, Black DM, Mitlak BH, Knickerbocker RK, Nickelsen T, Genant HK,
et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis
treated with raloxifene: Results from a 3-year randomised clinical trial. Multiple
Outcomes on Raloxifene Evaluation (MORE) Investigators. JAMA 1999; 282:637-645.
65. Cummings SR, Eckert S, Krueger KA, Grady D, Powels TJ, Cauley JA, et al.
The effect of raloxifene on risk of breast cancer in postmenopausal women: Results
from the MORE randomized trial. Multiple outcome on raloxifene evaluation. JAMA
1999; 281:2189-2197.
66. Stoll BA. Hormone replacement therapy in women treated for breast cancer.
Eur J Cancer Clin Oncol 1989; 25:1909-1913.
67. Natrajan PK, Soumakis K, Gambrell RD Jr. Estrogen replacement therapy in
women with previous breast cancer. Am J Obstet Gynecol 1999; 181:288-295.
68. Ursic-Vrscaj M, Bebar S. A case-control study of hormone replacement therapy
after primary surgical breast cancer treatment. Eur J Surg Oncol 1999; 25:146-151.
69. DiSaia PJ, Brewster WR, Ziogas A, Anton-Culver H. Breast cancer survival
and hormone replacement therapy: a cohort analysis. Am J Clin Oncol 2000; 23:541-545.
70. O'Meara ES, Rossing MA, Daling JR, Elmore JG, Barlow WE, Weiss NS. Hormone
replacement therapy after a diagnosis of breast cancer in relation to recurrence
and mortality. J Natl Cancer Inst 2001; 93:754-762.
71. Natrajan PK, Gambrell RD Jr. Estrogen replacement therapy in patients with
early breast cancer. Am J Obstet Gynecol 2002; 187:289-295.