Παθοφυσιολογία του πρόωρου
τοκετού
Α.
Μαμόπουλος
Αλληλογραφία:
Γ' Μαιευτική - Γυναικολογική κλινική
ΑΠΘ, Ιπποκράτειο Νοσοκομείο
Θεσσαλονίκης
Διεύθυνση αλληλογραφίας:
Απόστολος Μ. Μαμόπουλος
Τσιμισκή 133
546 21 Θεσσαλονίκη
Τηλ: +301/2310 275601
Fax: +301/2310 992950
e-mail: amamop@spark.net.gr
Kατατέθηκε: 12/05/03
Eγκρίθηκε: 20/10/03
Περίληψη
Ο πρόωρος τοκετός εξακολουθεί να είναι ένα από τα φλέγοντα και πάντα επίκαιρα
προβλήματα στην ειδικότητα της Μαιευτικής, αφού η συχνότητα εμφάνισής του δεν
έχει ελαττωθεί καθόλου τα τελευταία χρόνια, παρά τις δραματικές τεχνολογικές
και επιστημονικές εξελίξεις που έχουν παρατηρηθεί σε αυτό το χώρο κατά το ίδιο
χρονικό διάστημα. Επίσης, τα προβλήματα που σχετίζονται με την προωρότητα παραμένουν
η κύρια αιτία για το 70% των εμβρυϊκών και νεογνικών θανάτων. Τα τελευταία στοιχεία
δείχνουν ότι ο πρόωρος τοκετός δεν είναι μια πρόωρη και άκαιρη εμφάνιση ενός
φυσιολογικού φαινομένου, αλλά μάλλον ένα σύνδρομο πολυπαραγοντικής αιτιολογίας.
Στο άρθρο αυτό παρουσιάζονται οι τέσσερις επικρατέστερες μέχρι σήμερα θεωρίες,
που θα μπορούσαν να εξηγήσουν την αλυσίδα των γεγονότων, η οποία καταλήγει στην
πρόωρη έξοδο του εμβρύου. Αυτές αφορούν στην πρόωρη ενεργοποίηση του άξονα Υποθάλαμος-Υπόφυση-Επινεφρίδια
τόσο της μητέρας, όσο και του εμβρύου, ένας μηχανισμός για τον οποίο υπάρχουν
ενδείξεις ότι ίσως να εμπλέκεται και στον τελειόμηνο τοκετό. Επίσης, αφορούν
στην ύπαρξη μιας υποκλινικής φλεγμονής ως έναυσμα για την πυροδότηση μιας αλυσιδωτής
αντίδρασης, η οποία περιλαμβάνει προφλεγμονώδεις πρωτεΐνες που παράγονται από
τα στοιχεία της κύησης και καταλήγουν, με τη σειρά τους, στην παραγωγή μητροσυσπαστικών
παραγόντων. Τέλος, αναφέρεται και η εμφανής ή υποκλινική αιμορραγία των στοιχείων
της κύησης, αλλά και η υπερδιάταση των εμβρυϊκών μεμβρανών, ως εναρκτήρια γεγονότα
που θα καταλήξουν στην πρόωρη γέννηση του εμβρύου.
Όροι ευρετηρίου: πρόωρος τοκετός, φλεγμονή, αιμορραγία, οιστριόλη, θρομβίνη.
ΕΙΣΑΓΩΓΗ
Ως πρόωρος ορίζεται κάθε τοκετός που συμβαίνει πριν την 37η εβδομάδα της κύησης
ή πριν την 259η ημέρα από την τελευταία έμμηνο ρύση. Εξακολουθεί να αποτελεί
ένα από τα μεγαλύτερα προβλήματα της Μαιευτικής, αφού η συχνότητά του δεν έχει
ελαττωθεί καθόλου, ενώ τουλάχιστον στις αναπτυγμένες χώρες τα προβλήματα που
σχετίζονται με την προωρότητα είναι υπεύθυνα για την πλειονότητα των εμβρυϊκών
ή νεογνικών θανάτων, αλλά και για την αυξημένη νοσηρότητα που παρατηρείται σε
αυτά τα νεογνά.(1)
Ο πρόωρος τοκετός δεν είναι μια απλή παραλλαγή του φυσιολογικού τοκετού σε λάθος
χρόνο. Φαίνεται ότι είναι μια πολυπαραγοντική νόσος, στην παθογένεια της οποίας
συμμετέχουν η μητέρα, το έμβρυο και ο πλακούντας και η κλινική έκφραση της οποίας
είναι ο πρόωρος τοκετός με άθικτες τις μεμβράνες, η πρόωρη ρήξη των εμβρυϊκών
υμένων και η ανεπάρκεια του τραχήλου, η οποία εμφανίζεται χωρίς να έχει προηγηθεί
άλλη συμπτωματολογία. Όλα τα παραπάνω συνθέτουν την εικόνα του "Συνδρόμου
του Πρόωρου Τοκετού".(2) Το σύνδρομο αυτό είναι συνήθως αποτέλεσμα μιας
αργής, χρόνιας ενδομήτριας φλεγμονώδους αντίδρασης. Η φλεγμονή αυτή μπορεί να
είναι αποτέλεσμα μιας υποκλινικής μικροβιακής λοίμωξης, η οποία μπορεί να προσβάλλει
τη μητέρα ή το έμβρυο μετά από ανιούσα προσβολή των στοιχείων της κύησης, ή
μετά από αναζωπύρωση μικροβίων που προϋπάρχουν στην ενδομήτρια κοιλότητα.3 Η
φλεγμονώδης αντίδραση μπορεί ακόμη να είναι μια απάντηση σε ερεθίσματα όπως
η μητροπλακουντιακή ισχαιμία,(4) ενώ υπάρχουν και στοιχεία που θέτουν την υπόνοια
μιας αλλεργικής αντίδρασης ή μιας αντίδρασης έναντι αλλομοσχεύματος,(5) όπως
θεωρείται το έμβρυο από τη μητέρα.
Τέσσερις φαίνεται να είναι
οι κύριοι παθογενετικοί μηχανισμοί που παρεμβάλλονται μεταξύ του αρχικού γεγονότος
και του τελικού αποτελέσματος που είναι ο πρόωρος τοκετός:
- μια ενεργοποίηση του ορμονικού άξονα Υποθάλαμος-Υπόφυση-Επινεφρίδια (ΥΕΕ)
τόσο της μητέρας, όσο και του εμβρύου,
- μια φλεγμονή είτε των στοιχείων της κύησης, είτε συστηματική,
- μια αιμορραγία μετά από αποκόλληση του χορίου ή του φθαρτού και
- η παραγωγή θρομβίνης που συνεπάγεται η παθολογική διάταση της μήτρας (σχήμα
1).

Σχήμα
1. Οι 4 κύριες παθοφυσιολογικές οδοί που μπορεί να καταλήξουν σε
πρόωρο τοκετό.
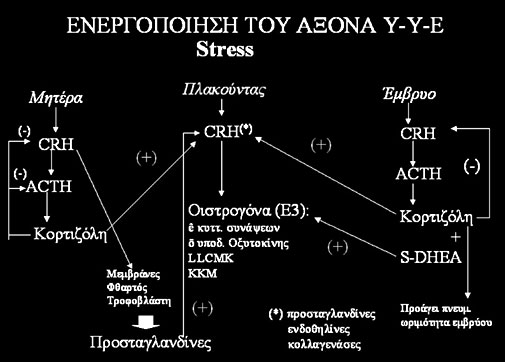
Σχήμα
2. Σχηματική αναπαράσταση της παθοφυσιολογικής αλυσίδας που μπορεί
να καταλήξει σε πρόωρο τοκετό μετά από ενεργοποίηση
του άξονα Υποθάλαμος - Υπόφυση - Επινεφρίδια (CRH-Cortisol Releasing Hormone:
ορμόνη που προκαλεί την απελευθέρωση κορτιζόλης,
S-DHEA-Sulphate Dehydroepiandrosterone: θειική δεϋδροεπιανδροστερόνη, LCMK-Light
Chain Myosin Kinase: κινάση της ελαφράς αλύσου
της μυοσίνης, KM-KalModuline: καλμοδουλίνη).
Ενεργοποίηση
του Αξονα ΥΕΕ
Η ενεργοποίηση του βασικού αυτού ενδοκρινικού άξονα φαίνεται να εμπλέκεται και
στο φυσιολογικό τοκετό και ίσως να είναι ο μηχανισμός που να χαρακτηρίζει το
βιολογικό ρολόι που σηματοδοτεί την έναρξη μιας φυσιολογικής διαδικασίας. Στον
πρόωρο τοκετό, φαίνεται να υπάρχει μια πρόωρη ενεργοποίηση του άξονα αυτού,
τόσο στη μητέρα όσο και στο έμβρυο, και ο μηχανισμός αυτός φαίνεται να εμπλέκεται
στα περιστατικά εκείνα που συμβαίνουν σχετικά αργά στην κύηση και μάλλον μετά
την 32η εβδομάδα. Στη μητέρα, οι λόγοι που οδηγούν σε αυτή την άκαιρη πυροδότηση
είναι ένα ψυχολογικό ή σωματικό stress.(6) Αυτός θα μπορούσε να είναι και ένας
μηχανισμός που να εξηγεί τις περιπτώσεις πρόωρου τοκετού σε χαμηλότερα κοινωνικοοικονομικά
στρώματα, σε ανύπαντρες μητέρες, σε περιπτώσεις έντονης σωματικής άσκησης, χρόνιων
συστηματικών λοιμώξεων ή φλεγμονών, αφού όλες αυτές οι περιπτώσεις συνοδεύονται
από χρόνιο stress. Η πρόωρη ενεργοποίηση του ορμονικού αυτού άξονα στο έμβρυο
θα μπορούσε να είναι αποτέλεσμα μια κακής αιμάτωσης του πλακούντα, προεκλαμψίας
ή υποξαιμίας.(7,8) Το αποτέλεσμα αυτής της ενεργοποίησης είναι και στις δύο
περιπτώσεις η πρόωρη και η ιδιαίτερα αυξημένη έκκριση της ορμόνης που διεγείρει
την έκκριση της κορτιζόλης (Cortisol Releasing Hormone - CRH) από τη μητέρα
και το έμβρυο. Οι δύο αυτοί άξονες επικοινωνούν μεταξύ τους και με τον πλακούντα,
ο οποίος έχει και αυτός την ιδιότητα να εκκρίνει την ίδια ορμόνη. Η έκκριση
CRH από τη μητέρα έχει ως αποτέλεσμα τα εξής: αφενός την έκκριση κορτιζόλης,
η οποία δρα στον πλακούντα και διεγείρει την περαιτέρω έκκριση CRH από αυτόν
(παρατηρείται δηλαδή ένα κύκλωμα θετικής βιοανάδρασης -positive feedback- σε
αντίθεση με τον υποθάλαμο, όπου το αντίστοιχο κύκλωμα έχει αρνητικό χαρακτήρα)
και αφετέρου, την άμεση δράση της ίδιας στις μεμβράνες, στο φθαρτό και στα τροφοβλαστικά
κύτταρα, που έχει ως αποτέλεσμα τη σύνθεση και την έκκριση προσταγλανδινών τοπικά.
Ακόμη, δεν αποκλείεται και η απευθείας δράση της στο μυομήτριο.(9) Οι προσταγλανδίνες
που παράγονται από τα διάφορα στοιχεία της κύησης μετά την επίδραση της CRH,
με τη σειρά τους διεγείρουν την περαιτέρω έκκριση της τελευταίας από τον πλακούντα,
δημιουργώντας έτσι ένα δεύτερο κύκλωμα θετικής βιοανάδρασης, το οποίο έχει,
τελικά, ως αποτέλεσμα την ολοένα και μεγαλύτερη αύξηση των επιπέδων τόσο της
CRH, όσο και των προσταγλανδινών.
Η απάντηση του εμβρύου στο stress περιλαμβάνει κι εδώ την απότομη κι απρόσκοπτη
αύξηση της έκκρισης της CRH από τον υποθάλαμό του (ο άξονας ΥΕΕ στο έμβρυο λειτουργεί
από την 7η-8η εβδομάδα της ενδομήτριας ζωής). Έτσι, διεγείρεται η έκκριση ACTH
και κορτιζόνης, αλλά και θειικής δεϋδροεπιανδροστερόνης (Dehydroepiandrosterone
Sulfate - DHEA-S) από τα επινεφρίδια του εμβρύου.(10) Η κινητοποίηση του μηχανισμού
αυτού έχει τα εξής αποτελέσματα:
- διεγείρει μέσω ενός κυκλώματος θετικής βιοανάδρασης, την περαιτέρω έκκριση
CRH από τον πλακούντα (θα αναφερθεί στη συνέχεια ο ρόλος που παίζει η πλακουντιακή
CRH).
- η αυξημένη ποσότητα εμβρυϊκής κορτιζόνης αφενός δρα στους εμβρυϊκούς πνεύμονες
προκαλώντας την ωρίμανσή τους, αφετέρου ανταγωνίζεται την προγεστερόνη στους
υποδοχείς γλυκοκορτικοειδών του πλακούντα, καταλαμβάνοντάς τους τελικά. Η απώθηση
της προγεστερόνης -που παίζει ανασταλτικό ρόλο στη διέγερση της μήτρας- από
τους υποδοχείς της, οδηγεί τελικά στην κατάληψη αυτών των θέσεων από την κορτιζόνη
και στη διέγερση περαιτέρω έκκρισης CRH από τον πλακούντα.
- η DHEA-S από τα εμβρυϊκά επινεφρίδια αποτελεί πρόδρομο ουσία για την παραγωγή
από τον πλακούντα οιστρόνης, οιστραδιόλης και οιστριόλης, αφού ο πλακούντας
δεν έχει τον ενζυματικό μηχανισμό να μετατρέψει την προγεστερόνη (που αποτελεί
και το μοναδικό στεροειδές που παράγει) σε οιστριόλη.
Τα οιστρογόνα που τελικά παράγονται από τον πλακούντα, σε αυξημένες τώρα πια
ποσότητες, έχουν ως αποτέλεσμα την αύξηση των διακυτταρικών συνδέσμων (gap junctions)
στα κύτταρα του μυομητρίου, την αύξηση των υποδοχέων της οξυτοκίνης, καθώς και
την αυξημένη παραγωγή ενζύμων που είναι υπεύθυνα για τη σύσπαση των μυϊκών ινών
του μυομητρίου (κινάση της ελαφράς αλύσου της μυοσίνης, καλμοδουλίνη).(9) Λόγω
του ότι η οιστριόλη, που αποτελεί και το κύριο οιστρογόνο της κύησης, προέρχεται
κατά 90% τουλάχιστον από την εμβρυϊκή DHEA-S, η πρόωρη αύξησή της φαίνεται να
αντανακλά με αρκετά μεγάλη ακρίβεια την πρόωρη ενεργοποίηση του άξονα ΥΕΕ του
εμβρύου. Λαμβάνοντας υπόψη ότι αυτή η ενεργοποίηση πιθανόν να ενέχεται στην
παθοφυσιολογία του πρόωρου τοκετού, αναζητήθηκε η πιθανή συσχέτιση που μπορεί
να υπάρχει μεταξύ της αύξησης της οιστριόλης στην κυκλοφορία της μητέρας και
της πρόωρης εξόδου του εμβρύου. Πραγματικά, η αύξησή της στη μητρική κυκλοφορία
αντανακλάται με αρκετά μεγάλη ακρίβεια στη συγκέντρωσή της στο σάλιο και αυτή
με τη σειρά της μάλλον φαίνεται να ανιχνεύει με αρκετά μεγάλη ευαισθησία και
ακρίβεια τις γυναίκες που θα καταλήξουν σε πρόωρο τοκετό. Έτσι, αύξηση της οιστριόλης
του σάλιου >2,1ng/ml παρουσιάζει -όσον αφορά στην πρόγνωση του πρόωρου τοκετού-
ευαισθησία 44%, ειδικότητα 92%, PPV 18% και NPV 92%. Η απόδοση αυτής της δοκιμασίας
φαίνεται να είναι ακόμη καλύτερη όταν το τεστ ξαναβγαίνει θετικό, ειδικά σε
περιπτώσεις κυήσεων υψηλού κινδύνου.(11)
Τέλος, η πλακουντιακή CRH, της οποίας η παραγωγή διεγείρεται μέσω κυκλώματος
θετικής βιοανάδρασης, τόσο από την κορτιζόνη του εμβρύου όσο και της μητέρας,
πέρα από τις δράσεις που προαναφέρθηκαν δρα και με παρακρινικό τρόπο, προκαλώντας
τη σύνθεση και παραγωγή προσταγλανδινών και ενδοθηλινών από το άμνιο και το
χόριο, αλλά και προάγοντας τη δραστηριότητα του μυομητρίου με απευθείας δράση
στις λείες μυϊκές ίνες. Επίσης, προάγει την παραγωγή κολαγενασών, οι οποίες
μπορεί να προκαλέσουν ωρίμανση του τραχήλου. Η έκκριση της CRH, πέρα από την
κορτιζόλη, μπορεί να προκληθεί και μετά από δράση κυτταροκινών, αλλά και ως
απάντηση σε μια ανοξική κατάσταση. Οι κυτταροκίνες που πιθανόν να παίζουν τέτοιο
ρόλο είναι η ιντερλευκίνη 1-β (IL-1β) και ο TNF-α(9) (σχήμα 2).
Οι ενδείξεις για τη συμμετοχή του άξονα ΥΥΕ μητέρας και εμβρύου, αντανακλώνται,
όπως προαναφέρθηκε, τόσο στην αύξηση της οιστριόλης -που αποτελεί δείκτη της
λειτουργίας των εμβρυϊκών επινεφριδίων(11)- όσο και στην αύξηση των επίπεδων
της CRH στον ορό της μητέρας που τελικά θα γεννήσει πρόωρα.(12)

Σχήμα
3. Σχηματική αναπαράσταση της παθοφυσιολογικής αλυσίδας που μπορεί
να καταλήξει σε πρόωρο τοκετό μετά από
αιμορραγία σε κάποιο από τα στοιχεία της κύησης και σχηματισμό θρομβίνης (TF-Tissue
Factor: ιστικός παράγοντας).
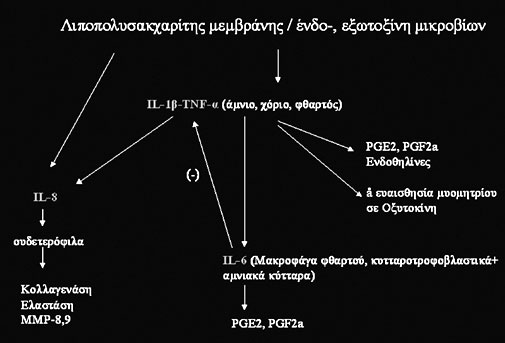
Σχήμα
4. Σχηματική αναπαράσταση της παθοφυσιολογικής αλυσίδας που μπορεί
να καταλήξει σε πρόωρο τοκετό μετά από
προσβολή των στοιχείων της κύησης από κάποια μικρόβια (IL-1β,6,8 - Interleukin-1β,6,8:
ιντερλευκίνες 1β,6,8, TNF-α-Tumor
Necrosis Factor-α: παράγοντας νέκρωσης των όγκων-α, PGE2,F2α: προσταγλανδίνες
Ε2,F2α, MMP-Matrix Metaloproteinases: μεταλλοπρωτεϊνάσες του διάμεσου ιστού).
Αιμορραγία
Η αιμορραγία κατά τη διάρκεια της κύησης, κλινική ή υποκλινική, σχετίζεται τόσο
με πρόωρο τοκετό, όσο και με Πρόωρη Ρήξη των Εμβρυϊκών Υμένων (ΠΡΕΥ).(13,14)
Η εμφάνιση κολπικής αιμόρροιας σε περισσότερα από ένα τρίμηνα, αυξάνει τον κίνδυνο
για ΠΡΕΥ κατά 7 φορές. Το φαινόμενο αυτό μπορεί να ερμηνευθεί αν λάβει κανείς
υπόψη την παραγωγή της θρομβίνης, που είναι το τελικό προϊόν του εξωγενούς μηχανισμού
πήξης. Ιστικός παράγοντας που παράγεται από το φθαρτό, αντιδρά με τον ενεργοποιημένο
παράγοντα VII (VIIa) και έχει ως αποτέλεσμα την παραγωγή του ενεργοποιημένου
παράγοντα X (Xa). Αυτός με τη σειρά του θα αντιδράσει με τον ενεργοποιημένο
παράγοντα V (Va), με τελικό αποτέλεσμα την παραγωγή θρομβίνης. Η θρομβίνη μπορεί
να ενεργοποιήσει διάφορες πρωτεάσες και μεταλλοπρωτεϊνάσες, οι οποίες δρώντας
στην επιφάνεια των εμβρυϊκών μεμβρανών δημιουργούν ευένδοτα σημεία που προδιαθέτουν
σε ΠΡΕΥ (σχήμα 3). Επίσης, in vitro, έχει φανεί ότι η θρομβίνη δρα τόσο ινότροπα,
όσο και χρονότροπα, σε λείες μυϊκές ίνες από μυομήτριο, φαινόμενο που αναστέλλεται
όταν προστεθεί ορός αίματος που περιέχει αναστολείς της θρομβίνης.(15) Στοιχεία
που θέτουν ενδείξεις υπέρ αυτής της άποψης είναι μια πρόσφατη πιλοτική μελέτη,
όπου συμπλέγματα θρομβίνης-αντιθρομβίνης III (ΤΑΤ), που είναι δείκτες ενεργοποίησης
της θρομβίνης, ανιχνεύθηκαν σε υψηλά επίπεδα σε σχέση με την ομάδα ελέγχου,
σε ασθενείς που παρουσίασαν μια συμπτωματολογία πρόωρου τοκετού και γέννησαν
μέσα στις επόμενες 3 εβδομάδες. Συγκέντρωση ΤΑΤ μεγαλύτερη από 8,0ng/ml είχε
ευαισθησία 50%, ειδικότητα 91%, θετική προγνωστική αξία 80% και αρνητική προγνωστική
αξία 71%, ενώ για συγκεντρώσεις ΤΑΤ >6,3ng/ml, τα αντίστοιχα μεγέθη ήταν
75%, 73%, 67% και 73%.(16)
ΠαθολογικΗ διΑταση τηΣ μΗτραΣ
Η παθολογική διάταση της μήτρας, όπως συμβαίνει σε περίπτωση υδραμνίου ή πολύδυμης
κύησης, είναι γνωστό ότι μπορεί να οδηγήσει σε πρόωρο τοκετό. Ο παθοφυσιολογικός
μηχανισμός που παρεμβάλλεται ανάμεσα σε αυτά τα δύο γεγονότα, φαίνεται να έχει
ως εναρκτήριο γεγονός την υπερβολική διάταση τόσο των ινών του μυομητρίου, όσο
και των εμβρυϊκών μεμβρανών. Η μεν πρώτη μπορεί να οδηγήσει σε παραγωγή προσταγλανδινών
Ε2 και F2a, σε σχηματισμό διακυτταρικών συνάψεων (gap junctions) μεταξύ των
μυϊκών ινών, αλλά και σε παραγωγή υποδοχέων οξυτοκίνης,(17) ενώ η δεύτερη μπορεί
να προκαλέσει την παραγωγή ιντερλευκίνης-8 (IL-8) και κολλαγενασών, οι οποίες
μπορεί να δημιουργήσουν ένα ευένδoτο σημείο στις εμβρυϊκές μεμβράνες, καταλήγοντας
έτσι σε πρόωρη ρήξη των εμβρυικών υμένων.(18) Εντούτοις, αυτά τα περιστατικά
μάλλον αποτελούν έναν ετερογενή πληθυσμό, τουλάχιστον για τις περιπτώσεις της
πολύδυμης κύησης, οπότε μπορεί αυτή να μην είναι η μοναδική οδός μέσω της οποίας
αυτά καταλήγουν σε πρόωρο τοκετό. Έτσι, ατελής διήθηση της τροφοβλάστης μπορεί
να οδηγήσει σε ελλιπή αιμάτωση του κυήματος κι έτσι υποξία και έναρξη τελικά
του τοκετού μέσω μηχανισμού stress.
Φλεγμονή
και πρόωρος τοκετός
Υπάρχει σήμερα μια πληθώρα στοιχείων που δείχνει ότι ο πρόωρος τοκετός μπορεί
να είναι αποτέλεσμα μιας φλεγμονώδους διαδικασίας, η οποία έχει ως τελικό αποτέλεσμα
την εμφάνιση συσπάσεων της μήτρας ή την πρόωρη ρήξη των εμβρυϊκών υμένων. Η
φλεγμονώδης αυτή διαδικασία μπορεί να είναι άσηπτη, π.χ. ως αποτέλεσμα υποξίας
του εμβρύου, αν και τα περισσότερα στοιχεία καταδεικνύουν ότι μάλλον κάποια
μικρόβια αποτελούν το έναυσμα για την έναρξη της αλυσιδωτής αντίδρασης που θα
καταλήξει σε μια φλεγμονώδη απάντηση από τη μητέρα ή το έμβρυο. Η απάντηση αυτή
χαρακτηρίζεται από την παρουσία φλεγμονωδών παραγόντων (όπως ο TNF-α ή IL-1β
που προαναφέρθηκαν), οι οποίοι είτε δρώντας απευθείας, είτε μέσω του άξονα ΥΕΕ,
καταλήγουν στην πρόωρη γέννηση του εμβρύου. Υπάρχουν 3 ομάδες στοιχείων που
υποστηρίζουν το σημαντικό ρόλο μιας λοίμωξης στον πρόωρο τοκετό: α) χορήγηση
βακτηρίων ή προϊόντων τους σε εγκύμονα πειραματόζωα κατέληξε σε πρόωρο τοκετό,(19)
β) συστηματικές λοιμώξεις της μητέρας (π.χ. πυελονεφρίτιδα, πνευμονία) μπορεί
να καταλήξουν σε πρόωρο τοκετό, γ) η εντοπισμένη ενδομήτρια λοίμωξη μπορεί επίσης
να έχει το ίδιο αποτέλεσμα.(20)
Τα ευρήματα από διάφορες κλινικές και πειραματικές μελέτες που ενισχύουν αυτή
την άποψη είναι τα εξής:
α) Τα βακτήρια -οι λιποπρωτεΐνες του τοιχώματός τους ή/και οι ενδοτοξίνες που
παράγουν- μπορούν απευθείας να προκαλέσουν την παραγωγή πρωτεασών, κολλαγενασών
ή ελαστάσης, οπότε και να προκαλέσουν τελικά πρόωρη ρήξη των εμβρυϊκών υμένων.(21)
Επίσης, είναι υπεύθυνα για την παραγωγή φωσφολιπάσης Α2, η οποία είναι το κύριο
ένζυμο που απαιτείται για την παραγωγή προσταγλανδινών.(22)
β) Η συστηματική λοίμωξη της μητέρας μπορεί να προκαλέσει πρόωρο τοκετό, είτε
μετά από υψηλό πυρετό και αφυδάτωση (άρα παραγωγή οξυτοκίνης), είτε μετά από
απελευθέρωση στη συστηματική κυκλοφορία προφλεγμονωδών παραγόντων, π.χ. TNF-α,
IL-1β που, όπως θα φανεί παρακάτω, μπορούν να προκαλέσουν πρόωρες συσπάσεις
της μήτρας, άμεσα ή έμμεσα.(23)
γ) Ο πιο συναρπαστικός μηχανισμός φαίνεται να είναι αυτός που ενοχοποιεί την
παρουσία μικροβίων στην ενδομήτρια κοιλότητα, ως το εναρκτήριο έναυσμα για την
παθοφυσιολογική αλυσίδα. Είναι γνωστό ότι η χοριοαμνιονίτιδα που είναι κλινικά
εμφανής μπορεί να προκαλέσει πρόωρο τοκετό. Αυτό όμως παρατηρείται μόνο στο
12% περίπου των περιπτώσεων πρόωρου τοκετού με άθικτους υμένες, ενώ στο 40%
αυτών των περιστατικών παρατηρούνται ιστολογικά στοιχεία χοριοαμνιονίτιδας στον
πλακούντα. Η δε συχνότητα με την οποία ανευρίσκεται ιστολογική χοριοαμνιονίτιδα
αυξάνει αντιστρόφως ανάλογα με την ηλικία κύησης στην οποία συνέβη ο πρόωρος
τοκετός, ειδικά πριν τις 30-32 εβδομάδες, καταδεικνύοντας τον πολύ σημαντικό
ρόλο που παίζει αυτός ο παθοφυσιολογικός μηχανισμός στους πολύ πρόωρους τοκετούς.(24)
Με βάση, λοιπόν, αυτά τα στοιχεία έχει διατυπωθεί η εξής θεωρία: ο πρόωρος τοκετός
μπορεί να είναι το τελικό αποτέλεσμα μιας φλεγμονώδους αντίδρασης που προκλήθηκε
λόγω της παρουσίας μικροβίων στην ενδοαμνιακή κοιλότητα. Η παρουσία των μικροβίων
στη στείρα αυτή κοιλότητα μπορεί να εξηγηθεί με 2 κυρίως μηχανισμούς: με την
ανιούσα οδό, από τον κόλπο και δια μέσω του τραχήλου κάποια μικρόβια μπορεί
να προσβάλλουν σταδιακά όλα τα στοιχεία της κύησης και, τελικά, και το ίδιο
το έμβρυο ή, υπάρχουν ενδείξεις ότι μπορεί να προϋπήρχαν στην ενδομήτρια κοιλότητα,
ακόμα και πριν τη σύλληψη, και η παρουσία τους να εκδηλώθηκε τελικά στη διάρκεια
της κύησης ως πρόωρες συσπάσεις, πρόωρη ρήξη εμβρυϊκών υμένων ή ανεπάρκεια του
τραχήλου. (25,3) Δεν αποκλείεται φυσικά και η αιματογενής, καθώς και η διαπλακουντιακή
μετάδοση της λοίμωξης, αλλά αυτή η οδός φαίνεται να εμπλέκεται πολύ σπανιότερα.
Τα τελικά προϊόντα που προκαλούν το δυσάρεστο αυτό αποτέλεσμα είναι οι προσταγλανδίνες
Ε2 και F2α, οι ενδοθηλίνες, αλλά και οι μεταλλοπρωτεϊνάσες της ενδιάμεσης ουσίας
(MMP), ειδικά η 8 και η 9. Οι μεσολαβητές που παρεμβάλλονται μεταξύ των μικροβίων
και των πρωτεϊνών αυτών φαίνεται να είναι το δίκτυο κυτταροκινών που υπάρχει
στο φθαρτό, στο λείο και λαχνωτό χόριο, αλλά και στο άμνιο και ειδικότερα οι
IL-1β, IL-6 και ο TNF-α.(26)
Οι IL-1β και ο TNF-α φαίνεται να είναι οι πρώτες κυτταροκίνες που παράγονται
ως αποτέλεσμα δράσης τόσο των λιποπολυσακχαριτών του τοιχώματος των μικροβίων,
όσο και της ενδοτοξίνης που παράγουν κάποια Gram(-) μικρόβια. Και οι δύο αυτές
πρωτεΐνες παράγονται από τα μακροφάγα του φθαρτού, από κύτταρα του χορίου, αλλά
και από τροφοβλαστικά κύτταρα. Οι δύο αυτές κυτταροκίνες, δρώντας παρακρινικά,
προκαλούν τελικά την παραγωγή προσταγλανδίνης Ε2 και F2α από τα ίδια κύτταρα
(αμνίου, χορίου και φθαρτού), αλλά και την παραγωγή ενδοθηλίνης. Η IL-1β φαίνεται
να αυξάνει και την ευαισθησία του μυομητρίου στην οξυτοκίνη.(27)
Η IL-6 φαίνεται να παίζει συντονιστικό ρόλο στη φλεγμονή. Παράγεται από τα μακροφάγα
του φθαρτού, αλλά και από κυτταροτροφοβλαστικά κύτταρα και αμνιακά κύτταρα ως
απάντηση στην επίδραση της IL-1β και του TNF-α, ελέγχοντας όμως την έκκριση
του τελευταίου. Αποτελεί φυσιολογικό συστατικό του αμνιακού υγρού, αλλά αυξάνεται
δραματικά τόσο σε περιπτώσεις πρόωρου τοκετού, όσο και σε χοριοαμνιονίτιδα.
Η IL-6 προκαλεί παραγωγή προσταγλανδινών Ε2 και F2a από κύτταρα του φθαρτού
και του χορίου,(28) ενώ η παρουσία της στον τράχηλο φαίνεται να αυξάνεται αρκετά
ακόμη και σε ασυμπτωματικές κυήσεις που θα καταλήξουν σε πρόωρο τοκετό.(29)
Τελευταία στη διαδικασία φαίνεται να είναι η IL-8, η οποία παράγεται πάλι από
όλες τις τάξεις κυττάρων μετά από επίδραση λιποπολυσακχαριτών της μεμβράνης
των μικροβίων, TNF-α και IL-1β.(30) Ο ρόλος της είναι κυρίως χημειοτακτικός,
δηλαδή να προσελκύσει στην περιοχή της φλεγμονής ουδετερόφιλα και να τα ενεργοποιήσει.
Η διαδικασία αυτή προκαλεί τελικά την απελευθέρωση κολλαγενάσης και ελαστάσης,
που αποσυνδέουν και διασπούν τα ινίδια κολλαγόνου του τραχήλου, ενώ αυξάνουν
και την τοπική παραγωγή υαλουρονικού οξέος, το οποίο με τη σειρά του θα αυξήσει
την περιεκτικότητα σε νερό της διάμεσης ουσίας του τραχήλου. Και οι δύο αυτές
διαδικασίες έχουν ως αποτέλεσμα να αποκτήσει τελικά ο τράχηλος μια πιο μαλακή
υφή(21) (σχήμα 4).
Summary
Μamopoulos M.
Pathophysiology of the preterm labor
Hellen Obstet Gynecol 15(4):307-313, 2003
Despite the major scientific and technological advances that have been noted in the field of Obstetrics over the past twenty years, Preterm labor remains one of the big mysteries since there has been no decrease in its rate and, also, because prematurity-related problems are responsible for at least 70% of the fetal and neonatal deaths in developed countries. Evidence that have accumulated over the last 10-15 years point out that preterm labor is probably not a premature appearance of a physiological process but rather a syndrome of multi-factorial etiology. In this article the 4 more popular theories that concern the pathophysiology of preterm labor are presented. The premature activation of the maternal and / or fetal Hypothalamic-Pituitary-Adrenals axis is a mechanism that could also be implicated in normal labor. A sub clinical infection of the pregnancy elements could also be the event that triggers an inflammatory cascade-where proinflammatory mediators are involved-that results in the production of uterotonic agents and the consequent premature delivery of the fetus. An either evident or sub clinical hemorrhage within the pregnancy membranes or the pathologic uterine distention could be two more mechanisms that could explain the premature delivery of a fetus.
Key words: preterm labor, infection, bleeding, estriol, thrombin.
ΒΙΒΛΙΟΓΡΑΦΙΑ
1. Hack C, Taylor HG. School-age outcomes in children with birth weights under
750 gr. N Engl J Med 1994; 331:756.
2. Romero R, Mazor M, Munoz H. The Preterm Labor Syndrome. Ann N Y Acad Sci
1994; 734:414.
3. Korn AP, Bolan G, Padian N. Plasma-cell endometritis in women with symptomatic
Bacterial vaginosis. Obstet Gynecol 1995; 85:387.
4. Arias F, Rodriguez L, Rague S. Maternal placental vasculopathy and infection:
two distinct groups among patients with preterm labor and preterm ruptured membranes.
Am J Obstet Gynecol 1993; 168:585.
5. Romero R, Sepulveda S, Baumann P. The Preterm Labor Syndrome: biochemical,
cytologic, immunologic, pathologic, microbiologic and clinical evidence that
preterm labor is a heterogeneous disease. Am J Obstet Gynecol 1993; 168:288.
6. Copper RL, Goldenberg RL, Das A. The preterm prediction study: maternal stress
is associated with spontaneous preterm birth at less than 35 weeks' gestation.
NICHD Maternal-Fetal Medicine Units Network. Am J Obstet Gynecol 1996; 175:1.286.
7. Ott WS. Intrauterine growth retardation and preterm delivery. Am J Obstet
Gynecol 1993; 168:1.710.
8. Germain AM, Carvajal J, Sanchez M. Preterm labor: placental pathology and
clinical correlation. Obstet Gynecol 1999; 94:284.
9. Majzoub JA, McGregor JA, Lockwood CJ. A central theory of preterm and term
labor: putative role for Corticotrophin-releasing hormone. Am J Obstet Gynecol
1999; 180:S232.
10. Smith R, Mesiano S, Chan EC. Corticotrophin-releasing hormone directly and
preferentially stimulates dehydroepiandrosterone sulfate secretion by human
adrenal cortical cells. J Clin Endocrinol Metab 1998; 83:2.916.
11. Heine RP, McGregor JA, Dullien VK. Accuracy of salivary estriol testing
compared to traditional risk factor assessment in predicting preterm birth.
Am J Obstet Gynecol 1999; 180:S214.
12. Bocking C, Challis J, Korebrits C. New approaches to the diagnosis of preterm
labor. Am J Obstet Gynecol 1999; 180:S247.
13. Harger JH, Hsing AW, Tuomola RE. Risk factors for preterm premature rupture
of fetal membranes: a multi-center case control study. Am J Obstet Gynecol 1990;
163:130.
14. Salafia CM, Lopez-Zeno JA, Sherer DM. Histologic evidence of old intrauterine
bleeding is more frequent in prematurity. Am J Obstet Gynecol 1995; 173:1.065.
15. Elovitz MA, Saunders T, Ascher-Landsberg J, Philippe M. Effects of thrombin
on myometrial contractions in vitro and in vivo. Am J Obstet Gynecol 2000; 183:799.
16. Elovitz MA, Baron J, Phillippe M. The role of thrombin in preterm parturition.
Am J Obstet Gynecol 2001; 185:1.059
17. Word RA, Stull JT, Casey ML, Kamm KE. Contractile elements and myosin light
chain phosphorylation in myometrial tissue from non-pregnant and pregnant women.
J Clin Invest 1993; 92:29.
18. Maradny EE, Kanayama N, Halim A. Stretching of fetal membranes increases
the concentration of Interleukin-8 and collagenase activity. Am J Obstet Gynecol
1996; 174:843.
19. Fidel P, Romero R, Wolf N. Systemic and local cytokine profile in endotoxin-induced
preterm parturition in mice. Am J Obstet Gynecol 1994; 170:1.467.
20. Romero R, Sirtori M, Oyarzun F. Infection and Labor V: prevalence, microbiology
and clinical significance of intraamniotic infection in women with preterm labor
and intact membranes. Am J Obstet Gynecol 1989; 161:817.
21. Ogama M, Hirano H, Tsubaki H. The role of cytokines in cervical ripening:
correlations between the concentration of cytokines and hyalouronic acid in
cervical mucus and the induction of hyalouronic acid production by inflammatory
cytokines by human cervical fibroblasts. Am J Obstet Gynecol 1998; 179:105.
22. Mitchell MD, Trautman MS, Dudley DJ. Cytokine networking in the placenta.
Placenta 1993; 14:249.
23. Romero. Am J Obstet Gynecol 1994; 170:320.
24. Watts DH, Krohn MA, Hillier SL. The association of occult amniotic fluid
infection with gestational age and neonatal outcome among women in preterm labor.
Obstet Gynecol 1992; 79:351.
25. Gomez R, Ghezzi F, Romero R. Premature labor and intraamniotic infection.
Clin Perinatol 1995; 22(2):281.
26. Goldenberg RL, Hauth JC, Andrews WW. Intrauterine infection and preterm
delivery. N Engl J Med 2000; 342:1.500.
27. Lundin-Schiller L, Mitchell MD. Prostaglandin production by human chorion
laeve cells in response to inflammatory mediators. Placenta 1991; 12:353.
28. Romero R, Yoon BH, Kenney JS. Amniotic fluid Interleukin-6 determinations
are of diagnostic and prognostic value in preterm labor. Am J Reprod Immunol
1993; 30(2-3):167.
29. Goepfert AR, Goldenberg RL. The Preterm Prediction Study. Association between
cervical IL-6 concentration and spontaneous preterm birth. Am J Obstet Gynecol
2001; 184:483.
30. Barclay CG, Brennand JE. Interleukin-8 production by the human cervix. Am
J Obstet Gynecol 1993; 169:625.