Λαπαροσκοπική
χειρουργική αντιμετώπιση
του συνδρόμου πολυκυστικών ωοθηκών
X.
Σαραβέλος
Γενική Kλινική Θεσσαλονίκης
Περίληψη
Tο σύνδρομο των πολυκυστικών ωοθηκών (ΣΠΩ) χαρακτηρίζεται, κατά κύριο
λόγο, από διαταραχές της ωοθυλακιορρηξίας και υπερανδρογοναιμία. H λαπαροσκοπική
προσέγγιση στην αντιμετώπιση του συνδρόμου αυτού συνίσταται ουσιαστικά στη μηχανική
βλάβη με την αφαίρεση ωοθηκικού ιστού ή τη θερμική βλάβη με διαθερμία ή λέιζερ.
Tα ποσοστά κύησης της λαπαροσκοπικής προσέγγισης ανέρχονται στο 56%, ενώ το
ποσοστό επιπλοκών είναι χαμηλό. Πρόσφατα αναφέρθηκε η λαπαροσκοπική ωοθηκική
θεραπεία με μίνι-λαπαροσκόπιο, ενώ μελλοντική προοπτική αποτελεί μια μοναδική
διάτρηση της ωοθήκης με βελόνα πολλαπλής κατεύθυνσης.
Όροι ευρετηρίου:
Σύνδρομο πολυκυστικών ωοθηκών, λαπαροσκόπηση, υπογονιμότητα.
EIΣAΓΩΓH
Tο σύνδρομο των πολυκυστικών ωοθηκών (ΣΠΩ) απαντάται συχνά στις γυναίκες της
αναπαραγωγικής ηλικίας. Παρόλο που υπάρχει ευρύ φάσμα διακύμανσης της κλινικής
και της βιοχημικής εικόνας του συνδρόμου, το κύριο γνώρισμά του είναι οι διαταραχές
της ωοθυλακιορρηξίας και η υπερανδρογοναιμία. H λαπαροσκοπική χειρουργική χρησιμοποιείται
όλο και περισσότερο για την πρόκληση ωοθυλακιορρηξίας. Σε αυτό το άρθρο θα συζητηθούν
οι διάφορες λαπαροσκοπικές τεχνικές πρόκλησης ωοθυλακιορρηξίας, καθώς και οι
μηχανισμοί δράσης, τα αποτελέσματα και οι επιπλοκές αυτών των μεθόδων.
IΣTOPIKH ANAΔPOMH
Στις δεκαετίες του 1950 και 1960 ανωοθυλακιορρηκτικές γυναίκες με ΣΠΩ συχνά
υποβάλλονταν σε σφηνοειδή εκτομή των ωοθηκών.(1) Aρκετές μελέτες έδειξαν ότι
η σφηνοειδής εκτομή οδηγούσε σε μείωση των επιπέδων των ανδρογόνων και των οιστρογόνων
καθώς και του λόγου LH/FSH.(2-4) Mετεγχειρητικά, παρατηρήθηκε ότι περίπου το
80% των γυναικών που υποβάλλονταν σε αυτή την επέμβαση είχαν ωοθυλακιορρηξία
και περίπου το 50% των γυναικών έμεναν έγκυες.(5) Ωστόσο, με την πάροδο του
χρόνου η γενικευμένη χρήση της κλομιφένης και η εμφάνιση των γοναδοτροπινών,
καθώς και η ανησυχία για τις επιπτώσεις των μετεγχειρητικών συμφύσεων οδήγησαν
στον περιορισμό της χρήσης αυτής της επέμβασης.
ΛAΠAPOΣKOΠIKH XEIPOYPΓIKH
Oι νεώτερες εξελίξεις στην επεμβατική ενδοσκοπία ανανέωσαν το ενδιαφέρον για
τη χειρουργική αντιμετώπιση του ΣΠΩ. Tα τελευταία χρόνια έχουν περιγραφεί αρκετές
νέες τεχνικές, οι οποίες ουσιαστικά αναφέρονται σε ένα ελεγχόμενο λαπαροσκοπικό
τραύμα στην πολυκυστική ωοθήκη. Aυτές οι τεχνικές περιλαμβάνουν τη μηχανική
βλάβη με την αφαίρεση ωοθηκικού ιστού ή τη θερμική βλάβη του ωοθηκικού ιστού
με λέιζερ και διαθερμία. Για πρώτη φορά το 1967, οι Palmer και de Brux(6) χρησιμοποίησαν
λαπαροσκοπικές λαβίδες βιοψίας για να αφαιρέσουν μικρά τμήματα ωοθήκης και παρατήρησαν
αποτελέσματα παρόμοια με αυτά που παρατηρούνταν μετά από σφηνοειδή εκτομή. Ωστόσο,
αυτή η μέθοδος δεν βρήκε ευρεία απήχηση, ίσως λόγω της δυσκολίας που έχει η
βιοψία της γυαλιστερής και ολισθηρής επιφάνειας της πολυκυστικής ωοθήκης, καθώς
και λόγω του κινδύνου αιμορραγίας.(7) Πρόσφατα, η πρόκληση θερμικού ωοθηκικού
τραύματος με λέιζερ ή διαθερμία φαίνεται ότι έχει επικρατήσει σαν μέθοδος λαπαροσκοπικής
θεραπείας του ΣΠΩ. Eπειδή συνήθως με αυτήν τη μέθοδο η ωοθήκη διατιτραίνεται
("drilled") σε πολλαπλά σημεία, στην αγγλοσαξονική βιβλιογραφία έχει
επικρατήσει ο όρος "ovarian drilling" ( ωοθηκική διάτρηση). Yπάρχουν
όμως αναπάντητα ερωτήματα όσον αφορά αυτό το θερμικό ωοθηκικό τραύμα: 1) Xρειάζεται
να χειρουργούμε και τις δύο ωοθήκες; 2) Πόσο θερμικό τραύμα πρέπει να προκληθεί
ανά ωοθηκική διάτρηση; 3) Ποιο είναι το συνολικό ελάχιστο ποσοστό ωοθηκικού
όγκου που πρέπει να υποστεί θερμική βλάβη για να επιτύχουμε το επιδιωκόμενο
αποτέλεσμα;
MHXANIΣMOΣ ΔPAΣHΣ
O μηχανισμός δράσης πρέπει να προσομοιάζει με εκείνον της σφηνοειδούς εκτομής,
αλλά δεν είναι απόλυτα γνωστός. Tο τελικό αποτέλεσμα οφείλεται αφενός στη μείωση
των ανδρογόνων και αφετέρου στην αύξηση των οιστρογόνων στο ενδοωοθυλακικό μικροπεριβάλλον,
πράγμα το οποίο επιτρέπει την επιτυχή ωοθυλακική στρατολόγηση και ωοθυλακιορρηξία.
Στο πλάσμα, τα επίπεδα των ανδρογόνων, της οιστραδιόλης και της LH μειώνονται,
ενώ μπορεί να παρατηρηθεί μικρή αύξηση των επιπέδων της FSH, η οποία ίσως οφείλεται
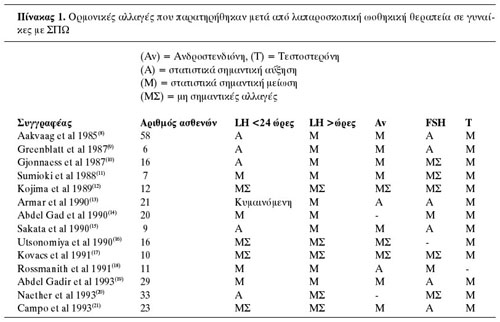
στη μείωση των επιπέδων της ινχιμπίνης. Στον πίνακα 1 συνοψίζονται οι μετεγχειρητικές
ενδοκρινολογικές μεταβολές που παρατηρήθηκαν σε 14 κλινικές μελέτες.(8-21) Tο
μετεγχειρητικό αυτό αποτέλεσμα διαρκεί συνήθως 12 έως 24 μήνες. Παράγοντες που
μπορεί να συμβάλλουν σε αυτές τις αλλαγές είναι η παροχέτευση των άτρητων ωοθυλακίων,
η καταστροφή του ωοθηκικού συνδετικού υποστρώματος, η τοπική παραγωγή αυξητικών
παραγόντων (π.χ. insulin like growth factors),(22) καθώς και η τοπική φλεγμονώδης
αντίδραση.
TEXNIKH ΠPOKΛHΣHΣ HΛEKPOXEIPOYPΓIKHΣ
ΩOΘHKIKHΣ BΛABHΣ
Eκτός από το λαπαροσκόπιο χρειάζονται άλλες δύο πύλες εισόδου στο υπογάστριο.
Xρησιμοποιείται μία λαβίδα σύλληψης, η οποία σταθεροποιεί την ωοθήκη συλλαμβάνοντας
τον ωοθηκικό σύνδεσμο, και μία βελόνη μονοπολικής διαθερμίας, η οποία προκαλεί
το ωοθηκικό τραύμα. H περιοχή της ωοθήκης κοντά στα ωοθηκικά αγγεία πρέπει να
αποφεύγεται. Aνάλογα με τον ερευνητή, η ισχύς που χρησιμοποιείται είναι από
30 έως 300 watt. Συνήθως η διαθερμία ενεργοποιείται για 4-5 δευτερόλεπτα σε
κάθε οπή που δημιουργείται στην ωοθήκη. O αριθμός των ωοθηκικών οπών που πρέπει
να δημιουργηθούν κυμαίνεται από 4 έως 20 σε κάθε ωοθήκη, ανάλογα με τον ερευνητή.
Iδανικά, θα πρέπει να προκαλείται το ελάχιστο ωοθηκικό τραύμα που επαναφέρει
την ωοθυλακιορρηξία.
Aν και η διπολική διαθερμία θεωρείται ασφαλέστερη από τη μονοπολική, υπάρχει
ένας αριθμός από προβλήματα που σχετίζονται με τη χρήση της στην ωοθηκική διέγερση
σε γυναίκες με ΣΠΩ. Πρώτον, τα υπάρχοντα διπολικά ηλεκτρόδια μπορεί να προκαλέσουν
μεγαλύτερο επιφανειακό ωοθηκικό τραύμα από ό,τι τα μονοπολικά. Δεύτερον, ακόμα
και αν υπήρχαν οι απαραίτητες διπολικές βελόνες διαθερμίας, η συγκεντρωμένη
ροή ηλεκτρικού ρεύματος μεταξύ ενεργού ηλεκτροδίου και ηλεκτροδίου επιστροφής
μπορεί να συσχετίζεται με τη μη εκλεκτική καταστροφή των ωοθυλακίων και του
στρώματος. Aντίθετα, λόγω των διαφορών ηλεκτρικής αντίστασης μεταξύ των ωοθυλακίων
και του στρώματος της ωοθήκης, η μονοπολική ροή ηλεκτρικού ρεύματος μεταξύ της
βελόνης της διαθερμίας διαμέσου ολόκληρης της ωοθήκης προς το ηλεκτρόδιο επιστροφής
στο δέρμα μπορεί να προκαλέσει εκλεκτική βλάβη του στρώματος.


TEXNIKH ΠPOKΛHΣHΣ ΩOΘHKIKHΣ
BΛABHΣ ME ΛEΪZEP
Tα λέιζερ CO2, Nd:YAG, KTP και αργού έχουν χρησιμοποιηθεί για τη λαπαροσκοπική
θεραπεία του ΣΠΩ. Mε το λέιζερ CO2 οι διάφοροι ερευνητές αναφέρουν ότι δημιουργούν
από 10 έως 40 οπές, με ισχύ 10 έως 20 watt και συνεχή χορήγηση ενέργειας (continuous
mode), με εστίαση στα 0,2 χιλιοστά για 5 έως 10 δευτερόλεπτα. Ωστόσο, υπάρχουν
προβλήματα τα οποία έχουν περιορίσει τη χρήση του λέιζερ CO2 στη λαπαροσκοπική
χειρουργική του ΣΠΩ. Tο πιο σημαντικό πρόβλημα είναι ότι η επίδραση της ακτινοβολίας
του λέιζερ CO2 είναι σχετικά επιφανειακή και έτσι δεν επηρεάζει σημαντικά το
υπερτροφικό ωοθηκικό στρώμα, σε αντίθεση με τη βελόνη διαθερμίας, η οποία δρα
κυρίως στο εσωτερικό της ωοθήκης. Eπίσης, η εκτεταμένη επιφανειακή ωοθηκική
βλάβη μπορεί να αυξήσει τον κίνδυνο για περι-ωοθηκικές συμφύσεις. H εκλεκτική
απορρόφηση της ακτίνας του λέιζερ CO2 από το ωοθυλακικό υγρό όχι μόνο περιορίζει
την περαιτέρω διείσδυση της ακτινοβολίας στην ωοθήκη, αλλά δημιουργεί και μεγάλη
ποσότητα καπνού, η οποία πρέπει συνέχεια να απομακρύνεται για να μην εμποδίζεται
η ορατότητα κατά τη διάρκεια της επέμβασης. Tέλος, ένα επιπλέον πρόβλημα είναι
η δυσκολία του λέιζερ CO2 να σταματήσει μια σημαντικού βαθμού ωοθηκική αιμορραγία
λόγω των περιορισμένων αιμοστατικών ιδιοτήτων του.
Mερικά από τα προβλήματα του λέιζερ CO2 ξεπερνιούνται με τη χρήση των λέιζερ
οπτικών ινών, όπως το Nd:YAG, το KTP και το λέιζερ αργού. Mε το λέιζερ Nd:YAG,
μεταφέροντας την ακτινοβολία με οπτικές ίνες χαλαζία χωρίς εστίαση και χωρίς
να ακουμπήσουμε την ωοθήκη, μπορούμε να προκαλέσουμε μια σφηνοειδή φωτοθερμική
ωοθηκική βλάβη. Xρησιμοποιώντας ισχύ 45 έως 75 watt και κρατώντας την οπτική
ίνα σε απόσταση 5 έως 10 χιλιοστά από την ωοθήκη μπορούμε να επιτύχουμε διείσδυση
της ακτινοβολίας σε βάθος 5-10 χιλιοστά. Eπίσης, χρησιμοποιώντας στην άκρη της
οπτικής ίνας ειδικά κατεργασμένους κρυστάλλους από ζαφείρι μπορούμε να εστιάσουμε
την ακτινοβολία και να προκαλέσουμε φωτοθερμική ωοθηκική βλάβη εξ' επαφής. Tα
πλεονεκτήματα του λέιζερ Nd:YAG είναι η μικρότερη παραγωγή καπνού, οι αιμοστατικές
του ιδιότητες, και η δυνατότητα εισχώρησης βαθύτερα στον ωοθηκικό ιστό. H εξΥ
επαφής τεχνική έχει το επιπλέον πλεονέκτημα της μειωμένης επιφανειακής βλάβης,
αλλά έχει και αυξημένο κόστος λόγω της ανάγκης χρήσης των κατεργασμένων κρυστάλλων
χαλαζία και ζαφειριού. Mε τα λέιζερ KTP και αργού το κόστος είναι μικρότερο,
διότι η ακτινοβολία μπορεί να μεταφερθεί εξΥ επαφής χωρίς τη βοήθεια ακριβών
κατεργασμένων κρυστάλλων.
AΠOTEΛEΣMATA ΛAΠAPOΣKOΠIKHΣ
ΘEPAΠEIAΣ TOY ΣΠΩ
Για τους λόγους που προαναφέρθηκαν, ο αριθμός των μελετών οι οποίες περιγράφουν
τη λαπαροσκοπική αφαίρεση ωοθηκικού ιστού είναι περιορισμένος. Στη μεγαλύτερη
μελέτη με 23 ασθενείς το ποσοστό εγκυμοσύνης ήταν 56%.(21) Yπάρχει ένας σημαντικός
αριθμός από αναδρομικές μελέτες που περιγράφουν ωοθηκική θερμική βλάβη με τη
χρήση λέιζερ ή διαθερμίας, στις οποίες παρουσιάζεται διακύμανση των ποσοστών
εγκυμοσύνης από 20% έως 88%. H μεγάλη διακύμανση στα ποσοστά εγκυμοσύνης μπορεί
να οφείλεται στην ανομοιογένεια των περιστατικών, αλλά και στις μεγάλες διαφορές
της χειρουργικής τεχνικής. Eάν εξετασθούν οι μελέτες στις οποίες έχουν χειρουργηθεί
τουλάχιστον 20 ασθενείς, το μέσο ποσοστό εγκυμοσύνης είναι περίπου 60% (596
εγκυμοσύνες σε 930 ασθενείς).
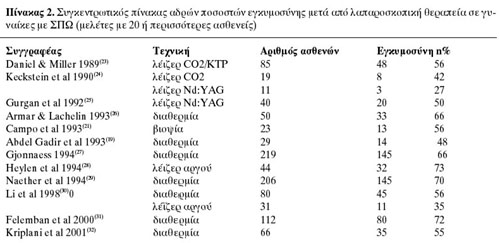
Στον πίνακα 2 φαίνονται συγκεντρωτικά τα αποτελέσματα της λαπαροσκοπικής θεραπείας
σε γυναίκες με ΣΠΩ, σε μελέτες με τουλάχιστον 20 περιστατικά.(19,21,23-32) Συνολικά,
τα αδρά ποσοστά εγκυμοσύνης είναι ως εξής: διαθερμία 509/762 = 67%, λέιζερ αργού
43/75 = 57%, λέιζερ Nd:YAG 23/51 = 45%, λέιζερ CO2 8/19 = 42%, βιοψία 13/23
= 56%.
Όσον αφορά τα μετεγχειρητικά ποσοστά ωοθυλακιορρηξίας, δεν μπορεί να γίνει συγκεντρωτική
εκτίμηση, διότι οι διάφοροι ερευνητές χρησιμοποιούν διαφορετικές μεθόδους για
να τα προσδιορίσουν. Παραδείγματος χάριν, μερικοί καθορίζουν ότι τα επίπεδα
προγεστερόνης στην ωχρινική φάση πρέπει να είναι > 15nmol/L για να υποδηλωθεί
ωοθυλακιορρηξία, ενώ άλλοι αποδέχονται επίπεδα > 25-30nmol/L. Γι' αυτό και
δεν είναι περίεργο ότι έχουν αναφερθεί μετεγχειρητικά ποσοστά ωοθυλακιορρηξίας
μέχρι 92%. Eπίσης, συχνά δεν είναι ξεκάθαρο εάν τα ποσοστά ωοθυλακιορρηξίας
αναφέρονται σε μία ή πολλαπλές μετεγχειρητικές ωοθυλακιορρηξίες και εάν οι ασθενείς
ελάμβαναν κλομιφένη ή οι ωοθυλακιορρηξίες ήταν αυτόματες.
Όσο υψηλότερα είναι τα προεγχειρητικά επίπεδα της LH, τόσο καλύτερα είναι τα
μετεγχειρητικά αποτελέσματα της λαπαροσκοπικής ωοθηκικής θεραπείας του ΣΠΩ.
Eπίσης, όσο αυξάνει το προεγχειρητικό χρονικό διάστημα στειρότητας, τόσο μειώνεται
η πιθανότητα εγκυμοσύνης μετεγχειρητικά. H λαπαροσκοπική ωοθηκική θεραπεία δεν
φαίνεται να βελτιώνει την αυξημένη αντίσταση στην ινσουλίνη, ούτε τη δυσλιπιδαιμία
που συνοδεύουν το ΣΠΩ.(33) Aν και δεν υπάρχει προοπτική μελέτη που να συγκρίνει
τη διαθερμία και το λέιζερ στη λαπαροσκοπική ωοθηκική θεραπεία του ΣΠΩ, τα στοιχεία
από τις υπάρχουσες αναδρομικές μελέτες δείχνουν ότι η μονοπολική διαθερμία εμφανίζει
καλύτερα μετεγχειρητικά αποτελέσματα. Eκτός αυτού, η διαθερμία έχει το πλεονέκτημα
ότι είναι φθηνότερη και ευκολότερη στη χρήση.
ΠΛEONEKTHMATA THΣ ΛAΠAPOΣKOΠIKHΣ
ΩOΘHKIKHΣ ΘEPAΠEIAΣ ΓIA TO ΣΠΩ
H λαπαροσκοπική θεραπεία του ΣΠΩ είναι μια σχετικά απλή επέμβαση, η οποία μπορεί
να γίνει και κατά τη διάρκεια μιας διαγνωστικής λαπαροσκόπησης. Oι μετεγχειρητικές
συμφύσεις είναι λιγότερες σε σύγκριση με την κλασική σφηνοειδή εκτομή, αλλά
θα πρέπει να τονισθεί ότι η συχνότητα και η βαρύτητα των μετεγχειρητικών συμφύσεων
μπορεί να διαφέρει ανάλογα με τη μέθοδο της λαπαροσκοπικής ωοθηκικής θεραπείας.
Σε αντίθεση με την ωοθηκική διέγερση με γοναδοτροπίνες, δεν υπάρχει λόγος για
στενή παρακολούθηση της απάντησης των ωοθηκών, ούτε και κίνδυνος πολύδυμης κύησης
ή υπερδιέγερσης. Eπιπλέον, η μείωση της LH και των ανδρογόνων φαίνεται να σχετίζεται
με τη μείωση του ποσοστού αποβολών.
Eίναι γενικά αποδεκτό ότι η θεραπεία πρώτης γραμμής για την ανωοθυλακιορρηκτική
υπογονιμότητα σε γυναίκες με ΣΠΩ είναι η κλομιφένη. Mετά από θεραπεία με κλομιφένη,
στο 80% των γυναικών προκαλείται ωοθυλακιορρηξία, αλλά μόνο οι μισές από αυτές
τις γυναίκες μένουν έγκυες. Δηλαδή περίπου το 60% των γυναικών με ΣΠΩ που λαμβάνουν
κλομιφένη δεν επιτυγχάνουν εγκυμοσύνη. H αποτυχία ίσως οφείλεται και στις αντι-οιστρογονικές
ιδιότητες της κλομιφένης και σε αυτή την περίπτωση συνήθως συνιστάται ωοθηκική
διέγερση με γοναδοτροπίνες. H πιθανότητα εγκυμοσύνης σε κάθε κύκλο ωοθηκικής
διέγερσης με γοναδοτροπίνες δεν ξεπερνά το 20%, ενώ η αντίστοιχη πιθανότητα
για τον ίδιο πληθυσμό μετά από λαπαροσκοπική ωοθηκική διέγερση σε διάστημα 6
μηνών είναι περίπου 50%. Έχει υπολογισθεί ότι το μέσο κόστος της εγκυμοσύνης
μετά από διέγερση με γοναδοτροπίνες είναι διπλάσιο από το μέσο κόστος της εγκυμοσύνης
μετά από λαπαροσκοπική ωοθηκική διέγερση. H λαπαροσκοπική θεραπεία έχει το επιπλέον
πλεονέκτημα ότι αποκαθιστά τις φυσιολογικές αυτόματες ωοθυλακιορρηξίες, ενώ
δεν διαταράσσει την καθημερινή δραστηριότητα της γυναίκας απαιτώντας πολλαπλές
αιμοληψίες και υπερηχογραφήματα, ούτε χρειάζεται σπερματέγχυση ή εκλογή αυστηρά
προσδιορισμένου χρόνου σεξουαλικής επαφής.
Πολλές μελέτες έδειξαν ότι η λαπαροσκοπική ωοθηκική θεραπεία και η κλομιφένη
έχουν συνεργική δράση. Έτσι, γυναίκες με ΣΠΩ που δεν απαντούν στην κλομιφένη,
όταν υποστούν λαπαροσκοπική ωοθηκική διέγερση, αποκτούν ευαισθησία στο φάρμακο.
Eπίσης, έχει βρεθεί ότι η λαπαροσκοπική ωοθηκική διαθερμία ευαισθητοποιεί τις
ωοθήκες των γυναικών με ΣΠΩ στις γοναδοτροπίνες, και έτσι με τις ίδιες ή και
μικρότερες δόσεις αυξάνονται τα ποσοστά ωοθυλακιορρηξίας και εγκυμοσύνης. Πρόσφατα,
παρατηρήθηκε ότι όταν η λαπαροσκοπική ωοθηκική διαθερμία εφαρμόζεται πριν από
κύκλους εξωσωματικής γονιμοποίησης σε γυναίκες με ΣΠΩ, μειώνονται σημαντικά
οι πιθανότητες ακύρωσης των κύκλων λόγω της υπερδιέγερσης των ωοθηκών.(34) Γι'
αυτό, σε γυναίκες με ιστορικό υπερδιέγερσης των ωοθηκών, οι οποίες υπόκεινται
σε θεραπεία εξωσωματικής γονιμοποίησης, προτείνεται η εφαρμογή της λαπαροσκοπικής
ωοθηκικής θεραπείας ως τρόπος πρόληψης αυτής της ανεπιθύμητης επιπλοκής.(35)
Σε μία δε μελέτη(36) τα ποσοστά βιώσιμων εγκυμοσύνων σε γυναίκες με ΣΠΩ μετά
από εξωσωματική γονιμοποίηση ήταν 4πλάσια (28%), όταν είχε προηγηθεί λαπαροσκοπική
ωοθηκική διαθερμία, σε σύγκριση με τις γυναίκες οι οποίες δεν είχαν υποστεί
λαπαροσκοπική θεραπεία (7%). Aυτή η διαφορά αποδόθηκε στα σημαντικά αυξημένα
επίπεδα ανδρογόνων του ωοθυλακικού υγρού στις γυναίκες που δεν υπέστησαν λαπαροσκοπική
ωοθηκική θεραπεία.
EΠIΠΛOKEΣ
Kατά τη διάρκεια της επεμβάσεως είναι σπάνιες οι επιπλοκές. Bέβαια, μπορεί να
συμβούν επιπλοκές που να οφείλονται σε αυτήν καθεαυτή τη λαπαροσκοπική προσέγγιση.
Έχουν παρατηρηθεί απόσχιση του ωοθηκικού συνδέσμου από υπερβολική έλξη, αιμορραγία
από τις "οπές" που δημιουργούνται στην ωοθήκη και θερμική βλάβη των
παρακειμένων οργάνων.
Mετεγχειρητικά, όπως και μετά από κάθε επέμβαση, είναι δυνατόν να δημιουργηθούν
περιωοθηκικές συμφύσεις, οι οποίες θα μπορούσαν να επηρεάσουν τα ποσοστά εγκυμοσύνης
και να προκαλέσουν πυελικό άλγος.(37) Σε μελέτες στις οποίες ελέγχθηκαν οι μετεγχειρητικές
συμφύσεις μετά από λαπαροσκοπική ωοθηκική θεραπεία, τα ποσοστά παρουσίας συμφύσεων
κυμαίνονται από 0% έως 100%. Aυτό οφείλεται στο ότι: 1) σε μερικές αναδρομικές
μελέτες έγινε επιλεκτική λαπαροσκόπηση δεύτερης ματιάς, δηλαδή δεν εξετάσθηκαν
όλες οι γυναίκες που χειρουργήθηκαν, και 2) υπάρχει μεγάλη διαφορά στις διάφορες
τεχνικές που έχουν χρησιμοποιηθεί, και αντανακλούν σημαντικές διαφορές στην
έκταση της επιφανειακής ωοθηκικής βλάβης. H μέση συχνότητα εμφάνισης συμφύσεων
είναι ~ 28%, αλλά, εάν εξετασθούν μόνο οι μελέτες στις οποίες έγινε λαπαροσκόπηση
δεύτερης ματιάς σε όλες τις ασθενείς, τότε τα ποσοστά κυμαίνονται από 50% έως
100%. Σε δύο προοπτικές μελέτες στις οποίες οι ωοθήκες καλύφθηκαν με Interceed,
ο παράγων αυτός δεν φάνηκε να μειώνει τη συχνότητα και τη βαρύτητα των μετεγχειρητικών
συμφύσεων,(38,39) ενώ σε μία άλλη μελέτη η δημιουργία τεχνητού ασκίτη φάνηκε
να συνδέεται με μικρότερα ποσοστά συμφύσεων.(40) Ωστόσο, από τις υπάρχουσες
μελέτες η δημιουργία μετεγχειρητικών περιωοθηκικών συμφύσεων δεν φαίνεται να
συνδέεται με χαμηλότερα ποσοστά εγκυμοσύνης, αλλά και η συμφυσιόλυση κατά τη
λαπαροσκόπηση δεύτερης ματιάς δεν φαίνεται να αυξάνει τα ποσοστά εγκυμοσύνης.
Eξαιρετικά σπάνια έχει παρατηρηθεί ωοθηκική ατροφία μετεγχειρητικά, από το υπερβολικό
θερμικό ωοθηκικό τραύμα κατά τη διάρκεια της "ωοθηκικής διάτρησης"
ή από τον τραυματισμό του κρεμαστήρα της ωοθήκης που προκαλεί μείωση της ωοθηκικής
αιμάτωσης.(41) Eπίσης, η καταστροφή μεγάλου αριθμού ωοθυλακίων θα μπορούσε να
επηρεάσει τη μελλοντική αναπαραγωγική ικανότητα της γυναίκας, προκαλώντας πρόωρη
εμμηνόπαυση. Aπό την άλλη πλευρά, η μετεγχειρητική αποκατάσταση της ωοθυλακιορρηξίας
για μεγάλο χρονικό διάστημα σε γυναίκες με ΣΠΩ ενέχει τον θεωρητικό κίνδυνο
αύξησης του καρκίνου των ωοθηκών. Παρόλα αυτά, δεν υπάρχουν στοιχεία για την
πιθανή συσχέτιση της λαπαροσκοπικής θεραπείας του ΣΠΩ, ούτε της κλασικής σφηνοειδούς
εκτομής με τον καρκίνο των ωοθηκών. Tέλος, μία άλλη θεωρητική ανησυχία είναι
η πιθανή ανάπτυξη αντι-ωοθηκικών αντισωμάτων μετεγχειρητικά, αλλά ούτε και για
αυτή την επιπλοκή υπάρχουν βιβλιογραφικά στοιχεία.
MEΛΛONTIKEΣ EΞEΛIΞEIΣ
Aπό μελέτες με περιορισμένα περιστατικά, υπάρχουν ενδείξεις ότι η λαπαροσκοπική
ωοθηκική θεραπεία της μίας ωοθήκης μόνο θα μπορούσε να αποκαταστήσει την ωοθυλακιορρηξία
και στις δύο ωοθήκες, αλλά τα στοιχεία δεν είναι αρκετά για να συστήσει κανείς
αυτήν τη μέθοδο.(42) Eπίσης, έχει επιχειρηθεί διακολπική ωοθηκική θεραπεία υπό
υπερηχογραφικό έλεγχο σε περιορισμένο αριθμό γυναικών με ΣΠΩ, αλλά χρειάζονται
περισσότερες μελέτες για να εκτιμηθεί αυτή η μέθοδος.(43,44) Tέλος, έχει προταθεί
η λαπαροσκοπική ωοθηκική θεραπεία με λαπαροσκόπιο διαμέτρου 2 χιλιοστών (μίνι-λαπαροσκόπηση)
χωρίς γενική αναισθησία.(45) H ιδανική θεραπεία θα πρέπει να περιλαμβάνει μία
μοναδική "διάτρηση" της επιφάνειας της ωοθήκης, πιθανώς με μία βελόνη
πολλαπλής κατεύθυνσης, έτσι ώστε να ελαχιστοποιείται η πιθανότητα μετεγχειρητικών
περι-ωοθηκικών συμφύσεων. Ωστόσο, το ελάχιστο θερμικό ωοθηκικό τραύμα που επιφέρει
το επιδιωκόμενο ωοθυλακιορρηκτικό αποτέλεσμα δεν έχει ακόμα προσδιορισθεί.
Summary
Saravelos H.
Laparoscopic treatment of polycystic ovary syndrome.
Hellen Obstet Gynecol 14(4): 337-344, 2002
Polycystic ovary syndrome (POS) is characterized mainly by ovulatory alteration
and elevated plasma androgens. Laparoscopic approach for the treatment of this
syndrome comprises controlled mechanical injury of ovarian tissue of the anal
injury either with electrocantery or laser. Pregnancy rates after laparoscopic
approach ranges up to 56%, while complication rates are low. Recently, has been
reported in the literature the application of mini laparoscopy without anaesthesia,
while a future perspective consists a controlled puncture of the ovary for the
prevention of adhesion formation.
Key words:
Polycystic ovary syndrome, infertility, laparoscope.
BIBΛIOΓPAΦIA
1. Stein IF, Cohen MR. Surgical treatment of bilateral polycystic ovaries. Amenorrhoea
and sterility. Am J Obstet Gynecol 1945; 38:465-480.
2. Judd HL, Rigg LA, Anderson DC, Yen SC. The effects of ovarian wedge resection
on circulating gonadotrophin and ovarian steroid levels in patients with polycystic
ovarian syndrome. J Clin Endocrin Metab 1976; 43:347-355.
3. Katz M, Carr PJ, Cohen BM, Millar R. Hormonal effects of wedge resection
of polycystic ovaries. Obstet Gynecol 1978; 51:437-444.
4. Vejlsted H, Albrechtsen R. Biochemical and clinical effect of ovarian wedge
resection in the polycystic ovary syndrome. Obstet Gynecol 1976; 47:575-580.
5. Adashi EY, Rock JA, Guzick D, Colston Wentz A, Seegar Jones G, Jones HW.
Fertility following bilateral ovarian wedge resection: A critical analysis of
90 cases of the polycystic ovarian syndrome. Fertil Steril 1981; 36:320-325.
6. Palmer R, de Brux J. Resultats histologiques, biochemiques et therapeutiques
obtenus chez les femmes dont les ovaires avaient ete diagnostiques Stein-Leventhal
a la coelioscopie. Bull Fed Soc Gynecol Obstet Lang Fr 1967; 19:405-412.
7. Saravelos H, Li TC. Should we recommend multiple punch ovarian biopsy for
ovulation induction in women with polycystic ovarian syndrome? Gyn Endosc 1996;
5:61-62.
8. Aakvvaag A, Gjonnaess H. Hormonal response to electrocautery of the ovary
in patients with polycystic ovarian disease. Br J Obstet Gynaecol 1985; 92:1258-1264.
9. Greenblat E, Casper RF. Endocrine changes after laparoscopic ovarian cautery
in polycystic ovarian syndrome. Am J Obstet Gynecol 1987; 156:279-285.
10. Gjonnaess H, Norman N. Endocrine effects of the ovarian electrocautery in
patients with polycystic ovarian disease. Br J Obstet Gynaecol 1987; 94:779-783.
11. Sumioki H, Utsunomyiya T, Matsuoka K, Korenaga M, Kadota T. The effect of
laparoscopic multiple punch resection of the ovary on hypothalamo-pituitary
axis in polycystic ovary syndrome. Fertil Steril 1988; 50:567-572.
12. Kojima E, Yanagibori A, Otaka K, Hirakawa S. Ovarian wedge with contact
ND:YAG laser used laparoscopically. J Reprod Med 1989; 34:444-447.
13. Armar NA, McGarrigle HHM, Honour J, Holownia P, Jacobs HS, Lachelin GCL.
Laparoscopic ovarian diathermy in the management of anovulatory infertility
in women with polycystic ovaries: endocrine changes and clinical outcome. Fertil
Steril 1990; 53:45-49.
14. Abdel Gadir A, Khatim MS, Mowafi RS, Alnaser HM, Alzaid HGM, Shaw RW. Hormonal
changes in patients with polycystic ovarian disease after ovarian electrocautery
or pituitary desensitization. Clin Endocrin 1990; 32:749-754.
15. Sakata M, Tasaka K, Kurachi H, Terakawa N, Miyake A, Tanizawa O. Changes
in bioactive luteinizing hormone after laparoscopic ovarian cautery in patients
with polycystic ovarian syndrome. Fertil Steril 1990; 53:610-613.
16. Utsunomiya T, Sumioki H, Taniguchi I. Hormonal and clinical effects of multifollicular
puncture and resection on the ovaries of polycystic ovarian syndrome. Horm Res
1990; 33(suppl 2):35-39.
17. Kovacs G, Buckler H, Bangah M, et al. Treatment of anovulation due to polycystic
ovarian disease by laparoscopic ovarian electrocautery. Br J Obstet Gynaecol
1991; 98:30-35.
18. Rossmanith W, Keckstein J, Spatzier K, Lauritzen C. The impact of ovarian
laser surgery on the gonadotrophin secretion in women with polycystic ovarian
disease. Clin Endocrinol 1991; 34:223-230.
19. Abdel Gadir A, Khatim MS, Alnaser HMI, Mowafi RS, Shaw RW. Ovarian electrocautery:
responders versus non-responders. Gynecol Endocrinol 1993; 7:43-48.
20. Naether OGJ, Fischer R, Weise H, Geiger-Koetzler L, Delfs T. Laparoscopic
electrocoagulation of the ovarian surface in infertile patients with polycystic
ovarian disease. Fertil Steril 1993; 60:88-94.
21. Campo S, Felli A, Lamanna M, Barini A, Garcia N. Endocrine changes and clinical
outcome after laparoscopic ovarian resection in women with polycystic ovaries.
Hum Reprod 1993; 8:359-363.
22. Wu X, Sallinnen K, Zhou S, Su Y, Pollanen P, Erkola R. Androgen excess contributes
to altered growth hormone / insulin like growth factor-1 axis in non obese women
with polycystic ovarian syndrome. Fertil Steril 2000; 73(4):730-740.
23. Daniel JF, Miller W. Polycystic ovaries treated by laparoscopic laser vaporization.
Fertil Steril 1989; 51:232-236.
24. Keckstein J. Laparoscopic treatment of polycystic ovarian syndrome: In BailliereΥs
Clinical Obstetrics and Gynaecology, Laparoscopic surgery (Ed) C. Sutton, Bailliere
Tindall, London, 1990; 3:563-581.
25. Gurgan T, Urman B, Aksu T, Yarali H, Zeyneloglu HB, Kisnisci H. The effect
of short interval laparoscopic lysis of adhesions on pregnancy rates following
Nd:YAG laser photocoagulation of polycystic ovaries. Obstet Gynecol 1992; 80:45-47.
26. Armar NA, Lachelin GC. Laparoscopic ovarian diathermy: an effective treatment
for anti-estrogen resistant anovulatory infertility in women with polycystic
ovarian syndrome. Br J Obstet Gynaecol 1993; 100:161-164.
27. Gjonnaess H. Polycystic ovarian syndrome treated by ovarian electrocautery
through the laparoscope. Fertil Steril 1984; 41:20-25.
28. Heylen SM, Puttemans PJ, Brosens IA. Polycystic ovarian disease treated
by laparoscopic argon laser drilling; comparison of vaporization vs perforation
technique. Hum Reprod 1994; 9:1038-1042.
29. Naether OGJ, Baukloh V, Fischer R, Kowalczyk T. Long term follow up in 206
infertility patients with polycystic ovarian syndrome after laparoscopic electrocautery
of the ovarian surface. Hum Reprod 1994; 9:2342-2349.
30. Li TC, Saravelos HG, Chow MS, Chisabingo R, Cooke ID. Factors affecting
the outcome of laparoscopic ovarian thermal treatment for polycystic ovarian
syndrome in women with anovulatory infertility. Br J Obstet Gynaecol 1998; 105:338-344.
31. Felemban A, Tan SL, Tulandi T. Laparoscopic treatment of polycystic ovaries
with insulated needle cautery; a reappraisal. Fertil Steril 2000; 73(2):266-269.
32. Kriplani A, Manchanda R, Agarwal N, Nayar B. Laparoscopic ovarian drilling
in clomiphene resistant women with polycystic ovarian syndrome. J Am Assoc Gynec
Lapar 2001; 8(4):511-518.
33. Lemieux S, Lewis GF, Ben-Chetrit A. Correction of hyperandrogenemia by laparoscopic
ovarian cautery in women with polycystic ovarian syndrome is not accompanied
by improved insulin sensitivity or lipid-lipoprotein levels. J Clin Endocrinol
Metab 1999; 84:4278-4282.
34. Tojer AJ, Al Shawaf T, Zosmer A, et al. Does laparoscopic ovarian diathermy
affect the outcome of IVF-embryo transer in women with polycystic ovarian syndrome?
A retrospective comparative study. Hum Reprod 2001; 16(1):91-95.
35. Rimington MR, Walker SM, Shaw RW. The use of laparoscopic ovarian electrocautery
in preventing cancellation of IVF treatment cycles due to ovarian hyperstimulation
syndrome in women with polycystic ovaries. Hum Reprod 1997; 12:1443-1447.
36. Colacurzi M, Zullo F, De Francis P, Mollo A, DePlacido G. In vitro fertilization
following laparoscopic ovarian diathermy in patients with polycystic ovarian
syndrome. Acta Obstet Gynecol Scand 1997; 76:555-558.
37. Saravelos H, Li TC, Bontis J, Tarlatzis BC, Cooke ID. Laparoscopic management
of polycystic ovarian syndrome. Gynaec Endoscopy 1997; 6:331-340.
38. Saravelos H, Li TC. Post-operative adhesions after laparoscopic electrosurgical
treatment for polycystic ovarian syndrome with the application of Interceed
to one ovary. Hum Reprod 1996; 11:992-997.
39. Greenblatt EM, Casper RF. Adhesion formation after laparoscopic ovarian
cautery for polycystic ovarian syndrome: lack of correlation with pregnancy
rates. Fertil Steril 1993; 60:766-770.
40. Naether OGF. Significant reduction of adnexal adhesions following laparoscopic
electrocautery of the ovarian surface (LEOS) by lavage and artificial ascites.
Gynaec Endoscopy 1995; 4:17-19.
41. Dabirashrafi H. Complications of laparoscopic ovarian cauterization. Fertil
Steril 1989; 52:878-879.
42. Balen AH, Jacobs HS. A prospective study comparing unilateral and bilateral
laparoscopic ovarian diathermy in women with polycystic ovarian syndrome. Fertil
Steril 1994; 62:921-925.
43. Ferraretti AP, Gianaroli L, Magli MC, Iammarrone E, Feliciani E, Fortini
D. Transvaginal ovarian drilling: a new surgical treatment for improving the
clinical outcome of assisted reproductive technologies in patients with polycystic
ovarian syndrome. Fertil Steril 2001; 76(4):812-816.
44. Ramzy AM, Al Inany H, Aboulfoutouh I, Sataar M, Idrees OA, Shebata MH. Ultrasonographic
guided ovarian stroma hydrocoagulation for ovarian stimulation in polycystic
ovary syndrome. Acta Obstet Gynecol Scand 2001; 11:1046-1050.
45. Zullo F, Pellicano M, Zupi E, Guida M, Mastantonio P, Nappi C. Mini laparoscopic
ovarian drilling under local anaesthesia in patients with polycystic ovarian
syndrome. Fertil Steril 2000; 74(2): 376-379.