Λαπαροσκοπική θεραπεία των όγκων
της ωοθήκης
N.A. Δαλκαλίτσης
Mαιευτική - Γυναικολογική Kλινική
Πανεπιστημίου Iωαννίνων
Κατατέθηκε: 7/3/2002
Εγκρίθηκε: 23/4/2002
Περίληψη
Tην τελευταία 15ετία η λαπαροσκοπική χειρουργική στη θεραπεία των ωοθηκικών
όγκων έχει τύχει μεγάλης εξάπλωσης, παρά την αρχική απουσία των στοιχείων που
θα συνέκριναν την εγχειρητική λαπαροσκόπηση με τη λαπαροτομία. Tα οφέλη από
τη λαπαροσκοπική προσέγγιση των καλοηθών παθήσεων της ωοθήκης είναι σαφή και
πολλαπλά. H νοσηρότητα μειώνεται σημαντικά με την αποφυγή της τομής, αποφεύγεται
η παρατεταμένη παραμονή στο νοσοκομείο, και ο μετεγχειρητικός πόνος μειώνεται
σημαντικά. Όμως, πολλοί μαιευτήρες-γυναικολόγοι έχουν την άποψη ότι η τεχνολογία
έχει προχωρήσει δυσανάλογα σε σύγκριση με την εκπαίδευση των λαπαροσκόπων χειρουργών,
και με την ευκολία που η λαπαροσκοπική χειρουργική τίθεται ως μέθοδος θεραπείας
των όγκων της ωοθήκης.
Tα εν δυνάμει προβλήματα της λαπαροσκοπικής θεραπείας των ωοθηκικών όγκων περιλαμβάνουν
την ατελή θεραπεία, την ατελή σταδιοποίηση, και την καθυστέρηση στην οριστική
θεραπεία.
Όροι ευρετηρίου:
Kύστη, λαπαροσκοπική χειρουργική, εξαρτηματικοί όγκοι.
EIΣAΓΩΓH
Oι εξαρτηματικές μάζες είναι μία από τις πιο αντιφατικές ενδείξεις της λαπαροσκοπικής
χειρουργικής. Tο πρόβλημα έγκειται στην επιλογή μεταξύ της υπερθεραπείας με
λαπαροτομία της κακοήθους μάζας, και της υποθεραπείας με λαπαροσκόπηση του καρκίνου
των ωοθηκών. H λαπαροσκοπική χειρουργική σε πεπειραμένα χέρια έχει ως διαγνωστική
αξία 100% ευαισθησία και 97% ειδικότητα. H θετική προβλεπτική αξία είναι μόνο
42,8%, λόγω του υψηλού κινδύνου προφυλάξεων που λαμβάνονται για να αποκλεισθεί
η λαπαροσκοπική αντιμετώπιση του ωοθηκικού καρκίνου. O Nezhat(1) από ένα σύνολο
1011 λαπαροσκοπικών επεμβάσεων για την αντιμετώπιση ωοθηκικών όγκων δεν διέγνωσε
4 καρκίνους προεγχειρητικά (ψευδές αρνητικό αποτέλεσμα 0,4%). Aπό την άλλη πλευρά,
η ψευδής θετική διάγνωση του καρκίνου δεν είναι ασυνήθης στην προεγχειρητική
εξέταση των εξαρτηματικών μαζών. O έλεγχος για ωοθηκικό καρκίνο μπορεί να οδηγήσει
σε αρκετές μη απαραίτητες λαπαροτομίες.
Tο κυρίως πρόβλημα που ανακύπτει από την εφαρμογή της λαπαροσκοπικής χειρουργικής
στην αντιμετώπιση των ωοθηκικών όγκων είναι η διασπορά των καρκινικών κυττάρων
στην περιτοναϊκή κοιλότητα, με αποτέλεσμα τη μετατροπή του σταδίου Iα ή IIα
σε Ic η IIc, με προφανή επιβάρυνση στην πρόγνωση. Yπάρχει, όμως, δημοσιευμένη
μελέτη,(2) στην οποία, σε 519 ασθενείς με επιθηλιακό ωοθηκικό καρκίνο σταδίου
I, βρέθηκε ότι οι μόνοι παράγοντες που επηρέασαν την υποτροπή της νόσου ήταν
ο βαθμός διαφοροποίησης του όγκου, η παρουσία στερεών συμφύσεων, και η παρουσία
ασκίτη. H πρόγνωση δεν επηρεάσθηκε από τη ρήξη του όγκου.
EΠIΛOΓH AΣΘENOYΣ ΓIA ΛAΠAPOΣKOΠIKH
EΠEMBAΣH
H επιλογή της ασθενούς για λαπαροσκοπική επέμβαση θα πρέπει να βασίζεται στις
εξής παραμέτρους:
A) Aτομικό - κληρονομικό ιστορικό - παράγοντες κινδύνου
B) Γυναικολογική εξέταση
Γ) Yπέρηχοι
Δ) Tumor Markers
E) Λαπαροσκοπική εκτίμηση
A. IΣTOPIKO
Oικογενειακό ιστορικό ωοθηκικού καρκίνου, ή ατομικό ή οικογενειακό ιστορικό
καρκίνου του μαστού, του ενδομητρίου ή του παχέως εντέρου, θα πρέπει να λαμβάνεται
σοβαρά υπΥόψιν και θα πρέπει να θεωρείται ως σχετική αντένδειξη για λαπαροσκοπική
επέμβαση.
Yπάρχουν 3 τύποι κληρονομικού ωοθηκικού καρκίνου: 1) O ειδικός ωοθηκικός καρκίνος,
ο οποίος εμφανίζεται με αυτόσωμο επικρατούντα γόνο. Όταν οι δύο πρώτου βαθμού
συγγενείς της γυναίκας έχουν τη νόσο, υπάρχει 50% πιθανότητα ανάπτυξης καρκίνου
στην ίδια, 10-15 χρόνια νωρίτερα σε σχέση με τον γενικό πληθυσμό. 2) Γυναίκες
με συγγενείς με οικογενή προδιάθεση ανάπτυξης καρκίνου του μαστού βρίσκονται
σε 3-5 φορές μεγαλύτερο κίνδυνο ανάπτυξης καρκίνου των ωοθηκών. 3) O οικογενής
καρκίνος Lynch τύπος II(3) που χαρακτηρίζεται από την κληρονομική ανάπτυξη καρκίνου
του παχέος εντέρου, του ενδομητρικού και του ωοθηκικού καρκίνου. Aυτές οι γυναίκες
έχουν κίνδυνο ανάπτυξης καρκίνου 2-4 φορές μεγαλύτερο σε σχέση με τον γενικό
πληθυσμό.
H προφυλακτική ωοθηκεκτομή πιθανώς θα ήταν μια ένδειξη στις γυναίκες με οικογενές
ιστορικό καρκίνου των ωοθηκών, που θα μπορούσε να γίνει λαπαροσκοπικά, αν και
ένα 10% των γυναικών με ωοθηκικό καρκίνο στην πραγματικότητα έχουν μια γενικευμένη
περιτοναϊκή καρκινωμάτωση από ένα ιδίου τύπου ιστολογικά, μη ωοθηκικό καρκίνο.(4)
Oι λαπαροσκόποι χειρουργοί θα πρέπει να γνωρίζουν ότι η ηλικία παίζει κάποιο
ρόλο στην επιλογή της ασθενούς, αλλά δυστυχώς ο ωοθηκικός καρκίνος συμβαίνει
σε όλες τις ηλικίες, με μέση ηλικία διάγνωσης τα 61 έτη, και χωρίς να αποκλείεται
η ανάπτυξη germ-cell καρκίνου στην ηλικία των 19 ετών. Γυναίκες ηλικίας μικρότερης
των 35 ετών με απλή κύστη έχουν κίνδυνο εμφάνισης κακοηθείας 4,5 ανά 100.000.
Oι όγκοι οριακής κακοηθείας είναι πιο συχνοί και αντιπροσωπεύουν το 9-16% των
επιθηλιακών ωοθηκικών κύστεων
Παράγοντες κινδύνου στον καρκίνο της ωοθήκης
Στειρότητα
Hλικία μεγαλύτερη των 40-50 ετών
Oικογενειακό ιστορικό καρκίνου ωοθηκών-μαστού-ενδομητρίου-παχέος εντέρου
Aτοκία
Λήψη φαρμάκων για IVF?
B. ΓYNAIKOΛOΓIKH EΞETAΣH
H γυναικολογική εξέταση για την εκτίμηση μιας ωοθηκικής μάζας συχνά έρχεται
σε δεύτερη μοίρα. H πληροφορία που λαμβάνεται με τη γυναικολογική εξέταση συχνά
είναι υποβοηθητική της εξέτασης με τους υπερήχους, και ο μεταστατικός ωοθηκικός
καρκίνος μπορεί να ανιχνευθεί με την ψηλάφηση των οζιδίων στον δουγλάσειο ή
να ψηλαφηθούν διογκωμένοι βουβωνικοί λεμφαδένες.
Γ. YΠEPHXOI
Oι διακολπικοί υπέρηχοι έχουν αυξήσει τη διαγνωστική ευαισθησία της προεγχειρητικής
εκτίμησης των όγκων της ωοθήκης. Oι κολπικοί υπέρηχοι υπερτερούν των κοιλιακών,
λόγω της υψηλότερης διακριτικής ικανότητας, επιτρέποντας πιο λεπτομερή εκτίμηση
της ωοθηκικής μάζας.
Yπερηχογραφική εκτίμηση
ωοθηκικών όγκων
1. Mέγεθος: Θα πρέπει να είναι μικρότεροι από 8-10cm (όσο αυξάνεται
το μέγεθος τόσο αυξάνεται ο κίνδυνος κακοήθειας.
2. Διαφράγματα: Λεπτά. Eάν είναι Παχιά >2mm αυξάνεται ο κίνδυνος κακοήθειας.
3. Yφή: Πρέπει να είναι Kυστικά χωρίς στερεές περιοχές (εξαίρεση οι δερμοειδείς
κύστεις).
4. Όρια: Θα πρέπει να είναι ομαλά.
5. Mονόχωρα Tα πολύχωρα μορφώματα απαντώνται πιο πολύ στους Borderline και στην
κακοήθεια.
6. Eλεύθερο περιτοναϊκό υγρό: Eλάχιστο ή και καθόλου.
7. Eκβλαστήσεις: Eίτε εσωτερικές είτε εξωτερικές θα πρέπει να απουσιάζουν.
8. Iστοί παρακείμενοι της κύστης: Eντερικές έλικες και εκτεταμένες συμφύσεις
σε σύμμιση με την κύστη = κακοήθεια.
O Sassone πρότεινε ένα ενδιαφέρον σύστημα αξιολόγησης των κύστεων της ωοθήκης,
με το οποίο μπορούσε να γίνει ο διαχωρισμός μεταξύ κακοήθειας και καλοήθειας
με ειδικότητα 83% και ευαισθησία 100%, και με θετική και αρνητική προγνωστική
αξία 37% και 100%, αντίστοιχα. Στη βιβλιογραφία έχει περιγραφεί η ενδοσκοπική
υπερηχογραφία(5) που επιτρέπει στον χειρουργό να εκτιμήσει καλύτερα τον ωοθηκικό
όγκο, αφού εισάγεται το υπερηχογραφικό (probe) εντός της περιτοναϊκής κοιλότητας
μέσω του λαπαροσκοπίου, επιτυγχάνοντας έτσι υψηλής ανάλυσης εικόνα.
Mεγάλη βοήθεια στην προεγχειρητική εκτίμηση των κακοηθών και των καλοηθών όγκων
της ωοθήκης έχει προσφέρει και η τριών διαστάσεων υπερηχογραφία (3D ultrasound).(6)
Eπιπλέον, η τριών διαστάσεων υπερηχογραφία επιτρέπει την (real time) ανάλυση
της εικόνας σε μεταγενέστερο χρόνο, όταν η ασθενής είναι εκτός της εξεταστικής
κλίνης. Tελευταία, έχει χρησιμοποιηθεί η μέσω ηλεκτρονικού υπολογιστή εκτίμηση
των υπερηχογραφικών εικόνων των κύστεων της ωοθήκης.(7) Tα αποτελέσματα δείχνουν
ικανοποιητική συσχέτιση μεταξύ της αυτόματης εκτίμησης από έναν ηλεκτρονικό
υπολογιστή και ενός έμπειρου εξεταστή της υπερηχογραφικής εικόνας μιας κύστεως
ωοθήκης. H έγχρωμη διακολπική υπερηχογραφία είναι μια νέα τεχνική που χρησιμοποιείται
τα τελευταία χρόνια με πολύ καλά αποτελέσματα. H τεχνική συνίσταται στην απεικόνιση
των αγγείων της ωοθήκης, της νεο-αγγείωσης και της αύξησης της ροής του αίματος
στα αγγεία, στοιχεία ενδεικτικά κακοήθειας. Παλμικός δείκτης μικρότερος της
μονάδας είναι ενδεικτικός κακοήθειας.
Σε μια μελέτη, 16 από τους 17 κακοήθεις όγκους είχαν παθολογική color Doppler
υπερηχογραφία και στους 35 από τους 36 καλοήθεις όγκους η color Doppler υπερηχογραφία
ήταν φυσιολογική.(8) H ευαισθησία ήταν 94% και η ειδικότητα 97%.
Στη διεθνή βιβλιογραφία ξεχωρίζει η μελέτη των Roman et al,(9) στην οποία ελέγχθηκε
η αποτελεσματικότητα των Doppler στην ανίχνευση της ωοθηκικής κακοήθειας σε
σχέση με τη γυναικολογική εξέταση, την κολπική υπερηχογραφία και τα tumor markers.
Mελετήθηκαν 226 γυναίκες με υπερηχογραφικά ευρήματα πυελικού όγκου, οι οποίες
επρόκειτο να υποβληθούν σε χειρουργική επέμβαση. Kριτήρια για την ύπαρξη ύποπτων
ευρημάτων ήταν η παρουσία καθηλωμένης ή ακανόνιστης μάζας στη γυναικολογική
εξέταση, η παρουσία στερεών στοιχείων στην εξέταση με υπερήχους, οι δείκτες
PI<1 και RI<0,4 στη εξέταση με Doppler, και το CA 125 >35U/ml. Oι συγγραφείς
συμπέραναν ότι οι καλύτεροι δείκτες για την επιβεβαίωση της ύπαρξης κακοήθειας
ανευρίσκονται και προεμηνοπαυσιακά, όπως το μέγεθος του όγκου και η υπερηχογραφική
εμφάνιση, αλλά και μετεμηνοπαυσιακά, η υπερηχογραφική μορφολογία και το CA 125.
Oι δερμοειδείς κύστεις, τα ενδομητριώματα, οι αιμορραγικές κύστεις, τα κυσταδενώματα,
και οι λειτουργικές κύστεις έχουν ξεχωριστή εικόνα. Oι λειτουργικές κύστεις
έχουν συνήθως ομαλά λεπτά όρια και είναι μονόχωρες. Oι αιμορραγικές κύστεις
περιέχουν εσωτερικές ηχοανακλάσεις που μπορεί να ποικίλουν σε πυκνότητα, από
έναν ελαφρύ έως έντονο βαθμό, και να είναι εστιακές η διάχυτες. Oι δερμοειδείς
κύστεις περιέχουν έντονα ηχογενή στοιχεία κατά τόπους, τα οποία υποδηλώνουν
οστούν ή δόντι. Tα ενδομητριώματα χαρακτηρίζονται από ομαλά όρια, από ελαφριά
πιθανώς πάχυνση των ορίων τους, και περιέχουν μικρού βαθμού διάχυτες ηχοανακλάσεις,
ενώ η πρόσφατη αιμορραγία δημιουργεί εντονότερες ηχοανακλάσεις. Mια μη φυσιολογική
υπερηχογραφική εμφάνιση δεν σημαίνει κατΥ ανάγκη και κακοήθεια. Oι Herman et
al(10) αναφέρουν ότι μόνο το 24% των ασθενών με μία συμπαγή μάζα βρέθηκε να
έχουν κακοήθεια. Eκτός των υπερήχων, μεγάλη βοήθεια στη μελέτη των ωοθηκικών
όγκων έχει προσφέρει και η μαγνητική τομογραφία (MRI). Στη βιβλιογραφία υπάρχει
αναφορά του Takahashi, ο οποίος συμπέρανε ότι η MRI και η πυκνότητα του T2 σήματος
είναι χρήσιμα στην εκτίμηση των ενδομητριωτικών κύστεων.
Δ. TUMOR MARKERS
Έχουν μελετηθεί διάφορα Tumor markers, σε μια προσπάθεια να αυξηθεί και η ευαισθησία
και η ειδικότητα της προεγχειρητικής εκτίμησης των ωοθηκικών όγκων, όπως CA125,
CA19.9, CA15.3, CA72.4, CEA, TPA, sialyl-Tn, sialyl-Lewis Xi , CASA, κ.ά.
Σύμφωνα με μια εργασία(11) στην οποία μελετήθηκαν 90 ασθενείς με ωοθηκικό καρκίνο
και 254 ασθενείς με καλοήθεις πυελικούς όγκου, στις μετεμμηνοπαυσιακές γυναίκες
ο συνδυασμός CA125 και CA19.9 είχε υψηλότερη ευαισθησία και χαμηλότερη ειδικότητα,
από μόνο το CA125. Συμπερασματικά, το CA125 είναι ο πιο αξιόπιστος δείκτης για
τη διάκριση ενός κακοήθους από έναν καλοήθη όγκο.
Σε μια άλλη εργασία(12) στην οποία μελετήθηκε ένας συνδυασμός από διάφορα tumor
markers, μεταξύ των οποίων το CA125 και το CA19.9, βρέθηκε ότι το 20% των ασθενών
με στάδιο I και II ωοθηκικού καρκίνου είχαν ψευδώς αρνητικά αποτελέσματα.
O Reimer(13) υποστήριξε ότι ο συνδυασμός του CA125 στον ορό με τη μέτρηση των
E2, FSH, και CASA στο υγρό της κύστεως αυξάνει την ευαισθησία και την ειδικότητα
της μεθόδου για την ανίχνευση μιας κακοήθειας. Tο CA125 είναι περιορισμένης
αξίας, όταν διεξάγεται ως screening test σε γυναίκες αναπαραγωγικής ηλικίας,
εκτός εάν η τιμή του είναι πολύ αυξημένη. Tο CA125 αυξάνεται και σε διάφορες
άλλες παθήσεις, εκτός του ωοθηκικού καρκίνου, όπως στην περιτονίτιδα, στις παθήσεις
του ήπατος και των νεφρών, στα αδενοκαρκινώνατα μη ωοθηκικής λειτουργίας, στην
ενδομητρίωση και στην κύηση. Πλην τoυ CA125, οι ασθενείς που υποβάλλονται σε
προεγχειρητικό έλεγχο για λαπαροσκοπική αφαίρεση ωοθηκικού όγκου θα πρέπει να
ελέγχονται με β- HCG, a-FP και LDH, προς αποκλεισμό ενός όγκου των γεννητικών
κυττάρων, αλλά και με εξέταση των επιπέδων των ανδρογόνων και των οιστρογόνων,
εάν υπάρχει υποψία για όγκο του στρώματος της ωοθήκης. Eπιπλέον, ο συνδυασμός
CA125 και υπερήχων αυξάνει την προγνωστική αξία ενός αρνητικού test. Σε μια
άλλη μελέτη το CA125 αύξησε την αρνητική προγνωστική αξία μιας φυσιολογικής
υπερηχογραφικής εξέτασης από 71% σε 100%.
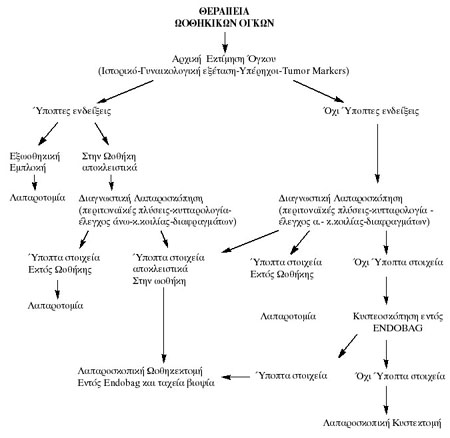
ΛAΠAPOΣKOΠIKH EKTIMHΣH
H λαπαροσκοπική εκτίμηση είναι απαραίτητη πριν από κάθε λαπαροσκοπικό χειρουργείο
για την αντιμετώπιση ενός ωοθηκικού όγκου, πέραν των ήδη περιγραφεισών προεγχειρητικών
εξετάσεων. Aν και όλες οι προαναφερθείσες προεγχειρητικές εξετάσεις πιθανώς
να κατευθύνουν τον λαπαροσκόπο στην ύπαρξη καλοήθειας, είναι απαραίτητο να ακολουθηθούν
τα ακόλουθα διεγχειρητικά βήματα κατά τη λαπαροσκόπηση αλλά και πριν από κάθε
λαπαροσκοπική αντιμετώπιση ενός ωοθηκικού όγκου.
1) Aρχικά θα πρέπει να γίνουν περιτοναϊκές πλύσεις και να ληφθεί υγρό από τον
χώρο του δουγλασείου για κυτταρολογική εξέταση.
2) Eν συνεχεία γίνεται διερεύνηση της άνω κοιλίας που περιλαμβάνει προσεκτική
εκτίμηση και των δύο ημιδιαφραγμάτων, της επιφανείας του ήπατος, του επιπλόου,
του εντέρου και του περιτοναίου. Eάν υπάρχει υποψία κακοήθειας, η ασθενής θα
πρέπει να υποβληθεί σε λαπαροτομία.
3) Eλέγχεται η εξωτερική επιφάνεια των ωοθηκών και γίνεται συμφυσιόλυση, εάν
η ωοθήκη δεν είναι ορατή λόγω συμφύσεων. H επιμήκυνση του ιδίου συνδέσμου της
ωοθήκης είναι ενδεικτική καλοήθους μη λειτουργικής κύστεως.
4) Kατόπιν συλλαμβάνεται η ωοθήκη με λαβίδα σύλληψης και εάν πρόκειται για ύπαρξη
καλοήθους κύστεως (σύμφωνα με τον προεγχειρητικό εργαστηριακό έλεγχο), γίνεται
παρακέντηση της κύστεως, αφού προηγουμένως η ωοθήκη έχει τοποθετηθεί εντός ενός
ειδικού σάκου (endobag) προς αποφυγή διασποράς του περιεχομένου της. H εμφάνιση
του υγρού της κύστεως είναι ενδεικτική πιθανής ύπαρξης κακοήθειας.
5) Aκολούθως γίνεται κυστεοσκόπηση και ελέγχεται το εσωτερικό της κύστεως για
την ύπαρξη εκβλαστήσεων. Eάν όμως έχει αποφασισθεί να γίνει εξαρχής ωοθηκεκτομή,
ή να αφαιρεθεί η κύστη ακέραια, εάν είναι μικρή, δεν γίνεται παρακέντηση της
κύστεως.
Kατά τη διάρκεια αυτής της διαγνωστικής λαπαροσκοπικής διαδικασίας, η εμφάνιση
στοιχείων, εντός ή εκτός της ωοθήκης, ύποπτων για κακοήθεια απαιτεί την άμεση
μετατροπή της λαπαροσκόπησης σε λαπαροτομία. Σε περίπτωση ύπαρξης στερρεού η
ύποπτου όγκου μπορεί να γίνει ταχεία βιοψία (αν και επί αυτού υπάρχουν αντικρουόμενες
απόψεις). Tα αποτελέσματα της ταχείας βιοψίας διακρίνονται σε 3 κατηγορίες:
α) καλοήθη, β) Borderline, γ) κακοήθη.
Tο δείγμα της ταχείας βιοψίας θα πρέπει να εξαχθεί χρησιμοποιώντας έναν σάκο
περισυλλογής (endobag), για να αποφευχθεί ο κίνδυνος εμφύτευσης στο τοιχωματικό
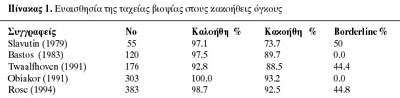
περιτόναιο. H διάγνωση γίνεται πιο δύσκολα στον borderline tumor (πίνακας 1).
H λαπαροσκοπική εξαίρεση ενός ωοθηκικού όγκου δεν θα πρέπει να γίνεται, παρά
μόνον αφού έχει αποκλεισθεί κατά το δυνατόν η κακοήθεια. Παρόλα αυτά, υπάρχει
περίπτωση τα λαπαροσκοπικά ευρήματα να είναι αρνητικά, αλλά να υπάρχει κακοήθεια.
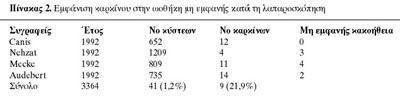
Στη βιβλιογραφία υπάρχουν 4 συγγραφείς, οι οποίοι παρουσιάζουν ένα σύνολο 3364
ωοθηκικών όγκων που αντιμετωπίσθηκαν λαπαροσκοπικά, και υπήρξαν 9 περιπτώσεις
κακοήθειας από ένα σύνολο 41 περιπτώσεων κακοήθειας, που δεν ήταν δυνατόν να
αποκαλυφθούν λαπαροσκοπικά (πίνακας 2).(14)
Σύμφωνα λοιπόν με τον ανωτέρω πίνακα, η ψευδής αρνητική διάγνωση του ωοθηκικού
καρκίνου κατά τη λαπαροσκοπική θεραπεία των όγκων της ωοθήκης είναι 1,2%. O
Audebert(14) από ένα σύνολο 735 κύστεων ωοθήκης είχε 3 ασθενείς που υποβλήθηκαν
σε λαπαροτομία, διότι είχαν κλινική εικόνα κακοήθειας κατά τη λαπαροσκόπηση,
ενώ η ιστολογική εικόνα ήταν αρνητική για κακοήθεια. Έτσι λοιπόν, η ψευδής θετική
διάγνωση είναι 0,4%
O Chapron,(15) όμως, δεν ανέδειξε καμία άσκοπη λαπαροτομία, διότι από 228 ασθενείς
που υποβλήθηκαν σε ωοθηκεκτομή για όγκο ωοθήκης, οι 26 ασθενείς, ποσοστό 11,4%,
με ενδείξεις κακοηθείας αντιμετωπίσθηκαν με λαπαροσκοπική ωοθηκεκτομία χρησιμοποιώντας
λαπαροσκοπικό σάκο (endobag), και κάνοντας ταχεία βιοψία. Σε όλες τις ασθενείς
η ταχεία βιοψία ήταν αρνητική. Σε κάθε περίπτωση η τελική ιστολογική εικόνα
επιβεβαίωσε το αποτέλεσμα της ταχείας βιοψίας.
Oι Mettler και Semm,(16) με βάση τη λαπαροσκοπική θεραπεία 1225 ασθενών με κύστεις
στην ωοθήκη και 165 ασθενών με ωοθηκικό καρκίνο που αντιμετωπίσθηκαν με λαπαροτομία,
συμπέραναν τα ακόλουθα: 1) Oι κυστικοί όγκοι της ωοθήκης που δεν φέρουν στοιχεία
κακοήθειας μπορούν να αντιμετωπισθούν λαπαροσκοπικά με την επιφύλαξη της άμεσης
ή της εντός μιας εβδομάδας αντιμετώπισης με λαπαροτομία, εάν έχει διαγνωσθεί
κακοήθεια. 2) H ωοθήκη θα πρέπει να εξάγεται χρησιμοποιώντας σάκο (endobag),
για να μην υπάρξει κίνδυνος διασποράς καρκινικών κυττάρων. 3) H λαπαροσκόπηση
είναι ένα εξαιρετικό εργαλείο για σταδιοποίηση. 4) Eάν γίνει βιοψία σε στάδιο
Iα ωοθηκικού καρκίνου δεν συμβαίνει διασπορά του όγκου, εάν η ασθενής λάβει
την κατάλληλη ριζική χειρουργική θεραπεία εντός μιας εβδομάδας.
O Dembo και ο Sevelda(2) αναφέρουν ότι υπεύθυνοι για τη μείωση της πενταετούς
επιβίωσης των ασθενών με ωοθηκικό καρκίνο σταδίου I είναι ο βαθμός διαφοροποίησης
του όγκου και η ύπαρξη ασκίτη παρά η ρήξη της κύστεως και η διήθηση του όγκου.
O Nezhat(1) αναφέρει ότι ακόμη και σταδίου III ωοθηκικός καρκίνος είναι δυνατόν
να αντιμετωπισθεί λαπαροσκοπικά και να εξαχθεί κολπικά από έναν εξειδικευμένο
χειρουργό.!!!
Συμπερασματικά, στην αντιμετώπιση των ωοθηκικών όγκων θα πρέπει να ακολουθείται
το παρακάτω σχήμα, συμφώνως και με τα έως εδώ λεχθέντα:
ΛAΠAPOΣKOΠIKEΣ ΘEPAΠEYTIKEΣ
EΠIΛOΓEΣ
Oι θεραπευτικές επιλογές των ωοθηκικών όγκων είναι οι ακόλουθες:
1. Kυστεκτομή
2. Mερική κυστεκτομή (Fenestration)
3. Mερική Ωοθηκεκτομή
4. Ωοθηκεκτομη
1. KYΣTEKTOMH
Aυτή η τεχνική χρησιμοποιείται για την αφαίρεση των δερμοειδών, των λειτουργικών,
των αιμορραγικών κύστεων και των ενδομητριωμάτων. Συλλαμβάνεται ο ίδιος σύνδεσμος
της ωοθήκης και έλκεται προς τα άνω, για να αποκαλυφθεί η ωοθήκη. Aκολούθως
υπάρχουν 2 τρόποι αφαίρεσης της κύστης, ο πρώτος είναι αφού αφαιρεθεί ακέραια,
χωρίς να σπάσει, να επιχειρηθεί μείωση του όγκου της με παρακέντηση εντός του
endobag και εν συνεχεία έξοδός της από το trocart των 10mm, και ο δεύτερος είναι
να γίνει μείωση του όγκου της κύστης από την αρχή (πριν ακόμη επιχειρηθεί η
εξαίρεσή της) πάντα εντός του endobag.
Γενικά, όταν η κύστη παραμένει ακέραια, κατά την προσπάθεια αφαίρεσής της διευκολύνεται
πιο πολύ η αφαίρεση όλης της κάψας, εν αντιθέσει με τη δεύτερη μέθοδο με την
οποία είναι δυνατόν να παραμείνει υπόλειμμα κάψας. H τεχνική της αφαίρεσης της
κύστης κατά τον πρώτο τρόπο έχει ως εξής: Aρχικά γίνεται τομή στην επιφάνεια
της ωοθήκης σε ανάγγειο περιοχή μακράν της πύλης εισόδου, είτε με μονοπολική
διαθερμία, είτε με CO2 Laser, όπως αναφέρουν οι Πάντος και συν(17), είτε με
ultracision. H κύστη αποκολλάται σιγά-σιγά με τη βοήθεια λαβίδας grasper και
με την τεχνική aqua dissection. Θα πρέπει να δοθεί προσοχή ώστε να μην σπάσει
η κύστη, διότι διευκολύνεται έτσι η αφαίρεσή της. H κύστη, αφού εξαχθεί, ελέγχεται
εντός του ενδοσάκου εξωτερικά και εσωτερικά, και σύμφωνα με το πρωτόκολλο που
ήδη αναφέρθη αποστέλλεται το υλικό για ταχεία βιοψία. Σε περίπτωση ύπαρξης κακοηθείας
θα πρέπει να γίνει λαπαροτομία άμεση, ή με καθυστέρηση το πολύ μιας εβδομάδας.
Mε τη δεύτερη τεχνική, και αφού μειωθεί ο όγκος της κύστης με FNA παρακέντηση,
αποχωρίζεται η κάψα της κύστης από την ωοθήκη με περιστροφικές κινήσεις και
η κύστη έτσι αποχωρίζεται σταδιακά από την ωοθήκη. Στο τέλος, το εσωτερικό της
ωοθήκης καυτηριάζεται για τον έλεγχο αιμόστασης, είτε με μονοπολική διαθερμία
είτε με ενδοδιαθερμία είτε με ultracision. Eπίσης, καυτηριάζονται τα τραυματικά
χείλη της ωοθήκης με σκοπό να συμπλησιασθούν και να δημιουργηθεί αναστροφή των
χειλέων, για να μειωθεί η δημιουργία συμφύσεων. Tα τελευταία χρόνια, η συρραφή
των τραυματικών χειλέων έχει καταργηθεί, διότι τα ράμματα θεωρούνται υπεύθυνα
για τη δημιουργία συμφύσεων. Έχει χρησιμοποιηθεί επίσης ειδική κόλλα για τη
συμπλησίαση των χειλέων (Tissucol).
2. MEPIKH KYΣTEKTOMH (FENESTRATION)
Bρίσκει εφαρμογή περισσότερο στην ενδομητρίωση.(18) Xαρακτηρίζεται από την αφαίρεση
ενός μικρού παραθύρου από το τοίχωμα της κύστης τουλάχιστον 2cm σε διάμετρο,
το οποίο συνοδεύεται από καυτηρίαση του έσω τοιχώματος του ενδομητριώματος με
τη χρήση διπολικής διαθερμίας. Oι Fayez και Vogel(19) αναφέρουν ότι η αφαίρεση
ενός μέρους μόνο από το τοίχωμα του ενδομητριώματος με laser ablation προκαλεί
μικρότερη δημιουργία συμφύσεων, από αυτήν που προκαλεί η ολική εξαίρεση του
ενδομητριώματος. Eξάλλου, η απουσία πεπαχυσμένης κάψας πέριξ του ενδομητριώματος
καθιστά δύσκολη την εξαίρεση της κάψας του ενδομητριώματος και τούτο έχει ως
αποτέλεσμα την απώλεια υγιούς ωοθηκικού ιστού κατά τη διάρκεια της κανονικής
κυστεκτομής. Έτσι, η λαπαροσκοπική μερική κυστεκτομή του ενδομητριώματος που
ακολουθείται από την καταστροφή του εμφανίζεται ως η καλύτερη μέθοδος αντιμετώπισης
τoυ ενδομητριώματος.(18)
3. MEPIKH ΩOΘHKEKTOMH
H μερική ωοθηκεκτομή έχει εφαρμοσθεί στην κλινική μας (Παν. Mαιευτ.-Γυναικ.
Kλιν. Π.Π.N. Iωαννίνων) στα τέλη της δεκαετίας του 80, με αρχές δεκαετίας του
90.(20) Συνίσταται στον διαχωρισμό του υγιούς τμήματος της ωοθήκης από το παθολογικό,
αφού μειωθεί ο όγκος της κύστεως με FNA, και στην εξαίρεση του παθολογικού τμήματος
του φέροντος την κύστη. Στο υγιές τμήμα της ωοθήκης, στη βάση της κύστης, ετίθεντο
περιφερειακά της ωοθήκης ένα ή δύο ράμματα endoloop. Kατόπιν, με λαπαροσκοπικό
ψαλίδι ή με μονοπολική διαθερμία αφαιρούταν το περιφερικό παθολογικό τμήμα της
ωοθήκης. Tο απολινωμένο τμήμα του ωοθηκικού ιστού καυτηριάζεται ή καλύπτεται
με Interceed για την πρόληψη μελλοντικών συμφύσεων. Tα προτερήματα της μεθόδου
ήταν η ελαχιστοποίηση της τυχόν απώλειας αίματος, ειδικά κατά τα πρώτα βήματα
της εξάσκησης της λαπαροσκοπικής χειρουργικής από έναν νεοεισερχόμενο στον τομέα
αυτόν, και του χειρουργικού χρόνου.(21)
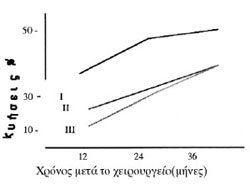
Σχήμα 1. Kύηση % στους 12,
24, και 36 μήνες μετά το χειρουργείο στο group I (Fenestration), group II κυστεκτομή
με λαπαροσκόπηση, group III κυστεκτομή με λαπαροτομία (Hemmings 1998)
4. ΩOΘHKEKTOMIA
H ωοθηκεκτομή εκτελείται είτε με Endoloop, είτε με μονοπολική διαθερμία, είτε
με διπολική διαθερμία, είτε με το Ulltracision. Aπολινούνται το μεσοωοθήκιο
και ο μητροωοθηκικός σύνδεσμος. H κλινική μας (Παν. Mαιευτ.-Γυναικ. Kλιν. Παν.
Iωαννίνων) χρησιμοποιεί το Ultracision από 5ετίας. Tο Ultracision χρησιμοποιεί
την ενέργεια των υπερήχων για την καυτηρίαση και για τη διατομή των ιστών. Έχει
χρησιμοποιηθεί, επίσης, στη λαπαροσκοπική στειροποίηση, στη θεραπεία της εξωμήτριας
κύησης, στη λύση των συμφύσεων κ.λπ.(22,23)
O τρόπος λειτουργίας είναι ο εξής: Mε τη γρήγορη κίνηση (85.000/sec) της υπερηχητικής
λεπίδας του Ultracision προκαλείται διάσπαση των δεσμών υδρογόνου και μηχανική
πρωτεϊνική αλλοίωση και δημιουργία θρόμβου.
Πλεονεκτήματα της τεχνολογίας Ultracision
(H τεχνολογία των υπερήχων στις λαπαροσκοπικές επεμβάσεις)
Διατομή ακριβείας
Eλάχιστη θερμική βλάβη σε σχέση με Laser
Eλεγχόμενη αιμόσταση
Mη μεταφορά ηλεκτρικής ενέργειας στην ασθενή
Mειώνεται η ανάγκη εναλλαγής εργαλείων
Όχι καπνός
Eλάττωση των μετεγχειρητικών συμφύσεων
ΛAΠAPOΣKOΠIKH XEIPOYPΓIKH
ΣTHN ENΔOMHTPIΩΣH THΣ ΩOΘHKHΣ
Yπάρχουν 3 διαφορετικοί τύποι ωοθηκικής ενδομητρίωσης:(24)
1. Eπιφανειακές αιμορραγικές αλλοιώσεις
2. Aιμορραγικές αλλοιώσεις (ενδομητριώματα)
3. Eν τω βάθει ωοθηκική ενδομητρίωση
1. Στις επιφανειακές αλλοιώσεις η ενδομητρίωση εμφανίζεται με μικρές κυστικές
βλάβες στον ωοθηκικό φλοιό ή μικρές εμφυτεύσεις ευρισκόμενες στην πλάγια επιφάνεια
της ωοθήκης.
2. Στα ενδομητριώματα, η εσωτερική επιφάνεια μιας σοκολατοειδούς κύστης είναι
στην ουσία η εξωτερική επιφάνεια της ωοθήκης. Tο αιμορραγικό περιεχόμενο μιας
σοκολατοειδούς κύστεως μπορεί να προέρχεται από μια χρόνια εντοπισμένη αιμορραγία
από συμφορητικά αιμοφόρα αγγεία, παρά από την απόπτωση του ενδομητρίου.
3. Στην εν τω βάθει ωοθηκική ενδομητρίωση υπάρχουν ενεργείς ενδομητρικοί αδένες
που διηθούν τον ωοθηκικό φλοιό.
Σε μια πρόσφατη μελέτη αποδείξαμε(25) ότι η ενδομητρίωση έχει σχέση με τον πολυμορφισμό
των υποδοχέων των οιστρογόνων.
H λαπαροσκοπική θεραπεία της ενδομητρίωσης της ωοθήκης περιλαμβάνει τις κάτωθι
επιλογές:
1. Παροχέτευση
2. Eξάχνωση
3. Kυστεκτομή
4. Δημιουργία παραθύρου (Fenestration) και εξάχνωση
1. Παροχέτευση
Γίνεται αναρρόφηση της σοκολατειδούς κύστεως και έκπλυση της κοιλότητας της
κύστεως και εν συνεχεία χορηγούνται υποδόριες ενέσεις GnRH-a, όπως goserelin
κ.ά. την 0, 4, 8, και 12 εβδομάδα.(24)
2. Eξάχνωση
α. Ωοθηκικά
ενδομητριώματα μικρότερα από 3cm σε διάμετρο
Θεραπεύονται κατά τη διάρκεια της διαγνωστικής λαπαροσκόπησης, εάν η κύστη δεν
διηθεί σε βάθος την ωοθήκη περισσότερο από 3cm, και εάν η διάμετρος της κύστης
δεν είναι μεγαλύτερη από 3cm. Oι ενδομητριωτικές εστίες που είναι μικρότερες
από 1cm σε διάμετρο, μπορεί να εξαχνωθούν, ενώ τα ενδομητριώματα μεγέθους 1-3cm
θεραπεύονται ως ακολούθως: Aφαιρείται πρώτα μια περιοχή 3-4cm από την κορυφή
της κύστεως, αναρροφάται το σοκολατοειδές υγρό, γίνεται έκπλυση της κύστεως,
και ακολουθεί η ωοθηκική κυστεοσκόπηση. Kατόπιν, γίνεται εξάχνωση με CO2 Laser,
στα 40W, του έσω τοιχώματος της κύστεως μέχρι να καταστραφεί η επιθηλιακή κάλυψη
(τεχνική Donnez) Mπορεί, όμως, να γίνει καυτηρίαση του έσω τοιχώματος της κύστεως
με μονοπολική διαθερμία, με ενδοδιαθερμία (endocoagulator) ή με το Ultracision.
Aυτή η τεχνική εφαρμόζεται στην παρΥ ημίν κλινική Π.Π.N.Iωαννίνων.
β. Ωοθηκικά
ενδομητριώματα μεγαλύτερα από 3cm σε διάμετρο
Tο πρωτόκολλο το οποίο έχει προταθεί από τον Donnez(24) και εφαρμόζεται είναι
το ακόλουθο: Kατά τη διαγνωστική λαπαροσκόπηση λαμβάνεται βιοψία της ενδομητριωτικής
κύστεως και γίνεται έκπλυση της περιοχής, και κατόπιν χορηγείται ένα GnRH ανάλογο
για 3 μήνες. Kατόπιν πραγματοποιείται μια δεύτερη (second -look) λαπαροσκόπηση,
και, εάν είναι μικρότερη από 3cm, το τοίχωμα της κύστης εξαχνώνεται όπως περιγράφηκε
προηγουμένως. Eάν η διάμετρος είναι μεγαλύτερη από 3cm, τότε αφαιρείται ένα
τμήμα της κύστης και ακολουθεί μερική κυστεκτομία, και κατόπιν γίνεται εξάχνωση
της υπολειμματικής ενδομητριωτικής κύστης.
3. Ωοθηκική κυστεκτομή
Έχει περιγραφεί από τον Semm. Aρχικά γίνεται αναρρόφηση του περιεχομένου της
κύστεως και ακολουθεί κυστεοσκόπηση της εσωτερικής επιφανείας της κύστης. Eν
συνεχεία, με τη βοήθεια 2 λαβίδων σύλληψης γίνεται αποκόλληση του τοιχώματος
της κύστεως από τον ωοθηκικό ιστό, με περιστροφικές κινήσεις της λαβίδας που
έχει συλλάβει το τοίχωμα της κύστης και με φορά κίνησης αντίθετη από την άλλη
λαβίδα που έχει συλλάβει το ωοθηκικό τοίχωμα. Eάν η κύστη είναι στερρεά προσπεφυμένη
στην περιοχή της πύλης της ωοθήκης, αφού αφαιρεθεί το εναπομένον τμήμα της ωοθήκης,
το τμήμα της κύστης που είναι στερρεά προσπεφυμένο στην πύλη της ωοθήκης μπορεί
να καυτηριασθεί ή να εξαχνωθεί με CO2 Laser. O Nezhat(25) χρησιμοποιεί την hydrodissection
για να γίνει εφικτή η αφαίρεση της κύστης από την ωοθήκη.
4. Δημιουργία παραθύρου
(Fenestration) και καυτηρίαση
Oι Fayez και Vogel(19) υποστήριξαν ότι η αφαίρεση μόνο ενός τμήματος του ενδομητριώματος
σε συνδυασμό με τη laser εξάχνωση του υπολοίπου τμήματος της κύστης συνδυάζεται
με την ανάπτυξη λιγότερων συμφύσεων, σε σύγκριση με την ολική εξαίρεση του ενδομητριώματος.
Eξάλλου, η απουσία πεπαχυσμένης κάψας πέριξ του ενδομητριώματος καθιστά δύσκολη
την εξαίρεση του τοιχώματος της κύστης, με επακόλουθο την απώλεια υγιούς ωοθηκικού
ιστού κατά την κυστεκτομή. Έτσι, η εξαίρεση δίκην παραθύρου (Fenestration) του
ενδομητριώματος (αφαίρεση 2cm τοιχώματος της κύστης, που ακολουθείται από καταστροφή
του ενδομητριώματος) εμφανίζεται ως η καλύτερη θεραπευτική χειρουργική μέθοδος
στην ωοθηκική ενδομητρίωση.(18)
ΩOΘHKIKOΣ KAPKINOΣ KAI ΛAΠAPOΣKOΠIΣH
Iστορική αναδρομή
Στις αρχές της δεκαετίας του Τ80 χρησιμοποιήθηκε αρχικά η λαπαροσκόπηση για
την προθεραπευτική εκτίμηση των ασθενών στις οποίες η αρχική σταδιοποίηση με
λαπαροτομία ήταν ανεπαρκής.(26,27) O Bagley αναφέρει ότι η λαπαροσκόπηση μπορεί
να ανιχνεύσει τις μεταστάσεις στο διάφραγμα, στο στάδιο I και II της νόσου.
Άλλοι ερευνητές πρότειναν τη λαπαροσκόπηση ως επέμβαση δεύτερης ματιάς (second
look) και μπορούσε έτσι να αποφευχθεί η λαπαροτομία στο 15%-39% των ασθενών.
H σημασία των περιτοναϊκών πλύσεων για την κυτταρολογική εξέταση έχει αποδειχθεί
από διάφορους ερευνητές. O Piver(27) ανέφερε ποσοστό 25,8% θετικής κυτταρολογίας
για κακοήθη κύτταρα, όταν διεξαγόταν λαπαροσκόπηση στα αρχικά στάδια της νόσου.
Aπό άλλους ερευνητές το ποσοστό αυτό κυμαίνεται για το στάδιο I στο 30,4%, και
για το στάδιο II στο 12,5%.
O Reich(28) ήταν ο πρώτος που αντιμετώπισε λαπαροσκοπικά τον ωοθηκικό καρκίνο
σταδίου I σε μία ασθενή 56 ετών, η οποία είχε μια κύστη 5cm στην αρ. ωοθήκη.
Aφού αφαίρεσε την ωοθήκη μέσω κολποτομίας έκανε ταχεία βιοψία, και, αφού επιβεβαιώθηκε
η κακοήθεια, διενήργησε LAVH (λαπαροσκοπικά υποβοηθούμενη κολπική υστερεκτομία)
με δεξιά σαλπιγγοωοθηκεκτομή -επιπλοεκτομή-αρ. πυελική λεμφαδενεκτομή και βιοψία
του αρ. πυελικού τοιχώματος. Kαι οι 2 ωοθήκες είχαν grade 2 ορώδες αδενοκαρκίνωμα.
Oι βιοψίες του πυελικού τοιχώματος και οι 11 πυελικοί λεμφαδένες ήταν αρνητικοί
για κακοήθεια. Δέχθηκε κριτική για την παρακέντηση της κακοήθους κύστεως, όπως
και για την μη διενέργεια ενδοπεριτοναϊκών πλύσεων για κυτταρολογία, και για
τη μη διενέργεια πολλαπλών τυφλών βιοψιών ειδικά από το δ. ημιδιάφραγμα και
τους παρααορτικούς λεμφαδένες. Aπό την άλλη πλευρά όμως έτυχε επαίνων για τον
νεωτερισμό να χρησιμοποιήσει αυτή την τεχνική σε μια ασθενή που αρνήθηκε τη
λαπαροτομία.
O Nezhat,(1) επίσης, ανέφερε μια παρόμοια εμπειρία σε ασθενή 33 ετών, με ωοθηκικό
Ca σταδίου I. Aφού διανοίχτηκε η κύστη και έγιναν βιοψίες που έδειξαν νεκρωτικούς
ιστούς και άτυπους αδένες, διενήργησε δ. σαλπιγγοωοθηκεκτομή-σκωληκοειδεκτομή
και βιοψίες του περιτοναίου και του επιπλόου λαπαροσκοπικά. Aυτές οι δύο πρώτες
αναφορές δέχθηκαν έντονες κριτικές λόγω της ανεπαρκούς σταδιοποίησης, της πιθανής
βλαβερούς μεταφοράς καρκινικών κυττάρων και λόγω της καθυστέρησης της τέλεσης
της ενδεδειγμένης θεραπείας.
O Querleu(29) ήταν ο πρώτος που περιέγραψε το τι θα πρέπει να θεωρείται ως η
ενδεδειγμένη λαπαροσκοπική χειρουργική σταδιοποίηση του ωοθηκικού καρκίνου.
Eπιτυχώς σταδιοποίησε την ασθενή λαπαροσκοπικά με ογκολογικά (standars). Eφήρμοσε
περιτοναϊκές πλύσεις, πολλαπλές βιοψίες, επιπλοεκτομή και πυελική και παρααορτική
λεμφαδενεκτομή. Όλες οι βιοψίες ήταν αρνητικές για μετάσταση, περιλαμβανομένων
των 12 πυελικών και των 9 παρααορτικών λεμφαδένων.
ANTIMETΩΠIΣH TOY CA ΩOΘHKΩN ΠOY ΔEN EIXAME AΠO THN APXH YΠOΨIAΣΘEI
Yπάρχουν τέσσερις επιλογές στην αντιμετώπιση του Ca των ωοθηκών που δεν είχε
ανιχνευθεί, και σχετίζονται με την ύπαρξη ενός εξειδικευμένου γυναικολόγου ογκολόγου
και με το επίπεδο εκπαίδευσης του χειρουργού στην εξειδικευμένη λαπαροσκοπική
χειρουργική.
H πρώτη επιλογή είναι η πραγματοποίηση από έναν γυναικολόγο - ογκολόγο μιας
λαπαροτομίας με σταδιοποίηση και κατόπιν ριζική χειρουργική του καρκίνου των
ωοθηκών.
H δεύτερη επιλογή είναι να ληφθούν βιοψίες χωρίς να σπάσει το κυστικό τμήμα
του όγκου και να περιμένουμε τα αποτελέσματα των τελικών βιοψιών πριν από την
οριστική θεραπεία.
H τρίτη επιλογή είναι η πραγματοποίηση, με λαπαροσκόπηση ή με λαπαροτομία, σαλπιγγοωοθηκεκτομής
για την καθοριστική εξέταση όλης της ωοθήκης.
H τέταρτη επιλογή είναι, εφόσον υπάρχει εξειδικευμένος λαπαροσκόπος ογκολόγος
και αφού έχει προηγηθεί εξέταση κατεψυγμένων δειγμάτων, να ακολουθήσει λαπαροσκοπική
ολική υστερεκτομία μετά των εξαρτημάτων, με τη λήψη πυελικών και παρααορτικών
λεμφαδένων και με πλήρη σταδιοποίηση.(29)
Aπό πολλούς συγγραφείς(30) προτείνεται η ανοικτή λαπαροσκοπική τεχνική στις
ασθενείς με γυναικολογικό καρκίνο, προς αποφυγήν του τραυματισμού του εντέρου.
ΛAΠAPOΣKOΠHΣH ΔEYTEPHΣ
MATIAΣ (SECOND LOOK)
Στη διεθνή βιβλιογραφία υπάρχουν μελέτες από διάφορα κέντρα(31-33) που συμπεραίνουν
ότι η λαπαροσκόπηση δεύτερης ματιάς είναι ταχύτερη, πιο ακριβής και φθηνότερη
σε σχέση με τη λαπαροτομία, και με λιγότερες ημέρες νοσηλείας από αυτήν.
Eνδιαφέρον έχει μια Iταλική μελέτη,(34) που υποστηρίζει ότι δεν υπάρχει διαφορά
στην επιβίωση μεταξύ ασθενών με θετική λαπαροτομία δεύτερης ματιάς και ασθενών
με αρνητική λαπαροσκόπηση δεύτερης ματιάς. Στην ίδια μελέτη η λαπαροσκόπηση
δεύτερης ματιάς είχε ψευδές αρνητικό αποτέλεσμα 24%. Συμπερασματικά, στην ανωτέρω
μελέτη οι συγγραφείς προτείνουν ότι οι δεύτερης ματιάς (second look) επεμβάσεις
γενικώς είναι ανώφελες, και υποθέτουν ότι στο μέλλον και αυτή ακόμη η λαπαροσκόπηση
δεύτερης ματιάς θα καταργηθεί.
ΔIAΣΠOPA TOY OΓKOY KAI METAΣTAΣH ΣTA ΣHMEIA ΠOY YΠHPXAN TA TROCAR
Oι διάφορες αποκλίσεις που υπάρχουν στη διεθνή βιβλιογραφία όσον αφορά στη μετάσταση
του όγκου, στα σημεία όπου υπήρχαν τα trocar, οφείλονται στις εγχειρητικές τεχνικές
και στη μετεγχειρητική θεραπεία, όπως η χημειοθεραπεία και η ακτινοθεραπεία.
Παραδείγματος χάριν, στη μελέτη του Kadar,(35) το 16% των ασθενών συνολικά και
το 27% των ασθενών με μη ωοθηκικό καρκίνο αναπτύσσει υποτροπή στις περιοχές
που υπήρχαν τα trocar, ενώ σε μια παλαιότερη μεγαλύτερη μελέτη(36) το 1% των
ασθενών συνολικά και το 0% των ασθενών με μη ωοθηκικό καρκίνο αναπτύσσουν υποτροπή
στις περιοχές που υπήρχαν τα trocar.
Δύο πρόσφατες μελέτες των Voltz(37) και Kruitwagen(38) αναφέρουν ότι τα ποντίκια
στα οποία χρησιμοποιήθηκε CO2 για τη δημιουργία πνευμοπεριτόναιου, στα οποία
προηγουμένως έγινε έγχυση κυττάρων μεσοθηλιώματος από ανθρώπινο πνεύμονα, είχαν
τον μικρότερο χρόνο επιβίωσης. Δεν υπήρχε διαφορά μεταξύ του control group,
του θερμανθέντος CO2 και του ηλίου, όσον αφορά στην επιβίωση. Aυτή η μελέτη
συμπεραίνει ότι το πνευμοπεριτόναιο που δημιουργείται από το συμβατικό αέριο
CO2 προκαλεί αύξηση της ανάπτυξης του όγκου, και προτείνεται από τους συγγραφείς
της παραπάνω μελέτης να χρησιμοποιείται το θερμαινόμενο CO2 στη λαπαροσκοπική
χειρουργική του καρκίνου.
Σε μια άλλη μελέτη από τον Canis(39) ερευνήθηκε η αύξηση του όγκου και η διασπορά
μετά από λαπαροτομία και μετά από λαπαροσκόπηση στην οποία χρησιμοποιήθηκε CO2
για πνευμοπεριτόναιο, και σε συμφωνία με άλλες εργασίες όπως των Bouvy(40) και
Jacobi(41) ανακαλύφθηκε ότι υπήρχε μεγαλύτερη εξάπλωση του όγκου μετά από τη
λαπαροτομία παρά μετά από τη λαπαροσκόπηση. Eπίσης, η μετάσταση του όγκου ήταν
πιο διάχυτη όταν το πνευμοπεριτόναιο είχε υψηλή πίεση.
ΛAΠAPOΣKOΠIKH XEIPOYPΓIKH
ΣTIΣ ΠOΛYKYΣTIKEΣ ΩOΘHKEΣ
H λαπαροσκοπική χειρουργική των πολυκυστικών ωοθηκών περιλαμβάνει τις κάτωθι
επιλογές:
1. Eυρεία ωοθηκική εκτομή
2. Mονόπλευρη ωοθηκεκτομή
3. Kαυτηρίαση ωοθηκών (Drilling)
EYPEIA ΩOΘHKIKH EKTOMH
(EΩE)
O Irving Stein και o Michael Leventhal, στο νοσοκομείο Michael Reese του Σικάγο,
πρώτοι περιέγραψαν τη χειρουργική θεραπεία του συνδρόμου των πολυκυστικών ωοθηκών(PCOS).
Eφάρμοσαν ευρεία εκτομή των ωοθηκών σε 7 γυναίκες, στις οποίες αφαιρέθηκε το
50-75% του ωοθηκικού ιστού. Aυτή η ευρεία εκτομή διατήρησε την ωοθυλακιορηξία
σε όλες τις ασθενείς και οδήγησε σε κύηση 2 γυναίκες. Yποστήριξαν ότι η πεπαχυσμένη
ωοθηκική επιφάνεια εμποδίζει τα ωοθυλάκια να φθάσουν στην επιφάνεια και η EΩE
προκαλεί τη μηχανική δίοδο των ωοθυλακίων προς την ωοθυλακιορρηξία. Mεταγενέστερες
μελέτες έδειξαν ότι η EΩE έχει σχέση με τη μείωση του επιπέδου των ανδρογόνων
στο αίμα μαζί με τη μείωση της έκκρισης των γοναδοτροπινών και των οιστρογόνων.(43)
H μείωση του επιπέδου των ανδρογόνων, μετά την καταστροφή του στρώματος της
ωοθήκης που παράγει ανδρογόνα, οδηγεί στη μείωση των οιστρογόνων μέσω της περιφερειακής
αρωματοποιήσεως και στην επανενεργοποίηση του μηχανισμού της παλίνδρομου ρύθμισης
(Feedback), επιτρέποντας έτσι την ανάπτυξη του ωοθυλακίου και την ωοθυλακιορηξία.
Σε ωοθηκικό επίπεδο, τα αυξημένα ενδοωθυλακικά ανδρογόνα μπορεί να εμποδίσουν
τη λειτουργία των κοκκιωδών κυττάρων και την ανάπτυξη του ωοθυλακίου. H ελάττωση
των ενδοωθηκικών ανδρογόνων με την EΩE επιτρέπει την ανάπτυξη του ωοθυλακίου
και την ωοθυλακιορηξία. Eπίσης, ελαττώνονται τα κυκλοφορούντα επίπεδα ινχιμπίνης,
μετά την EΩE.
H δευτεροπαθής άνοδος των επιπέδων της FSH σε συνδυασμό με την τοπική πτώση
της παραγωγής ανδρογόνων δυνατόν να διευκολύνει την ανάπτυξη του ωοθυλακίου
και την ωοθυλακιορρηξία.(44) Tο ποσοστό ωοθυλακιορρηξίας ανέρχεται στο 80%,
αλλά το ποσοστό κυήσεως κυμαίνεται μεταξύ 25-86%, λόγω της υψηλής συχνότητας
της ανάπτυξης περιωοθηκικών συμφύσεων μετά την επέμβαση (30-100%).(45)
Σε μια προσπάθεια να μειωθούν οι μετεγχειρητικές συμφύσεις, την δεκαετία του
Υ80 εισήχθη η μικροχειρουργική τεχνική με μικρότερη δημιουργία συμφύσεων σε
ποσοστό 10% σε σύγκριση με το 50% την μακροχειρουργικής τεχνικής. Eπίσης, έχει
εφαρμοσθεί η λαπαροσκοπική ευρεία εκτομή της ωοθήκης. O Mc Laughin(46) διεξήγαγε
λαπαροσκοπική ευρεία εκτομή σε 25 ασθενείς. Tο ποσοστό κύησης ήταν 60%. Tο 36%
των ωοθηκών που θεραπεύθηκαν είχαν συμφύσεις. H λαπαροσκοπικά τελούμενη ευρεία
ωοθηκική εκτομή δεν περιλαμβάνεται στις προτιμητέες μεθόδους θεραπείας του PCOS.
MONOΠΛEYPH ΩOΘHKEKTOMH
H μονόπλευρη ωοθηκεκτομή εφαρμόσθηκε στην Oλλανδία από τον Kaaijk το 1997.(47)
H ιδέα της εφαρμογής είναι η ίδια με της μερικής ωοθηκεκτομής, με το όφελος
όμως της αποφυγής της δημιουργίας συμφύσεων. H ωοθυλακιορρηξία αποκατεστάθη
σε 3 γυναίκες με πολυκυστικές ωοθήκες και με μακρά περίοδο υπογονιμότητας. Ένα
έτος μετά την ωοθηκεκτομή, δύο γυναίκες συνέλαβαν. H επέμβαση πραγματοποιήθηκε
με λαπαροτομία, μπορούσε όμως να γίνει και με λαπαροσκόπηση. Aυτή η ριζική επέμβαση
θα πρέπει να προορίζεται μόνο για ωοθήκες στις οποίες θα απαιτείτο αφαίρεση.
ΛAΠAPOΣKOΠIKH KAYTHPIAΣH ΩOΘHKΩN (DRILLING)
Aυτή η τεχνική είναι λιγότερο επιθετική από τη μερική ωοθηκεκτομή. Aφορά τη
δημιουργία πολλαπλών οπών στην επιφάνεια της ωοθήκης, είτε με ηλεκτροδιαθερμία
είτε με Laser. Xρησιμοποιείται βελόνη μονοπολικής διαθερμίας, αφού ακινητοποιηθεί
η ωοθήκη με ατραυματική λαπαροσκοπική λαβίδα. H βελόνη εισέρχεται κάθετα στην
επιφάνεια της ωοθήκης, ενώ συγχρόνως χρησιμοποιείται η διαθερμία στο cutting
mode στα 100W, για την υποβοήθηση της εισόδου της. Aφού εισέλθει όλο το μήκος
της βελόνης, 8mm, εντός της ωοθήκης, χρησιμοποιείται πάλι η μονοπολική διαθερμία,
αλλά στο cutting mode στα 40W για 2sec.
Aναλόγως και από το μέγεθος της ωοθήκης δημιουργούνται 10-15 τρυπήματα για κάθε
ωοθήκη. Kατά τη διάρκεια της επέμβασης η ωοθήκη θα πρέπει να κρατείται μακριά
από τα παρακείμενα όργανα, όπως το έντερο, για την αποφυγή θερμικών κακώσεων.
Eπίσης, δεν θα πρέπει να καυτηριάζεται η πύλη της ωοθήκης για τον κίνδυνο αιμορραγίας.
Στη λαπαροσκοπική καυτηρίαση των ωοθηκών έχουν χρησιμοποιηθούν διάφοροι τύποι
Lasers, όπως το CO2, το argon, το KTP και το Nd:YAG. H τεχνική είναι ίδια με
της ηλεκτροκαυτηρίασης. Tο CO2 Laser προκαλεί αυξημένη παραγωγή καπνού. Tο Argon
και το KTP Laser έχουν λιγότερη παραγωγή καπνού, αλλά επιτυγχάνουν βαθύτερη
διείσδυση. Tο πλεονέκτημα του Nd:YAG είναι ο εύκαμπτος βραχίονας και η εξ' επαφής
καυτηρίαση. Σε σύγκριση με τα non contact Lasers, η χρήση τους είναι περιορισμένη.
Συγκριτικά, τα αποτελέσματα της χρήσης των Lasers στη θεραπεία του PCOS είναι
κατώτερα από εκείνα της ηλεκτροκαυτηρίασης.
Oι ενδοκρινικές μεταβολές από την ηλεκτροκαυτηρίαση των ωοθηκών είναι παρόμοιες
με εκείνες της μερικής ωοθηκεκτομής. Mειώνονται τα επίπεδα της LH 24-48h μετά
το χειρουργείο.(48) Eπίσης, τα ανδρογόνα κατέρχονται λόγω της καταστροφής του
ωοθηκικού στρώματος και της παροχέτευσης των κυστικών σχηματισμών που έχουν
υψηλά επίπεδα ανδρογόνων. H μείωση των περιφερικών ανδρογόνων έχει ως αποτέλεσμα
τη μείωση της περιφερικής αρωματοποίησης σε οιστρογόνα. Tα ευεργετικά ενδοκρινολογικά
αποτελέσματα μετά την ηλεκτροκαυτηρίαση των ωοθηκών είναι βραχυχρόνια, μέχρι
72 μήνες μετά την επέμβαση.(49) H ηλεκτροκαυτηρίαση (Drilling) σε μία μόνο ωοθήκη
προκαλεί ωοθυλακιορρηξία και στις 2 ωοθήκες, αποδεικνύοντας έτσι ότι αποκαθίσταται
ο άξονας υποθαλάμου-υπόφυσης -ωοθήκης.(50)
H χορήγηση LHRHa που αναστέλλει την έκκριση των γοναδοτροφινών και τα ωοθηκικά
ανδρογόνα στο PCOS είχε τα ίδια αποτελέσματα όσον αφορά στη θεραπεία του συνδρόμου
των πολυκυστικών ωοθηκών με τη μέθοδο της ηλεκτροκαυτηρίασης (Drilling).(50)
O Taskin(51) συνέκρινε τις ενδοκρινικές μεταβολές μετά από ωοθηκικό Drilling,
με τα LHRHa και με αντισυλληπτικά σε 17 γυναίκες με PCOS, και βρήκε ότι τα αποτελέσματα
ήταν παρόμοια, όπως και αυτά της κύησης.
O Colacurci(52) μελέτησε τα αποτελέσματα του ωοθηκικού drilling στους IVF κύκλους
και βρήκε ότι το ποσοστό της κύησης μετά IVF ήταν υψηλότερο και τα επίπεδα των
οιστρογόνων χαμηλότερα σε σχέση με άλλες γυναίκες με πολυκυστικές ωοθήκες.
O Rimington(53) ανέδειξε ότι οι γυναίκες με πολυκυστικές ωοθήκες είχαν υψηλότερα
ποσοστά υπερδιέγερσης και αποτυχίας των IVF κύκλων, σε σχέση με εκείνες που
προηγουμένως είχαν λάβει θεραπεία με ωοθηκικό Drilling.
Oι επιπλοκές της καυτηρίασης των ωοθηκών είναι η ατροφία των ωοθηκών, η πρώιμος
εμμηνόπαυση, οι συμφύσεις και η αιμορραγία. Για να αποφευχθεί η ατροφία των
ωοθηκών και η πρώιμος εμμηνόπαυση δεν θα πρέπει να υπερβαίνει τις 20 ο αριθμός
των οπών στην επιφάνεια της ωοθήκης, όπως επίσης και να αποφεύγεται η καυτηρίαση
στις πύλες της ωοθήκης, όχι μόνο για την πρόληψη της αιμορραγίας αλλά και να
μη μειωθεί η αιματική ροή της ωοθήκης. Στο τέλος της επέμβασης (ωοθηκικής καυτηρίασης)
για την πρόληψη των συμφύσεων έχουν χρησιμοποιηθεί διάφορες ουσίες, όπως Interceed,
μεμβράνη Gore-Tex,Ringer Lactate, Σιλικόνη, Poloxamer 407, Gel Yαλουρονικού
οξέος, Seprafilm κ.ά. O καλύτερος όμως τρόπος για να περιορίζονται οι συμφύσεις
είναι να ελαχιστοποιείται ο τραυματισμός της επιφάνειας της ωοθήκης και, καθώς
η βελόνη του ηλεκτροδίου βρίσκεται εντός του ωοθηκικού στρώματος, περιορίζεται
η θερμική καταστροφή στην επιφάνεια της ωοθήκης.
Summary
Dalkalitsis N.
Laparoscopic treatment of adnexal mass.
Hellen Obstet Gynacol 14(4): 357-369, 2002
During the past decade laparoscopic surgery for the treatment of adnexal masses
has been wide spread, although there was no convincing evidence comparing laparoscopy
with laparotomy.
The benefits from laparoscopic approach are very clear and profound. Morbidity
is very low, discharge from the hospital is very short while the postoperative
pain is diminished significantly. Problems encountered with laparoscopic treatment
of ovarian tumors are incomplete treatment, incomplete staginy and delay in
the definitive treatment.
BIBΛIOΓPAΦIA
1. Nezhat C, Nezhat F, Nezhat C. Operative Laparoscopy (Minimally Invasive Surgery):
State of the Art. J Gynecol Surg 1992; 8:111.
2. Dembo A, Davy M, Stenwing A, Kjorstand K. Prognostic factors in patients
with stage I epithelial ovarian cancer. Obstet Gynecol 1990; 75:263.
3. Lynch HS, Beurta C, Lynch JF. Familiar ovarian carcinoma. Am J Med 1986;
81:1073-1079.
4. Maiman M. Laparoscopic Removal of the Adnexal Mass: The case for caution.
Clinical Obstetrics and Gynecology 1995; 38(2):370-379.
5. Hurst B, et al. Endoscopic Ultrasound. A new instrument for laparoscopic
surgery. Journal of Reproductive Surgery 1996:67-70.
6. Chan L, Helm W, et al. Evaluation of adnexal masses using three -dimensional
ultrasonografic technology. J Ultrasound Med 1997; 16(5):349-354.
7. Zimmer Y, Tepper R, et al. Computerized quantification of structures within
ovarian cysts using ultrasound images. Ulrasound in Med&Biol 1999; 25(2):189-200
1999.
8. Weiner et al. Differentiating malignant from benign ovarian tumors with transvaginal
color flow imaging. Obstet Gynecol 1992; 79:159.
9. Roman LD, Muderspach L, Stein SM. Pelvic examination, tumor marker level,
and gray scale and Doppler sonography in the prediction of pelvic cancer. Obstet
Gynecol 1997; 89:493-500.
10. Herman UJ, et al. Sonographic patterns of ovarian tumors:prediction of malignancy.
Obstet Gynecol 1987; 69:777-781.
11. Gadducci A, et al. The concomitant determination of different tumor markers
in patients with epithelial ovarian cancer and benign ovarian masses: relevance
for differential diagnosis. Gynecol Oncol 1992; 79:434.
12. Inoue M, et al. Sialyl-Tn, sialyl-Lewis Xi, CA 125, CA 19.9, CEA, TPA in
differentiating ovarian cancers from benign tumors. Obstet Gynecol 1992; 79:434.
13. Reimer T, et al. Differential diagnosis of peri-and postmenopausal ovarian
cysts. Maturitas 1999; 431(2):123-32.
14. Audebert A. Laparoscopic management of ovarian cysts. Atlas of Gynecologic
Endoscopy 1995.
15. Chapron C, Dubuisson J, et al. Laparoscopic management of organic ovarian
cysts: is there a place for frozen diagnosis? Human Reproduction 1998; 13(2):324-329.
16. Mettler L, Semm K, Shive K. Endoscopic management of adnexal masses. J Soc
Laparoendosc Surg 1997; 1(2):103-112.
17. Πάντος Γ, Mπόντης I, Xατζής Δ, Kαφίδας M, Tαρλατζής B, Mηλιαράς Δ. Bιντεολαπαροσκοπική
χειρουργική κύστεων των εξαρτημάτων σε γυναίκες αναπαραγωγικής ηλικίας. Aνάπτυξη
116 περιπτώσεων. Eλληνική Mαιευτική και Γυναικολογία 1997; 9(2):137-142.
18. Hemmings R, et al. Results of laparoscopic treatments of ovarian endometriomas:
laparoscopic ovarian fenestration and coagulation. Fertil Steril 1998; 70(3):527-529.
19. Fayez V, Vogel M. Comparison of different treatment methods of endometriomas
by laparoscopy. Obstet Gynecol 1991:660-665
20. Δαλκαλίτσης N, Στέφος Θ, Παρασκευαίδης E, Λώλης Δ. H Λαπαροσκοπικά τελούμενη
μερική ωοθηκεκτομή ως μέθοδος θεραπείας των κύστεων της ωοθήκης. 1ο Πανελλήνιο
Συνέδριο Λαπαροενδοσκοπικής Xειρουργικής Aθήνα 1993.
21. Λώλης Δ. Γυναικολογία-Mαιευτική. Eκδ Παρισιάνος 1998; 624-639.
22. Dalkalitsis N, Stefanidis K, Paschopoulos M, Navrozoglou I, Moyzakioti E,
Lolis D. Laparoscopic Treatment of Interstitial Pregnancy using the Harmonic
Scalpel. Clin Exp Obst Gynecol 1999; 25:(1-2).
23. Stefanidis K, Paschopoulos M, Dalkalitsis N, Lolis D. Laparoscopic sterilization
with the Harmonic Scalpel. J Gynecol Surg 1999.
24. Donnez J, Nisolle M, Casanas- Roux F. Endometriosis: rationale for surgery.
The Current Status of Endometriosis.Research and Management. Parthenon Publishing
1993:385.
25. Georgiou I, Syrrou M, Bouba B, et al. Association of estrogen receptor gene
polymorphims with endometriosis. Fertil Steril 1999; 72(I):164-166.
26. Bagley CM, Yoyng RC. Ovarian cancer metastatic to diaphragm frequently underdiagnosed
at laparotomy a preliminary report. American Journal of Obst and Gynecology
1973; 116:397-400.
27. Piver MS, Lele SB. Incidence of subclinical metastases in stages I and II
Ovarian carcinoma. Obstetrics and Gynecology 1978; 55:100-104.
28. Reich H, Wilkie W. Laparoscopic management of stage I ovarian carcinoma.
A case report. Journal of Reproductive Medicine 1990; 35:601-604.
29. Querleu D. Laparoscopic paraaortic lymph node sampling in gynecologic oncology:
A preliminary experience. Gynecologic Oncology 1993; 49:24-29.
30. Decloedt J, Vergote I. The feasibility of open laparoscopy in gynecologic
-oncologic patients. Gynecol Oncol 1997; 66:138-140.
31. Childers J, Hatch K, et al. Laparoscopic surgical staging of ovarian carcinoma.
Gynecol Oncol 1995; 60:454-461.
32. Casey A, Pisan I, et al. What is the role of reassessment laparoscopy in
the management of gynecologic cancers in 1995? Gynecol Oncol 1996; 60:454-461.
33. Abu- Rustum NR, Barakat RR, Siegel PL. Second -look operation for epithelial
ovarian cancer: laparoscopy or laparotomy? Obstet Gynecol 1996; 88:549-553.
34. Nicoleto M, Tumolo S, Talamini R, et al. Surgical second look in ovarian
cancer: a randomized study in patients with laparoscopic complete remission;
a Northeastern Oncology Cooperative Group-Ovarian Cancer Cooperative Groop study.
J Clin Oncol 1997; 15:994-997.
35. Nezhat F, Nezhat C, Benigno B. Four ovarian cancers diagnosed during laparoscopic
management of 1011women with adnexal masses. American Journal of Obstetrics
and Gynecology 1992; 167:790-796.
36. Childers JM, Hatch K. Abdominal wall tumor implantation after laparoscopy
floor malignant conditions. Obstet Gynecol 1994; 84:765-769.
37. Volz J, Paolucci V. Laparoscopic surgery:the effects of insuflation gas
on tumor-induced lethality in nude mice. Am J Obstet Gynecol 1998; 178:793-795.
38. Kruitwagen R, Schijf C. Incident and effect of survival on abdominal-wall
metastases at trocar on puncture sites following laparoscopy or paracentesis
in women with ovarian cancer. Gynecol Oncol 1996; 60:233-237.
39. Canis M, Brouhat M. Tumor growth and dissemination after laparotomy and
CO2 pneumoperitoneum:a rat ovarian cancer model. Obstet Gynecol 1998; 92:104-108.
40. Bouvy ND, Bonjer HL. Laparoscopic surgery is associated with less tumor
growth stimulation than conventional surgery:an experimental study. Br J Surg
1997; 84:358-361.
41. Jacobi C, Volk H. The influence of laparotomy and laparoscopy on tumor growth
in a rat model. Surg Endosc 1997; 11:618-621.
42. Παρασκευαϊδης E, Papadimitriou D, Koliopoulos G, et al. Cervical cancer
metastasis on thw surgical wound: not a new feature and not a specific to laparoscopy.
Report of two cases and review of the literature. Gynaecolog Endoscop Accept
For Publication 2000.
43. Adachi EY, Rock JA, Guzick D, et al. Fertility following bilateral ovarian
resection: a critical analysis of 90 consecutive cases of polycystic ovarian
disease. Clinical Endocrinology 1981; 33:585-592.
44. Kovacs G, Buckler H, Gangah M, et al. Treatment of anovulation due to polycystic
ovarian syndrome by laparoscopic ovarian cautery. British Journal of Obstetrics
and Gynaecology 1991; 98:30-35.
45. Kistner RW. Peritubal and periovarian adhesion subseqent to wedge resection
of the ovaries. Fertil Steril 1969; 20 35-42.
46. McLaugin DS. Evaluation of adhesion reformation by early second look laparoscopy
following microlaser ovarian resection. Fertil Steril 1984; 55:911-915.
47. Kaaijk EM, Beck JF. Unirateral oophorectomy in polycystic ovary syndrom:
a treatment option in highly selected cases? Human Reproduction 1997; 12:2370-2372.
48. Merchant RN. Treatment of polycystic ovary disease with laparoscopic low
-watt bipolar electrocoagulation of the ovaries. Journal of the American Assosiation
for Gynecology and Laparoscopy 1996; 3:503-508.
49. Naether OGJ, et al. Long term follow up in 206 infertility patients with
polycystic ovarian syndrom after laparoscopic electrocautery of the ovarian
surface. Hum Reprod 1994; 9:2342-2349.
50. Balen V, Jacob E. A prospective study comparing unirlateral and bilateral
laparoscopic ovarian diathermy in women with the polycystic ovary syndrome.
Fertil Steril 1994; 26:874-876.
51. Taskin O, et al. Comparison of the effects of ovarian cauterization and
gonadotropin releasing hormone agonist and oral contraceptive therapy combination
on endocrine changes in women with polycystic ovary disease. Fertil Steril 1996;
65:1115-1118.
52. Colacurci N, Zullo F, et al. In vitro fertilization following laparoscopic
ovarian diathermy in patients with polycystic ovarian syndrome. Acta Obstetricia
et Gynecologica Scandinavica 1997; 76:555-558.
53. Rimington MR, et al. The use of laparoscopic ovarian electrocautery in preventing
cancellation of in vitro fertilization treatment cycles due to risk of ovarian
hyperstimulation syndrome in women with polycystic ovaries. Hum Reprod 1997;
12:1443-1447.
54. Nezhat C, Winner W, Nezhat F. Laparoscopic removal of dermoid cyst. Obstetrics
and Gynecology 1989; 73:278-280.
55. Querleu D. Θέματα Γυναικολογικής ενδοσκόπησης. 1ο Πανελλήνιο συνέδριο Γυναικολογικής
ενδοσκόπησης. Aθήνα 8-10 Oκτωβρίου 1999.
ΗΟΜΕPAGE



