Ενδείξεις θεραπείας ασθενών
με χρόνια ηπατίτιδα Β
Σ. ΜΑΝΩΛΑΚΟΠΟΥΛΟΣ,
Χ. ΤΡΙΑΝΤΟΣ
Γαστρεντερολογικό Τμήμα, ΓΝΑ "Πολυκλινική"
Εισαγωγή
H λοίμωξη από τον ιό της ηπατίτιδας Β (HBV) αποτελεί ένα σημαντικό πρόβλημα
δημόσιας υγείας. Υπολογίζεται ότι περισσότεροι από 350 εκατομμύρια άνθρωποι
παγκοσμίως είναι μολυσμένοι από τον HΒV [1]. Σύμφωνα με τον Παγκόσμιο Οργανισμό
Υγείας, το 2000 καταγράφηκαν 5,2 εκατομμύρια περιπτώσεις οξείας ηπατίτιδας Β.
Οι πάσχοντες από χρόνια ηπατίτιδα Β παρουσιάζουν αυξημένο κίνδυνο ανάπτυξης
κίρρωσης, ηπατικής ανεπάρκειας και ηπατοκυτταρικού καρκίνου (ΗΚΚ) [2]. Ο ΗΚΚ
βρίσκεται στην 6η θέση των κακοηθειών παγκοσμίως, ενώ 50% των περιπτώσεων σχετίζονται
με τον ιό της ηπατίτιδας Β [3]. Η ενδημικότητα του ιού της ηπατίτιδας Β ποικίλλει
[4]. Μεγάλη θεωρείται στις περιοχές εκείνες στις οποίες ο επιπολασμός του ιού
είναι υψηλός >8% (Κίνα, ΝΑ Ασία, Μέση Ανατολή, Κεντρική Αφρική, περιοχές
του Αμαζονίου και Αλάσκα). Μέση στις περιοχές όπου ο επιπολασμός του HΒsAg κυμαίνεται
από 2-7% (Ιαπωνία, Ρωσία, Ινδία, κεντρική και Νότια Ευρώπη και περιοχές της
Κεντρικής και Νότιας Αμερικής). Χαμηλή στις περιοχές εκείνες όπου ο επιπολασμός
του HbsAg είναι <2% (Β Αμερική, Δ Ευρώπη και Αυστραλία). Σε μερικές περιοχές
όπως η Κίνα και οι υπο-Σαχάριες χώρες της Αφρικής, ο ΗΚΚ που σχετίζεται με την
ηπατίτιδα Β είναι μία από τις κύριες αιτίες καρκίνου στον ανδρικό πληθυσμό.
Ο HBV είναι ένας DNA ιός με διάμετρο 42nm που ανήκει στους Hepadna-ιούς και
προκαλεί οξεία και χρόνια λοίμωξη. Καλύπτεται από πρωτεϊνικό περίβλημα που αποτελείται
από την πρωτεΐνη επιφανείας με τον αντιγονικό επίτοπο HΒsAg και τις πρωτεΐνες
προ-S1 και προ-S2. Ο νουκλεοκαψιδικός πυρήνας αποτελείται από το DNA του ιού,
την πολυμεράση και την πυρηνική πρωτεΐνη c, με επίτοπο HbcAg. Στο αίμα έχουν
απομονωθεί σωματίδια του ιού (σωμάτια Dane), καθώς σωληνίσκοι και σφαίρες, που
αποτελούνται από τις πρωτεΐνες του περιβλήματος που παράγονται σε περίσσεια.
Τα γεγονότα τα οποία σημάδεψαν την επιδημιολογία της ηπατίτιδας Β τα τελευταία
20 χρόνια είναι η ανακάλυψη του εμβολίου, ο συστηματικός έλεγχος των εγκύων
γυναικών και ο συστηματικός εμβολιασμός των παιδιών [5].
Φυσική πορεία
της νόσου
Περίπου 70% των ασθενών με οξεία ηπατίτιδα Β διαδράμουν υποκλινική ή ανικτερκή
λοίμωξη, ενώ το 30% περίπου αναπτύσσουν ικτερική ηπατίτιδα. Σε ποσοστό δε μικρότερο
του 1% αναπτύσσεται οξεία ηπατική ανεπάρκεια εξαιτίας έντονης ανοσιακής κάθαρσης.
Η χρονιότητα καθορίζεται από την παρουσία του HΒsAg στον ορό για διάστημα μεγαλύτερο
από 6 μήνες. Η ηλικία και το φύλο συνιστούν τους βασικούς παράγοντες που επηρεάζουν
τη μετάπτωση σε χρονιότητα. Έτσι, ενώ αδυναμία κάθαρσης του ιού παρατηρείται
στο 5% περίπου των ενηλίκων, το ποσοστό αυτό ανέρχεται στο 90% στα νεογνά. Η
χρονιότητα καθορίζεται από την παρουσία του HΒsAg στον ορό για διάστημα μεγαλύτερο
των έξι μηνών. Πολλοί παράγοντες σχετίζονται με την εξέλιξη της χρόνιας λοίμωξης.
Μερικοί αφορούν τον ξενιστή (ηλικία, φύλο, ανοσιακή επάρκεια, γενετικοί παράγοντες,
συνοδά νοσήματα, έξεις-αλκοόλ), και άλλοι τον ίδιο τον ιό (πολλαπλασιασμός,
μεταλλαγές γονιδιώματος).
Η χρόνια λοίμωξη διακρίνεται σε τέσσερεις φάσεις, καθεμία από τις οποίες καθορίζεται
από ιολογικές, βιοχημικές και ιστολογικές παραμέτρους, με δυνητική μετάπτωση
της μίας στην άλλη. Πρόκειται για τη φάση της ανοχής, της κάθαρσης, της ενσωμάτωσης
και της ενεργοποίησης.
Στη φάση της ανοχής, ο ιός δεν αναγνωρίζεται από το ανοσιακό μας σύστημα και
πολλαπλασιάζεται με γρήγορο ρυθμό. Οι τρανσαμινάσες είναι σχεδόν φυσιολογικές,
το HBV DNA σε υψηλά επίπεδα, το HΒeAg θετικό, το anti HΒcore IgM σχετικά χαμηλό
και το HΒcAg εκφράζεται ανοσοϊστοχημικά στον πυρήνα του ηπατοκυττάρου. Ιστολογικά
διαπιστώνονται μη ειδικές ελαφρές αλλοιώσεις ή χρόνια επιμένουσα ηπατίτιδα.
Η διάρκεια της φάσης αυτής ποικίλλει από ημέρες ή εβδομάδες μέχρι δεκαετίες,
όπως συμβαίνει στη νεογνική ηλικία. Λόγω της ελάχιστης φλεγμονής και της ηπατοκυτταρικής
νέκρωσης δεν αναπτύσσεται κίρρωση του ήπατος.
Στη φάση της κάθαρσης, ο ιός συνεχίζει να πολλαπλασιάζεται, αναγνωρίζεται όμως
από το ανοσιακό σύστημα. Το HΒeAg μετατρέπεται σε anti HΒeAg, οι τρασνσαμινάσες
είναι υψηλές, το HBV DNA χαμηλό, το antiHBc IgM υψηλό, το HΒcAg εκφράζεται στον
πυρήνα του ηπατοκυττάρου, ενώ ιστολογικά παρουσιάζονται αλλοιώσεις χρόνιας λοβιακής
και ενεργού ηπατίτιδας. Ο ετήσιος ρυθμός οροαναστροφής είναι 5-10%, ενώ κατά
το στάδιο αυτό μπορεί να αναπτυχθεί κίρρωση του ήπατος με ετήσιο ρυθμό 1,5-2%.
Ακολουθεί η φάση της ενσωμάτωσης, όπου ο ιός ενσωματώνεται στο γενετικό υλικό
των ηπατοκυττάρων. Οι τρανσαμινάσες είναι φυσιολογικές, το ΗΒV DNA ανιχνεύεται
με PCR, το HΒeAg είναι αρνητικό, το anti HΒe είναι συνήθως αλλά όχι πάντα θετικό,
το anti HBc IgM παρουσιάζει χαμηλή τιμή και ιστολογικά διαπιστώνονται μη ειδικές
αλλοιώσεις ή αλλοιώσεις χρόνιας επιμένουσας ηπατίτιδας. Η παρουσία HΒeAg σημαίνει
έντονο πολλαπλασιασμό, ενώ η ορομετατροπή του HΒeAg σημαίνει μικρότερο ιικό
πολλαπλασιασμό και βελτίωση της ιστολογικής εικόνας του ήπατος. Στη φάση αυτή
δεν επιδεινώνεται η ιστολογική εικόνα παρά μόνο εάν υπάρξει επαναδραστηριοποίηση
του ιού λόγω μετάλλαξης ή εάν προστεθεί άλλος παράγοντας όπως αλκοόλ, φάρμακα
ή κάποιος ηπατοτρόπος ιός. H πορεία των ασθενών που παραμένουν στη φάση αυτή
για μακρό χρονικό διάστημα είναι πολύ καλή. Μικρό ποσοστό, περίπου 5%, παρουσιάζει
ιστολογικά κίρρωση, η οποία έχει αναπτυχθεί στην προηγούμενη φάση της κάθαρσης.
Το ΗΒsAg ανιχνεύεται σε υψηλές συγκεντρώσεις στο κυτταρόπλασμα σε μεγάλο αριθμό
ηπατοκυττάρων, δίνοντας τη χαρακτηριστική ιστολογική εικόνα "θαμπής υάλου".
Στη φάση της ενσωμάτωσης, ο ιός διατηρεί την ικανότητα να ενεργοποιηθεί, κυρίως
σε περιπτώσεις ανοσοκαταστολής αλλά και αυτόματα. Τα αυτόματα αυτά επεισόδια
είναι αρκετά συχνά στη φυσική ιστορία της λοίμωξης, διαδράμουν υποκλινικά, συμβάλλουν
όμως στην εξέλιξη της ηπατικής νόσου.
Η πρόγνωση και η θνητότητα των ασθενών διαφοροποιείται, γεγονός που υπογραμμίζει
την πολυπλοκότητα της νόσου και τη σημαντική αλληλοεπίδραση πολλών παραγόντων
στην εξέλιξή της. Η γεωγραφική επίσης θέση επηρεάζει την εξέλιξη και αποτελεί
χαρακτηριστικό που πρέπει να ληφθεί υπόψη στην αξιολόγηση των μελετών. Μελέτες
προερχόμενες από την Ευρώπη έδειξαν ευνοϊκότερη πρόγνωση, σε σύγκριση με μελέτες
από την Άπω Ανατολή. Η εξέλιξη σε κίρρωση των ΗΒeAg θετικών ασθενών εμφανίζεται
με ρυθμό 2-2,5% ετησίως [6]. Η εξέλιξη σε κίρρωση φαίνεται να είναι ταχύτερη
σε ΗΒeAg αρνητικούς ασθενείς. Η επίπτωση της μετάπτωσης σε μη αντιρρόπηση υπολογίζεται
σε 3% ετησίως [7]. Η πενταετής θνητότητα είναι 0-2% για ασθενείς με ηπατίτιδα
Β χωρίς κίρρωση, 14-20% για ασθενείς με καλά αντιρροπούμενη κίρρωση και 70-80%
μετά τη ρήξη της αντιρρόπησης [8]. Προγνωστικοί παράγοντες για την ανάπτυξη
κίρρωσης αποτελούν το θετικό HBeAg, η μεγάλη ηλικία και τα αυξημένα επίπεδα
ALT7. Παράγοντες κινδύνου για την ανάπτυξη HKK αποτελούν το άρρεν φύλο, το οικογενειακό
ιστορικό ΗΚΚ, η μεγάλη ηλικία, η παρουσία HBeAg, η κίρρωση και η συν-λοίμωξη
με HCV [9].
Με βάση τα ανωτέρω, οι ασθενείς με χρόνια ηπατίτιδα Β διακρίνονται σε δύο κατηγορίες.
Σε εκείνους με ενεργό νόσο (παθολογικές τρανσαμινάσες, ενδείξεις ιικού πολλαπλασιασμού
και μαρτυρία φλεγμονής στην ιστολογική μελέτη) και στους ανενεργούς φορείς.
Στην πρώτη κατηγορία, οι ασθενείς κινδυνεύουν να αναπτύξουν κίρρωση και ΗΚΚ
και χρήζουν θεραπείας. Οι ανενεργοί φορείς έχουν κατά κανόνα καλοήθη πορεία
και χρειάζονται μόνο παρακολούθηση [10]. Πρέπει να καταστεί σαφές ότι η παραπάνω
διάκριση είναι αδρή και ότι καθένας ασθενής μπορεί να μεταπέσει σε οποιοδήποτε
στιγμή της χρόνιας λοίμωξης, από τη μια κατηγορία στην άλλη. Το γεγονός αυτό
υπογραμμίζει και την αναγκαιότητα της συνεχούς και συστηματικής παρακολούθησης
των ανενεργών φορέων.
Η σημαντική αύξηση των γνώσεών μας όσον αφορά τη φυσική πορεία της νόσου, σε
συνδυασμό με την προσθήκη νέων ισχυρών αντιικών σκευασμάτων, οδήγησε την Αμερικανική,
την Ευρωπαϊκή Ηπατολογική Εταιρεία και το Ελληνικό Κέντρο Ελέγχου Ειδικών Λοιμώξεων
(ΚΕΕΛ) να παρουσιάσουν συναινετικές συστάσεις για την αντιμετώπιση των ασθενών
με χρόνια ηπατίτιδα Β [11,12,13]. Οι συστάσεις ακολουθούν κοινούς άξονες και
οι προτεινόμενες οδηγίες δε διαφέρουν.
Ενδείξεις θεραπείας
της χρόνιας ηπατίτιδας Β
Γενικά, η αποτελεσματικότητα της θεραπείας της χρόνιας ηπατίτιδας Β θα λέγαμε
ότι είναι περιορισμένη. Επομένως, ρεαλιστικός στόχος στη θεραπεία της χρόνιας
ηπατίτιδας Β είναι η καθυστέρηση ή η ακύρωση των σοβαρών επιπλοκών της νόσου
και δευτερεύοντες στόχοι είναι η ορομετατροπή, η καταστολή του HBV DNA και η
ιστολογική βελτίωση. Ο θεράπων ιατρός θα πρέπει να εκτιμά την ηλικία του ασθενούς,
τη φάση της λοίμωξης, τη βαρύτητα της νόσου, άλλα συνοδά προβλήματα, την πιθανότητα
της ανταπόκρισης και τα πιθανά προβλήματα από τη θεραπεία. Οι εγκεκριμένοι θεραπευτικοί
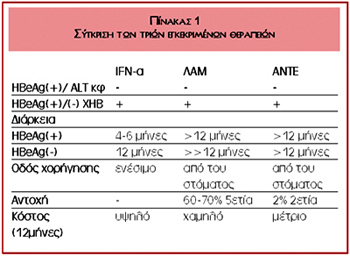
παράγοντες είναι τρεις: η ιντερφερόνη-α (IFN-α), η λαμιβουντίνη (ΛΑΜ) και η
διπιβαλική αντεφοβίρη (ΑΝΤΕ). Οι τρεις παράγοντες έχουν σημαντικές διαφορές.
Πλεονεκτήματα της IFN-α αποτελούν η συγκεκριμένη διάρκεια χορήγησης, η παρατεταμένη
μακροχρόνια ανταπόκριση και η μη ανάπτυξη μεταλλαγών. Μειονέκτημά της είναι
η παρεντερική χορήγηση και οι αρκετές παρενέργειές της. Η ΛΑΜ είναι εύκολα χορηγούμενη,
με ανεπιθύμητες ενέργειες παρόμοιες με εκείνες του εικονικού φαρμάκου. Επίσης,
σε ετήσια χορήγηση είναι η οικονομικότερη. Σημαντικό όμως πρόβλημα της θεραπείας
με ΛΑΜ είναι η ανάπτυξη μεταλλαγών που μειώνουν την αποτελεσματικότητά της.
Τέλος, η ΑΝΤΕ είναι δραστική σε όλες τις μορφές της χρόνιας ηπατίτιδας Β, συμπεριλαμβανομένων
των ανθεκτικών στη λαμιβουντίνη στελεχών, είναι εύκολη στη χορήγηση και με μικρό
ποσοστό ανάπτυξης μεταλλαγών. Είναι ακριβότερη της λαμιβουντίνης. Και τα τρία
σκευάσματα μπορούν να χορηγηθούν ως πρώτης γραμμής φαρμακευτική προσέγγιση.
Η σύγκριση των τριών παραπάνω παραγόντων παρουσιάζεται στον πίνακα 1.
Α. Ασθενείς
HBeAg θετικοί
Όταν οι ασθενείς εμφανίζουν επίπεδα αλανινικής αμινοτρανσφεράσης (ALT) >
2 φορές της φυσιολογικής τιμής (ΑΦΤ), HBV DNA στον ορό >105 copies /ml, και/ή
μέτρια/σοβαρή ηπατίτιδα στη βιοψία ήπατος, θα πρέπει να θεραπεύονται. H ιολογική
ανταπόκριση φαίνεται να είναι πολύ μεγαλύτερη από αυτή των ασθενών στην ομάδα
ελέγχου μετά θεραπεία με ΙFN-α [14], ΛΑΜ [15] και ΑΝΤΕ [16]. Οι τρεις παραπάνω
θεραπευτικοί παράγοντες έχουν παρόμοια αποτελεσματικότητα. Με εξαίρεση τις περιπτώσεις
αντένδειξης στη χορήγηση IFN-α ή ιστορικού μη ανταπόκρισης σε προηγούμενη θεραπεία,
οι τρεις παράγοντες μπορεί να χορηγηθούν ως αρχική θεραπεία.
Όταν η ALT παραμένει φυσιολογική ή ελαφρώς αυξημένη (<2xΑΦΤ) δεν πρέπει να
χορηγείται θεραπεία. Σε περιπτώσεις με παροδικές αυξήσεις των τρανσαμινασών
ή ελαφρώς αυξημένες τιμές, μπορεί να γίνεται βιοψία ήπατος και ο ασθενής να
λαμβάνει θεραπεία, εφόσον πρόκειται για μέτρια ή σοβαρή φλεγμονή. Ιολογική ανταπόκριση
αναφέρεται σε λιγότερο από 10% των ασθενών με φυσιολογικές τρανσαμινάσες μετά
τη χορήγηση IFN-α17 ή ΛΑΜ [18].
Παιδιά με ALT >2xΑΦΤ πρέπει να λάβουν θεραπεία εφόσον παραμένει σε αυτό το
επίπεδο για περισσότερο από 6 μήνες. Στον παιδικό πληθυσμό με χρόνια ηπατίτιδα
Β, η χορήγηση IFN-α [19] και ΛΑΜ [20] έχει οδηγήσει σε μεγαλύτερη ιολογική ανταπόκριση
σε σύγκριση με την ομάδα ελέγχου.
Β. Ασθενείς
HBeAg αρνητικοί
Στους ασθενείς αυτής της κατηγορίας πρέπει να χορηγείται θεραπεία όταν παρουσιάζουν:
HBV DNA >105 copies/ml, αυξημένη ALT >2 φορές του φυσιολογικού ή μέτρια
προς σοβαρή ηπατίτιδα στη βιοψία ήπατος [11]. Σημειωτέον ότι οι τρανσαμινάσες
παρουσιάζουν σημαντικές διακυμάνσεις και δεν αποκλείεται ο ασθενής να εμφανίζει
σε μερικές μετρήσεις επίπεδα ALT εντός φυσιολογικών ορίων, ενώ η βιοψία ήπατος
δείχνει σημαντική φλεγμονή, απότοκη πρόσφατης ενεργοποίησης. Η θεραπεία μπορεί
να αρχίσει με IFN-α, ΛΑΜ η ΑΝΤΕ [21-23]. Το επίπεδο του HBV DNA στον ορό δεν
είναι επαρκώς τεκμηριωμένο και απαιτείται περισσότερη έρευνα για τον καθορισμό
του επίπεδου της ιαιμίας που σχετίζεται με ενεργό νόσο και δυσμενή εξέλιξη στην
HΒeAg(-) χρόνια ηπατίτιδα Β.
Γ. Ανενεργοί
φορείς
Στους ασθενείς που βρίσκονται στη φάση της ανενεργού φορίας δεν ενδείκνυται
η χορήγηση θεραπείας, γιατί η πρόγνωσή τους είναι πολύ καλή και το ποσοστό κάθαρσης
του HBsAg με τη θεραπεία είναι μηδαμινό. Οι ασθενείς αυτοί θα πρέπει να παρακολουθούνται
με συχνές μετρήσεις των τρανσαμινασών και του IgM anti-HBc.
Δ. Μη ανταπόκριση
σε θεραπεία με IFN-a
Ασθενείς που δεν ανταποκρίθηκαν στη θεραπεία με IFN-α μπορούν να λάβουν ΛΑΜ
ή ΑΝΤΕΦ [24].
Ε. Έξαρση της
λοίμωξης κατά τη διάρκεια θεραπείας με λαμιβουδίνη
Στους ασθενείς που αναπτύσσεται φαινόμενο διαφυγής με συνοδό έξαρση της νόσου
κατά τη διάρκεια θεραπείας με ΛΑΜ, πρέπει να χορηγείται ΑΝΤΕ25, ιδιαίτερα στην
περίπτωση μη αντιρροπούμενης κίρρωσης, υποτροπή της ηπατίτιδας μετά τη μεταμόσχευση
ή σε περιπτώσεις με ταυτόχρονη χορήγηση ανοσοκατασταλτικής θεραπείας.
ΣΤ. Μη αντιρροπούμενη
κίρρωση
Ασθενείς με μη αντιρροπούμενη κίρρωση μπορούν να λαμβάνουν ΛΑΜ26 ή ΑΝΤΕΦ27.
Η καταστολή του ιικού πολλαπλασιασμού βελτιώνει την ηπατική λειτουργία [26,27,28].
Πολλές φορές μάλιστα, η μεταμόσχευση ήπατος γίνεται λιγότερο επείγουσα ή μη
απαραίτητη λόγω της σημαντικής βελτίωσης της ηπατικής λειτουργίας. Παρόλα αυτά,
η ανάπτυξη ιικής αντοχής οδηγεί σε ταχεία και όχι σπάνια σε σοβαρή αναζωπύρωση
της νόσου, απειλητικής για τη ζωή του ασθενούς [26]. Είναι ασαφές εάν θα πρέπει
να χορηγείται θεραπεία σε ασθενείς με χαμηλό ιικό φορτίο. Η IFN-α δεν θα πρέπει
να χορηγείται σε ασθενείς με μη αντιρροπούμενη κίρρωση.
Η. Ειδικές ομάδες
ασθενών
1. Εργαζόμενοι στο χώρο της υγείας
Η θεραπευτική παρέμβαση ενδέχεται να μειώσει τον κίνδυνο μετάδοσης της νόσου
από το ιατρικό προσωπικό σε ασθενείς κατά τη διάρκεια χειρουργικών ή άλλων επεμβάσεων,
αλλά δεν υπάρχουν δεδομένα για το επίπεδο του HBV DNA κάτω από το οποίο η μετάδοση
είναι μηδενική [8].
2. Εξω-ηπατικές εκδηλώσεις
Μερικοί ασθενείς ενδέχεται να ωφεληθούν από τη χορήγηση IFN-α, αλλά λίγα είναι
ακόμη τα δεδομένα για τη χρήση των νουκλεοσιδικών αναλόγων [8].
3. Συν-λοίμωξη με άλλους ιούς
Στους ασθενείς με συν-λοίμωξη HBV/ΗΙV φαίνεται ότι η ΛΑΜ, καθώς και νεότερα
νουκλεοσιδικά ανάλογα, έχουν ένδειξη [29,30].
HBV/ΗCV: Η συν-λοίμωξη στις περιπτώσεις αυτές χαρακτηρίζεται από επικράτηση
του ενός ιού, συνήθως του HCV. Η θεραπεία πρέπει να στοχεύει τον ιό που επικρατεί.
Λίγες είναι οι υπάρχουσες πληροφορίες για την αποτελεσματικότητα της θεραπείας
σε αυτή την κατηγορία των ασθενών.
Στη χρόνια HBV/ΗDV συν-λοίμωξη, θεραπεία συνιστάται στις περιπτώσεις με μέτρια
προς σοβαρή ηπατίτιδα. Η βιοχημική ύφεση συνοδεύεται από ιστολογική βελτίωση.
Η ΛΑΜ είναι αναποτελεσματική, ενώ η ΑΝΤΕ δεν έχει δοκιμαστεί. Η IFN-α είναι
ο μόνος παράγοντας που έχει δοκιμαστεί και φαίνεται να είναι αποτελεσματικός.
4. Ασθενείς σε αιμοδιάλυση
Δεν έχει διευκρινιστεί σε ποια έκταση η σχετική με την ηπατική πάθηση νοσηρότητα
και η θνητότητα είναι αυξημένες στους ασθενείς με λοίμωξη από τον ιό της ηπατίτιδας
Β.
5. Ασθενείς σε ανοσοκαταστολή
Οι ασθενείς που υποβάλλονται σε μεταμόσχευση νεφρού ή καρδιάς και έχουν χρόνια
ηπατίτιδα Β, εμφανίζουν μειωμένη επιβίωση. Η IFN-α αντενδείκνυται λόγω του κινδύνου
απόρριψης του μοσχεύματος και της μυελοκαταστολής. Η προληπτική θεραπεία με
νουκλεοσιδικό ανάλογο φαίνεται λογική για ασθενείς που λαμβάνουν μικρά διαστήματα
ανοσοκαταστολής [31].
6. Εγκυμοσύνη
Πιθανώς η λοίμωξη στα νεογνά θα μπορούσε να μειωθεί, εάν δινόταν θεραπεία σε
έγκυες γυναίκες με υψηλά επίπεδα ιαιμίας. Παρόλα αυτά, δεν υπάρχουν αρκετά δεδομένα
μέχρι σήμερα [8,32].
Μεταμόσχευση
ήπατος
Μετά τη μεταμόσχευση, η αναμόλυνση του μοσχεύματος είναι καθολική και συνοδεύεται
με μείωση της επιβίωσης. Τα ποσοστά αναμόλυνσης μειώνονται με την καταστολή
του ιικού πολλαπλασιασμού προ-εγχειρητικά. Έτσι, ο ασθενής με υψηλά επίπεδα
HBV στον ορό πρέπει να λαμβάνει αντιική θεραπεία προ της μεταμόσχευσης [33].
Η αντιική αγωγή με ΛΑΜ και χορήγηση HBIG έχει δώσει μέχρι σήμερα τα καλύτερα
αποτελέσματα στη μείωση της μετα-μεταμόσχευση ηπατίτιδας Β.
Συμπεράσματα
Η χορήγηση θεραπείας της ηπατίτιδας Β απαιτεί προσεκτική επιλογή των ασθενών.
Η ΙFN-α χορηγείται για συγκεκριμένο χρονικό διάστημα, δεν συνοδεύεται από ανάπτυξη
φαινομένου διαφυγής, αλλά χαρακτηρίζεται από σημαντικές παρενέργειες. Η ΛΑΜ
είναι άριστα ανεκτή και ιδιαίτερα ασφαλής, αλλά σχετίζεται με μεταλλαγές και
με το φαινόμενο διαφυγής. Η ΑΝΤΕ κοστίζει περισσότερο από τη ΛΑΜ, είναι όμως
αποτελεσματική στην αντιμετώπιση των μεταλλαγμένων στελεχών στη λαμιβουντίνη
και έχει μικρό ποσοστό διαφυγής.
Σε ασθενείς με οξεία ηπατίτιδα δεν είναι απαραίτητη η αντιική θεραπεία.
Ασθενείς με οξεία ηπατική ανεπάρκεια θα πρέπει να μεταμοσχεύονται.
Ασθενείς με ήπια ηπατίτιδα πρέπει να λαμβάνουν θεραπεία όταν υπάρχει ένδειξη
εξέλιξης σε μέτρια ή σοβαρή ηπατίτιδα. Ασθενείς με μη αντιρροπουμένη κίρρωση
θα πρέπει να θεραπεύονται σε ηπατολογικές μονάδες που συνδέονται με κέντρα μεταμόσχευσης.
Προφυλακτική θεραπεία πρέπει να χορηγείται σε όλους τους ασθενείς που έχουν
ενταχθεί σε λίστα μεταμόσχευσης, ενώ χορήγηση νουκλεοσ(τ)ιδικού αναλόγου είναι
απόλυτα ενδεδειγμένη μετά τη μεταμόσχευση.
Δοσολογικά σχήματα
ΙFN-α χορηγείται παρεντερικά με υποδόρια ένεση
1. Ενήλικες, 5 ημερησίως ή 10ΜU τρις εβδομαδιαίως.
2. Παιδιά, 6MU/m2 τρις εβδομαδιαίως.
3. Στην HΒeAg(+) ηπατίτιδα Β, 16 εβδομάδες θεραπεία.
4. Στην ΗΒeAg(-) ηπατίτιδα Β, 12 μήνες θεραπεία.
Λαμιβουντίνη χορηγείται από του στόματος
1. Ενήλικες με φυσιολογική νεφρική λειτουργία και HIV(-), 100mg ημερησίως.
2. Παιδιά, 3mg/Kg ημερησίως, με μέγιστη δόση τα 100mg.
3. Στην HΒeAg(+) ηπατίτιδα Β, για τουλάχιστον 12 μήνες θεραπεία. Μπορεί να συνεχιστεί
για μεγαλύτερο διάστημα όταν δεν έχει επιτευχθεί ορομετατροπή. Συνέχιση για
3-6 μήνες μετά την ορομετατροπή.
4. Στην HΒeAg(-) ηπατίτιδα Β, για >12 μήνες θεραπεία. Δεν έχει καθοριστεί
η ιδανική διάρκεια θεραπείας.
Αντεφοβίρη χορηγείται από του στόματος
1. Σε ενήλικες με φυσιολογική νεφρική λειτουργία, 10mg ημερησίως.
2. Στην HΒeAg(+) ηπατίτιδα Β, για τουλάχιστον 12 μήνες θεραπεία.
3. Στην HΒeAg(-) ηπατίτιδα Β για >12 μήνες θεραπεία. Δεν έχει καθοριστεί
η ιδανική διάρκεια θεραπείας.
Δεν έχει επίσης καθοριστεί η διάρκεια θεραπείας για τις περιπτώσεις με φαινόμενο
διαφυγής στη λαμιβουντίνη. Μακρόχρονη θεραπεία πρέπει να χορηγείται στους ασθενείς
με μη αντιρροπούμενη νόσο ή αναμόλυνση μοσχεύματος.
Βιβλιογραφία
1. Lai CL, Ratziu V, Yuen MF, Poynard T. Viral hepatitis B. Lancet 2003; 362(9401):2.089-2.094.
2. Beasley RP. Hepatitis B virus. The major etiology of hepatocellular carcinoma.
Cancer 1988; 61(10):1.942-1.956.
3. Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol 2001;
2(9):533-543.
4. Margolis HS, Alter MJ, Hadler SC. Hepatitis B: evolving epidemiology and
implications for control. Semin Liver Dis 1991; 11(2):84-92.
5. Lok AS, Heathcote EJ, Hoofnagle JH. Management of hepatitis B: 2000-summary
of a workshop. Gastroenterology 2001; 120(7):1.828-1.853.
6. Fattovich G, Brollo L, Giustina G, Noventa F, Pontisso P, Alberti A et al.
Natural history and prognostic factors for chronic hepatitis type B. Gut 1991;
32(3):294-298.
7. Realdi G, Fattovich G, Hadziyannis S, Schalm SW, Almasio P, Sanchez-Tapias
J et al. Survival and prognostic factors in 366 patients with compensated cirrhosis
type B: a multicenter study. The Investigators of the European Concerted Action
on Viral Hepatitis (EUROHEP). J Hepatol 1994; 21(4):656-666.
8. de Franchis R, Hadengue A, Lau G, Lavanchy D, Lok A, McIntyre N et al. EASL
International Consensus Conference on Hepatitis B. 13-14 September, 2002 Geneva,
Switzerland. Consensus statement (long version). J Hepatol 2003; 39(1):S3-25.
9. Fattovich G, Giustina G, Schalm SW, Hadziyannis S, Sanchez-Tapias J, Almasio
P et al. Occurrence of hepatocellular carcinoma and decompensation in western
European patients with cirrhosis type B. The EUROHEP Study Group on Hepatitis
B Virus and Cirrhosis. Hepatology 1995; 21(1):77-82.
10. McMahon BJ, Holck P, Bulkow L, Snowball M. Serologic and clinical outcomes
of 1536 Alaska Natives chronically infected with hepatitis B virus. Ann Intern
Med 2001; 135(9):759-768.
11. Lok AS, McMahon BJ. Chronic hepatitis B: Update of recommendations. Hepatology
2004; 39(3):857-861.
12. EASL International Consensus conference on hepatitis B. J Hepatol 2003;
39:S3-S25.
13. Κέντρο Ελέγχου Ειδικών Λοιμώξεων. Κατευθυντήριες οδηγίες θεραπευτικής παρεμβάσεως
σε ασθενείς με λοίμωξη με τον ιό ηπατίτιδας Β ή C. Aθήνα, 2003.
14. Wong DK, Cheung AM, O'Rourke K, Naylor CD, Detsky AS, Heathcote J. Effect
of alpha-interferon treatment in patients with hepatitis B e antigen-positive
chronic hepatitis B. A meta-analysis. Ann Intern Med 1993; 119(4):312-323.
15. Dienstag JL, Schiff ER, Wright TL, Perrillo RP, Hann HW, Goodman Z et al.
Lamivudine as initial treatment for chronic hepatitis B in the United States.
N Engl J Med 1999; 341(17):1.256-1.263.
16. Marcellin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML et al. Adefovir
dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis
B. N Engl J Med 2003; 348(9):808-816.
17. Lok AS, Wu PC, Lai CL, Lau JY, Leung EK, Wong LS et al. A controlled trial
of interferon with or without prednisone priming for chronic hepatitis B. Gastroenterology
1992; 102(6):2.091-2.097.
18. Chien RN, Liaw YF, Atkins M. Pretherapy alanine transaminase level as a
determinant for hepatitis B e antigen seroconversion during lamivudine therapy
in patients with chronic hepatitis B. Asian Hepatitis Lamivudine Trial Group.
Hepatology 1999; 30(3):770-774.
19. Torre D, Tambini R. Interferon-alpha therapy for chronic hepatitis B in
children: a meta-analysis. Clin Infect Dis 1996; 23(1):131-137.
20. Jonas MM, Kelley DA, Mizerski J, Badia IB, Areias JA, Schwarz KB et al.
Clinical trial of lamivudine in children with chronic hepatitis B. N Engl J
Med 2002; 346(22):1.706-1.713.
21. Manesis EK, Hadziyannis SJ. Interferon alpha treatment and retreatment of
hepatitis B e antigen-negative chronic hepatitis B. Gastroenterology 2001; 121(1):101-109.
22. Hadziyannis SJ, Papatheodoridis GV, Dimou E, Laras A, Papaioannou C. Efficacy
of long-term lamivudine monotherapy in patients with hepatitis B e antigen-negative
chronic hepatitis B. Hepatology 2000; 32(4 Pt 1):847-851.
23. Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, Chang TT, Kitis G, Rizzetto
M et al. Adefovir dipivoxil for the treatment of hepatitis B e antigen-negative
chronic hepatitis B. N Engl J Med 2003; 348(9):800-807.
24. Schiff ER, Dienstag JL, Karayalcin S, Grimm IS, Perrillo RP, Husa P et al.
Lamivudine and 24 weeks of lamivudine/interferon combination therapy for hepatitis
B e antigen-positive chronic hepatitis B in interferon nonresponders. J Hepatol
2003; 38(6):818-826.
25. Xiong X, Flores C, Yang H, Toole JJ, Gibbs CS. Mutations in hepatitis B
DNA polymerase associated with resistance to lamivudine do not confer resistance
to adefovir in vitro. Hepatology 1998; 28(6):1.669-1.673.
26. Manolakopoulos S, Karatapanis S, Elefsiniotis J, Mathou N, Vlachogiannakos
J, Iliadou E et al. Clinical course of lamivudine monotherapy in patients with
decompensated cirrhosis due to HBeAg negative chronic HBV infection. Am J Gastroenterol
2004; 99(1):57-63.
27. Schiff ER, Lai CL, Hadziyannis S, Neuhaus P, Terrault N, Colombo M et al.
Adefovir dipivoxil therapy for lamivudine-resistant hepatitis B in pre- and
post-liver transplantation patients. Hepatology 2003; 38(6):1.419-1.427.
28. Fontana RJ, Hann HW, Perrillo RP, Vierling JM, Wright T, Rakela J et al.
Determinants of early mortality in patients with decompensated chronic hepatitis
B treated with antiviral therapy. Gastroenterology 2002; 123(3):719-727.
29. Benhamou Y, Bochet M, Thibault V, Calvez V, Fievet MH, Vig P et al. Safety
and efficacy of adefovir dipivoxil in patients co-infected with HIV-1 and lamivudine-resistant
hepatitis B virus: an open-label pilot study. Lancet 2001; 358(9283):718-723.
30. Nelson M, Portsmouth S, Stebbing J, Atkins M, Barr A, Matthews G et al.
An open-label study of tenofovir in HIV-1 and Hepatitis B virus co-infected
individuals. AIDS 2003; 17(1):F7-10.
31. Lau GK, He ML, Fong DY, Bartholomeusz A, Au WY, Lie AK et al. Preemptive
use of lamivudine reduces hepatitis B exacerbation after allogeneic hematopoietic
cell transplantation. Hepatology 2002; 36(3):702-709.
32. van Zonneveld M, van Nunen AB, Niesters HG, de Man RA, Schalm SW, Janssen
HL. Lamivudine treatment during pregnancy to prevent perinatal transmission
of hepatitis B virus infection. J Viral Hepat 2003; 10(4):294-297.
33. Samuel D, Muller R, Alexander G, Fassati L, Ducot B, Benhamou JP et al.
Liver transplantation in European patients with the hepatitis B surface antigen.
N Engl J Med 1993; 329(25):1.842-1.847.