Eθισμός
στο κάπνισμα:
υπάρχει γενετική προδιάθεση;
ΤΣΑΡOΥΧΑ ΑΙΜΙΛΙΑ[1],
ΤΣΙΓΚOΥ ΕΥΔOΞΙΑ[2]
[1]Πνευμονολόγος, Επιμελητής Β', 8η Πνευμονολογική Kλινική ΝΝΘΑ
[2]Πνευμονολόγος, Εξειδίκευση σε ΜΕΘ, Nοσοκομείο ΚΑΤ
Παρά τις εντατικές
εκστρατείες περιορισμού του καπνίσματος στις περισσότερες ανεπτυγμένες χώρες,
το ποσοστό των καπνιστών παραμένει ανησυχητικά υψηλό. Στην Αμερική υπολογίζεται
ότι 3.000 έφηβοι ξεκινούν το κάπνισμα κάθε ημέρα, πολλοί από τους οποίους γίνονται
συστηματικοί καπνιστές μέχρι την ενηλικίωση τους. Αναμφισβήτητα, βασικό ρόλο
παίζουν κοινωνικοί και περιβαλλοντικοί παράγοντες, τόσο για την έναρξη της καπνιστικής
συνήθειας, όσο και για την ανάπτυξη εθισμού. Όπως φαίνεται όμως, υπάρχουν σοβαρές
ενδείξεις για τη συμμετοχή και γενετικών παραγόντων στις παραπάνω διεργασίες.
Υπολογίζεται μάλιστα ότι, οι γενετικοί παράγοντες ευθύνονται σε ποσοστό 50%
περίπου. Κατανόηση των γενετικών μηχανισμών που ρυθμίζουν την εξάρτηση, θα βοηθούσε
όχι μόνο θεωρητικά, αλλά και πρακτικά, δημιουργώντας τη βάση για εξατομικευμένες
θεραπείες διακοπής του καπνίσματος.
Ο καπνιστής καπνίζει γιατί το κάπνισμα του προκαλεί ευχαρίστηση. Το ευχάριστο
συναίσθημα συνδέεται με τη διέγερση ντοπαμινεργικών οδών, όπως συμβαίνει και
με τον εθισμό σε ποικίλες και μη σχετιζόμενες φαρμακολογικά ουσίες, όπως τα
οπιοειδή, η κάνναβη, η κοκαΐνη και το αλκοόλ. Οι παραπάνω ουσίες διεγείρουν
υποδοχείς στα κυτταρικά σώματα των ντοπαμινεργικών υποδοχέων, με την ακόλουθη
διέγερση των μετασυναπτικών υποδοχέων ντοπαμίνης να ευθύνεται, σε μεγάλο βαθμό,
για το αίσθημα απόλαυσης που προκαλεί η κατανάλωση των ουσιών αυτών. Σύμφωνα
με άλλη διατυπωμένη υπόθεση, οι ντοπαμινεργικές οδοί εμπλέκονται στη συνειδητοποίηση
της γνώσης, που συνδέει το ερέθισμα, δηλαδή το κάπνισμα, με την απόλαυση. Οι
δύο θεωρίες μάλλον συνυπάρχουν και αλληλοσυμπληρώνονται. Εκτός από τη ντοπαμίνη,
φαίνεται ότι εμπλέκονται στην ανάπτυξη εθισμού και άλλοι νευρομεταβιβαστές,
όπως είναι η σεροτονίνη, το γάμμα-αμινο-βουτυρικό οξύ (GABA), το γλουταμινικό
οξύ και η νοραδρεναλίνη.
Εδώ τίθεται ένα ενδιαφέρον ερώτημα. Γιατί, ενώ πολλοί άνθρωποι απολαμβάνουν
το κάπνισμα, ορισμένοι μόνο γίνονται βαρείς χρήστες και ισχυρά εξαρτώμενοι;
Οι μοριακοί μηχανισμοί, που ενεργοποιούνται όταν οι εξαρτημένοι καπνιστές αναπτύσσουν
σύνδρομο στέρησης, προσπαθώντας να διακόψουν το κάπνισμα, θα μπορούσαν να διαφωτίσουν
το παραπάνω φαινόμενο (σχήμα 1). Εδώ θα πρέπει να υπενθυμίσουμε ότι το συστατικό
του καπνού που προκαλεί εξάρτηση, είναι η νικοτίνη.
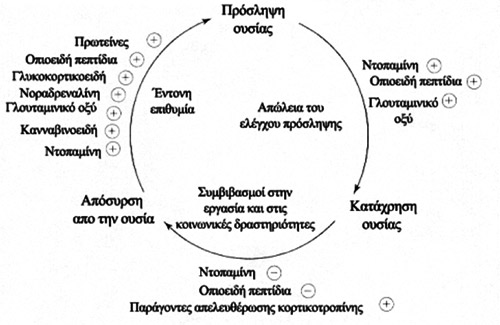
Σχήμα 1. Η εξαρτημένη συμπεριφορά παρουσιάζεται ως κυκλική διεργασία,
όπου η αναμενόμενη απόλαυση από την κατανάλωση του καπνού υπερβαίνει τους ψυχολογικούς
μηχανισμούς που περιορίζουν την κατανάλωση. Καταναλώνονται έτσι μεγάλες ποσότητες
καπνού και όταν τα επίπεδα της νικοτίνης πέφτουν, προκύπτει δυσάρεστο στερητικό
συναίσθημα, που δημιουργεί έντονη ανάγκη κατανάλωσης καπνού. Αναπτύσσεται δηλαδή
ένας κύκλος αυξημένης πρόσληψης. Με την πάροδο του χρόνου αναπτύσσεται ανοχή
στο αίσθημα απόλαυσης, αλλά κατά την προσπάθεια διακοπής τα εξαρτημένα άτομα
ευαισθητοποιούνται εκ νέου στα ηδονικά αποτελέσματα της νικοτίνης (θετικό feedback).
Οι κύκλοι επαναλαμβάνονται στη διάρκεια της ζωής ενός κανονικού καπνιστή και
διαρκούν από λεπτά έως ώρες. Συνεχείς επαναλήψεις του κύκλου οδηγούν σε μεταβολές
των νευρωνικών δομών και τελικά σε διαιώνισή του.
Οι
βιοχημικές μεταβολές που συνοδεύουν τον εθισμό
Μία από
τις κυτταρικές μεταβολές, που εγκαθίστανται μετά από επανειλημμένη έκθεση σε
καπνό, είναι η σύνθεση νέων πρωτεϊνών. Οι κυριότερες από αυτές είναι οι μεταγραφικοί
παράγοντες της οικογένειας Fos, οι οποίοι δρουν αυξάνοντας το ευχάριστο συναίσθημα
που ακολουθεί την εισπνοή του καπνού, ενώ συμβάλλουν και στη δημιουργία αισθημάτων
κατάθλιψης, άγχους και ευερεθιστότητας κατά το χρονικό διάστημα της διακοπής
του καπνίσματος.
Σημαντικό ρόλο στον κύκλο της εξάρτησης, εκτός των μεταβολών της κυτταρικής
βιοχημείας, παίζουν και οι μεταβολές της νευρομεταβίβασης στο συναπτικό επίπεδο.
Η μακρόχρονη λήψη νικοτίνης βλάπτει, όπως φαίνεται, τη ντοπαμινεργική λειτουργία,
πιθανά μέσω down regulation των υποδοχέων ντοπαμίνης.
Έχουν διαπιστωθεί επίσης προσαρμογές στο γλουταμινεργικό σύστημα και στα επίπεδα
νοραδρεναλίνης, οι οποίες πιθανόν να έχουν και αυτές κάποιο ρόλο στον κύκλο
της εξάρτησης.
Γενετικοί
πολυμορφισμοί και προδιάθεση για κάπνισμα
Στο σχήμα 2 συνοψίζονται τα αποτελέσματα των ερευνών που έχουν γίνει, όσον αφορά
στη συσχέτιση γονιδίων και εξάρτησης από το κάπνισμα.
Οι περισσότερες μελέτες είναι μικρές και η σημαντικότητα των αποτελεσμάτων τους
κρίνεται αμφισβητήσιμη. Οι ισχυρότερες ενδείξεις, που μέχρι στιγμής έχουν περιγραφεί,
αφορούν σε γενετικές παραλλαγές του ντοπαμινεργικού συστήματος. Μελετώνται τόσο
οι οδοί σύνθεσης ντοπαμίνης στους νευρώνες και η απελευθέρωσή της στους προσυναπτικούς
νευρώνες, όσο και η ενεργοποίηση υποδοχέων των νευρώνων, καθώς και η επαναπρόσληψη
και ο μεταβολισμός της αμίνης. Ιδιαίτερα σημαντικές είναι αυτές που αφορούν
στον D2 υποδοχέα ντοπαμίνης και το μεταφορέα ντοπαμίνης.
Σε μεγάλη μελέτη οι Caporaso και συνεργάτες βρήκαν ότι ένας πολυμορφισμός στο
3Υ τμήμα του DRD2 γονιδίου (υποδοχέα D2 ντοπαμίνης), είναι δύο φορές συχνότερος
σε καπνιστές, συγκρινόμενος με μη καπνιστές και επίσης απαντάται συχνότερα σε
καπνιστές που ξεκινούν το κάπνισμα σε μικρότερη ηλικία και σε αυτούς που αδυνατούν
να το διακόψουν. Ο πολυμορφισμός προκύπτει από αλλαγή από C σε T στη θέση 32806
του γονιδίου DRD2, αλλά ο ακριβής μηχανισμός, με τον οποίο το αλλήλιο αυτό προδιαθέτει
σε εθισμό στο κάπνισμα δεν είναι γνωστός. Ο πιθανότερος μηχανισμός που προτείνεται
είναι ότι, τα άτομα με ένα ή περισσότερα διαφορετικά αλλήλια DRD2 έχουν μικρότερο
αριθμό ντοπαμινεργικών υποδοχέων στο ραβδωτό σώμα, κάτι που συνεπάγεται και
ανάλογες μεταβολές στην κεντρική ντοπαμινεργική οδό. Αυτό σημαίνει μειωμένη
αντίληψη ηδονής, κατάσταση που μπορεί να βελτιωθεί μόνο με υψηλά επίπεδα νικοτίνης.
Και αυτό επειδή, όπως είναι γνωστό, η νικοτίνη προκαλεί έκκριση ντοπαμίνης,
επαναφέροντας έτσι τα φυσιολογικά επίπεδα του νευρομεταβιβαστή. ΚατΥ αυτόν τον
τρόπο, το αλλήλιο θα μπορούσε να προδιαθέσει σε ανάπτυξη εθισμού στη νικοτίνη.
Αν και αυτή είναι η επικρατούσα θεωρία, το αντίθετο θα μπορούσε επίσης να συμβαίνει,
δηλαδή το αλλήλιο να αυξάνει τη ντοπαμινεργική μεταφορά, καθιστώντας έτσι το
άτομο ιδιαίτερα ευαίσθητο στα ευχάριστα αποτελέσματα της νικοτίνης, εφόσον αυξάνεται
η απελευθέρωση ντοπαμίνης.
Παρόμοια δράση προτείνεται για αλλήλιο γονιδίου του μεταφορέα ντοπαμίνης. Στην
περίπτωση αυτή, το αλλήλιο (SLC6A3-9) φαίνεται να προστατεύει από τον εθισμό
στη νικοτίνη. Ο μηχανισμός που πιθανολογείται είναι, μάλλον, μέσω της αύξησης
της ντοπαμινεργικής μεταφοράς, εξουδετερώνοντας την ανάγκη της αύξησης μέσω
της νικοτίνης.
Το αλλήλιο του γονιδίου D4 υποδοχέα της ντοπαμίνης, που σχετίζεται με μειωμένη
παραγωγή cAMP, έχει αναφερθεί επίσης ότι σχετίζεται με την καπνιστική συνήθεια.
Υπάρχουν αρκετές μελέτες πολυμορφισμών ενζύμων με βασικό ρόλο στο μεταβολισμό
της ντοπαμίνης, όπως η μονοαμινοοξειδάση, η ντοπαμίνη-β-υδροξυλάση και η κατεχολ-ο-μεθυλτρανσφεράση,
οι οποίες ακόμη δεν έχουν καταλήξει σε σαφή συμπεράσματα.
Από παλαιότερες μελέτες υπήρχαν κάποιες ενδείξεις, για ενοχοποίηση σε εθισμό
πολυμορφισμών του γονιδίου D5 υποδοχέα ντοπαμίνης. Σε πρόσφατη μελέτη από δείγμα
900 καπνιστών, δε βρέθηκε καμία συσχέτιση μεταξύ 4 πολυμορφισμών του γονιδίου
και καπνιστικής συνήθειας - εθισμού.
Από όλα τα ανωτέρω, φαίνεται ο βασικός ρόλος που έχουν οι ντοπαμινεργικές οδοί
στην προκαλούμενη από το κάπνισμα εξάρτηση.
Άλλες μελέτες έχουν επικεντρωθεί στο ρόλο των συνδεδεμένων με τη μεμβράνη ενζύμων
του κυτοχρώματος p450, τα οποία μεταβολίζουν τη νικοτίνη στο ήπαρ. Υπάρχουν
δύο ένζυμα που καταλύουν το μεταβολισμό της νικοτίνης σε κοτινίνη, αν και με
διαφορετικό ρυθμό: τα CYP2A6 και CYP2D6. Η ενεργός περιοχή, η υπεύθυνη για οξείδωση
του υποστρώματος, βρίσκεται πλησίον της μεμβράνης, επιτρέποντας έτσι την πρόσβαση
σε διάφορα λιπόφιλα μόρια. Μεγάλος αριθμός φαρμάκων και τοξινών μεταβολίζεται
κατά αυτόν τον τρόπο, με την ειδικότητα ως προς το υπόστρωμα να εξασφαλίζεται
από τμήματα αμινοξέων σε ειδικές θέσεις αναγνώρισης (παρόμοια με HLA και ανοσοσφαιρίνες).
Οι θέσεις αυτές είναι αρκετά πολυμορφικές και μεταλλάξεις των γονιδίων, που
ρυθμίζουν αυτά τα αμινοξέα, παρατηρούνται συχνά.
Οι μελέτες για το ρόλο των CYP2A6 και CYP2D6 έχουν αμφιλεγόμενα αποτελέσματα,
με τελευταίες όμως ενδείξεις ότι το CYP2A6 είναι μεγαλύτερης σημασίας του CYP2D6.
Όσοι έχουν αδρανή αλλήλια CYP2A6, θα χρησιμοποιούν το CYP2D6 και όσοι έχουν
και τα δύο ένζυμα αδρανή, θα μεταβολίζουν τη νικοτίνη πολύ αργά. Αδρανή αλλήλια
CYP2A6 είναι σπανιότατα σε Ευρωπαίους, απαντώνται όμως σε Ασιάτες. Αυτό σε κάποιες
μελέτες έχει υποστηριχθεί ότι περιορίζει την ανάγκη κατανάλωσης καπνού και σχετίζεται
αρνητικά με την ανάπτυξη εθισμού. Και αυτό αμφισβητήθηκε όμως, καθώς εκτός από
τη δράση τους στο μεταβολισμό της νικοτίνης, τα ένζυμα του κυτοχρώματος επηρεάζουν
και με άλλους τρόπους την ανάπτυξη εξάρτησης στο κάπνισμα. Συγκεκριμένα, το
CYP2D6 μετατρέπει την τυραμίνη, μία πολύ συχνή αμίνη της τροφής, σε ντοπαμίνη.
Ο βασικός τρόπος παραγωγής ντοπαμίνης χρησιμοποιεί βέβαια την τυροσίνη, δεν
μπορεί όμως να αποκλεισθεί και μία λειτουργική ένδεια ντοπαμίνης, από ανεπαρκές
CYP2D6.Σε αυτήν την περίπτωση, ο καπνιστής θα επιζητήσει νικοτίνη για να αυξήσει
τα επίπεδα της ντοπαμίνης του.
Εκτός των παραπάνω, μεταλλάξεις των ενζύμων του κυτοχρώματος φαίνεται ότι επηρεάζουν
και τη θεραπευτική αγωγή απεξάρτησης από το κάπνισμα. Συγκεκριμένα, το CYP2D6
είναι βασικό ένζυμο για το μεταβολισμό φαρμάκων, όπως τα τρικυκλικά αντικαταθλιπτικά
και οι εκλεκτικοί αναστολείς σεροτονίνης, σκευάσματα που συνταγογραφούνται συχνά
ως θεραπείες απεξάρτησης.
Έχει μελετηθεί πολυμορφισμός του γονιδίου της τρυπτοφάνης-υδροξυλάσης, περιοριστικού
ενζύμου του ρυθμού παραγωγής σεροτονίνης, με τη λογική ότι η σεροτονίνη είναι
βασική ουσία για την διαμόρφωση της διάθεσης. Δεν προέκυψε συσχέτιση με την
καπνιστική συνήθεια, βρέθηκε όμως ότι σχετίζεται με την ηλικία έναρξης του καπνίσματος.
Απαιτούνται περισσότερες μελέτες για να καθοριστεί η σημασία αυτού του ευρήματος.
Άλλες πιθανές γονιδιακές συσχετίσεις ισχύουν για αλλήλιο της ντοπαμινο-β-υδροξυλάσης,
βασικού γονιδίου για τη σύνθεση νοραδρεναλίνης. Για τους νευρομεταβιβαστές που
εμπλέκονται στην εξάρτηση από άλλες ουσίες, κυριότερες εκ των οποίων είναι τα
οπιοειδή πεπτίδια και το GABA, απαιτούνται περισσότερες μελέτες. Προς το παρόν
δεν έχει ακόμα διερευνηθεί η ακριβής δράση και αλληλεπίδραση της νικοτίνης με
τον υποδοχέα της στον εγκέφαλο, που δεν είναι άλλος από τον υποδοχέα της ακετυλχολίνης.
Στη βιβλιογραφία αναφέρονται και πολλά άλλα εμπλεκόμενα γονίδια, όπως της χολοκυστοκινίνης,
του μετατρεπτικού ενζύμου αγγειοτενσίνης, ακόμα και του υποδοχέα CD14, οι συσχετίσεις
όμως με την καπνιστική συνήθεια είναι περιορισμένες.
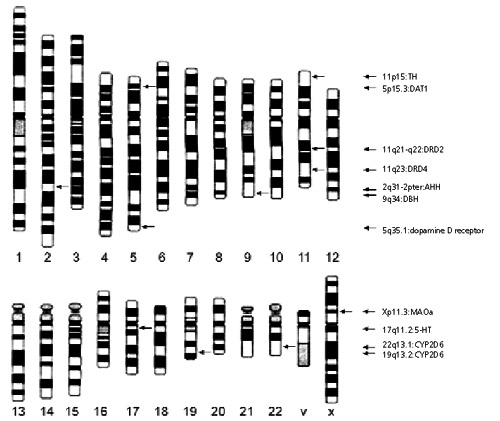
Σχήμα 2.
Μελέτες
συσχετισμών μεταξύ γονιδιακών πολυμορφισμών και της σχέσης τους με την καπνιστική
συνήθεια.
Εξατομικευμένη
θεραπεία και γονίδια
Οι πλέον αποτελεσματικές διαθέσιμες θεραπείες απεξάρτησης από τη νικοτίνη είναι
τα αντικαταθλιπτικά φάρμακα και τα υποκατάστατα νικοτίνης. Τα αντικαταθλιπτικά
φάρμακα και από αυτά κυρίως η νορτρυπτυλλίνη και η βουπροπριόνη, δρουν αναστέλλοντας
την απομάκρυνση των μονοαμινικών νευρομεταβιβαστών από το χώρο της σύναψης,
επαυξάνοντας έτσι τη δράση των μεταβιβαστών. Η δράση τους δεν είναι ειδική για
κάποιο μεταβιβαστή, όμως η νορτρυπτυλλίνη δρα κυρίως επί της νοραδρεναλίνης,
ενώ η βουπροπριόνη επί της ντοπαμίνης. Ο μηχανισμός δράσης των υποκατάστατων
νικοτίνης επίσης δεν είναι γνωστός, θεωρείται όμως ότι δρουν, τα μεν σταθερής
αποδέσμευσης ανακουφίζοντας από τα συμπώματα στέρησης, τα δε ταχείας αποδέσμευσης
αντιμετωπίζοντας το οξύ άγχος από τη στέρηση.
Η κατανόηση των γενετικών μηχανισμών που ελέγχουν την εξάρτηση, θα έδινε ώθηση
σε εξατομικευμένες και κυρίως αποτελεσματικές θεραπείες. Δοθέντος του ρόλου
που έχει ο D2 υποδοχέας ντοπαμίνης στην ανάπτυξη εξάρτησης, φάρμακα που τον
μπλοκάρουν, όπως η τιαπρίδη (αποτελεσματική στην απεξάρτηση από το αλκοόλ),
θα είχαν τη θέση τους σε θεραπείες απεξάρτησης. Ασαφείς ενδείξεις υπάρχουν για
τη δράση των ανταγωνιστών οπιοειδών.
Επιπρόσθετα, τα φάρμακα που χρησιμοποιούνται στην αρχική φάση, ακόμα κι αν αποδειχθούν
αποτελεσματικά για κάποια άτομα, δεν έχουν καμία δράση στην απώτερη φάση, αυτή
της διατήρησης της αποχής από τη νικοτίνη. Εδώ ίσως έχουν θέση σκευάσματα που
μπλοκάρουν το γλουταμινεργικό σύστημα, όπως η ακαμροσάτη, ουσία που έχει αποδειχθεί
αποτελεσματική στη μακροχρόνια αποχή από το αλκοόλ. Επίσης, η βουπροπριόνη και
η τιαπρίδη, που μεταβάλλουν το ντοπαμινεργικό σύστημα, θα έχουν παρόμοια δράση.
Η γνώση των γονιδίων που ευθύνονται για τον εθισμό του κάθε καπνιστή, θα καθόριζε
θεραπευτικά σχήματα 100% αποτελεσματικά. Προς το παρόν, η κάθε είδους θεραπευτική
παρέμβαση είναι μόνο κατά 20% αποτελεσματική. Για παράδειγμα, σε καπνιστές με
ανενεργές αλλήλιο γονιδίου σύνθεσης μεταφορέα ντοπαμίνης, θα είχε αποτέλεσμα
η βουπροπριόνη, που δρα εν μέρει συνδεόμενη με αυτόν το μεταφορέα. Από την άλλη,
άτομα με αδρανές γονίδιο κυτοχρώματος, δεν θα ωφελούνταν από θεραπεία υποκατάστασης
με νικοτίνη μόνο.
Συμπερασματικά, αναφέρεται ότι απαιτείται περισσότερη βασική έρευνα για την
ταυτοποίηση των υπεύθυνων γονιδίων για τον εθισμό, αφού ελάχιστα είναι μέχρι
σήμερα γνωστά. Εκτός όμως από τη βασική έρευνα, θα εξυπηρετούσε παράλληλα και
η ανάπτυξη απλών γενετικών δοκιμασιών για τον καθορισμό του καπνιστικού γονότυπου
κάθε εξαρτημένου καπνιστή. Ο καπνιστικός φαινότυπος θα πρέπει να καθορίζεται
με φυσιολογικές μελέτες και ειδικά ερωτηματολόγια. Ο συνδυασμός φαινότυπου-γονότυπου
όμως, θα μπορούσε να καθορίσει την καλύτερη εξατομικευμένη θεραπεία.
O προσδιορισμός του γονότυπου των εμπλεκόμενων γονιδίων, θα μπορούσε και αυτός
με τη σειρά του να καθορίσει την ακριβή δόση κάποιων αντιεξαρτησιογόνων φαρμάκων.
Συγκεκριμένα, το CYP2D6 καθορίζει το μεταβολισμό κάποιων αντικαταθλιπτικών φαρμάκων,
όπως της νορτρυπτυλίνης, σκευάσματος με συχνές ανεπιθύμητες ενέργειες, που περιορίζουν
τη χορήγηση του. Υπάρχουν δοκιμασίες για τον ακριβή καθορισμό του γονότυπου
του CYP2D6, που είναι σε θέση να προβλέψουν με σχετική ακρίβεια το φαινότυπο
του μεταβολισμού του φαρμάκου. Στο μέλλον, ο ταυτόχρονος προσδιορισμός των CYP2A6
και CYP2D6, θα καθορίσει το ρυθμό μεταβολισμού της νικοτίνης και άρα την ακριβή
δοσολογία και το ρυθμό χορήγησης των αντικαταθλιπτικών, ώστε οι θεραπείες απεξάρτησης
να είναι αποτελεσματικές και ασφαλείς.
Ο απλούστερος τρόπος καθορισμού του γονότυπου των εξαρτημένων καπνιστών, φαίνεται
ότι θα γίνεται με μικρό αριθμό μονήρων πολυμορφικών νουκλεοτιδίων (SNPs) και
θα αποτελεί το χάρτη της μοριακής βάσης του εθισμού τους και ταυτόχρονα το βασικό
σχέδιο θεραπείας τους. Ας δούμε κάποιες βασικές ομάδες καπνιστών, όπως θα διαμορφωθούν
με αυτό τον τρόπο: οι πολυμορφισμοί που επηρεάζουν το ντοπαμινεργικό σύστημα
(DRD2 και DAT1) προκαλούν εθισμό, λόγω της εξάρτησης από τα ηδονικά αισθήματα
που προκαλεί η κατανάλωση καπνού. Άλλοι εθίζονται γιατί δεν μπορούν να αποφύγουν
τα δυσάρεστα συναισθήματα κατά τη φάση της διακοπής, με πιθανότερο ένα γενετικό
υπόβαθρο να επηρεάζει τις κεντρικές οδούς νευρομεταβίβασης, μέσω διεγερτικών
αμινοξέων ή νοραδρεναλίνης. Μία ακόμη ομάδα περιλαμβάνει βαρείς καπνιστές, που
μετά τη διακοπή του τσιγάρου έχουν για χρόνια εντονότατη επιθυμία να καπνίσουν
και οι οποίοι μάλλον έχουν μόνιμες μεταβολές κυτταρικής βιοχημείας.
Φυσικά, οι αλληλεπιδράσεις μεταξύ αυτών των παραγόντων είναι σύνθετες. Για παράδειγμα,
αν η αναζήτηση απόλαυσης από τη νικοτίνη συνυπάρχει με διαταραχές μεταβολισμού
νικοτίνης, το άτομο μπορεί να μη γίνει ποτέ συστηματικός καπνιστής. Οι διαφορετικές
ομάδες των καπνιστών θα απαντούν σε διαφορετικές θεραπευτικές παρεμβάσεις, είτε
αυτές είναι θεραπείες συμπεριφοράς ή φαρμακολογικές.
Η επανάσταση στον τομέα «γονίδια και κάπνισμα» θα είναι, όπως φαίνεται, στο
μέλλον η ανάπτυξη απλών δοκιμασιών για τα SNPs με χρήση PCR.
Βιβλιογραφία
1. Walton R, Johnstone E, Munafo M, Neville M, Griffiths S. Genetic clues to
the molecular basis of tobacco addiction and progress towards personalized therapy.
Trends in Molecular Medicine, Feb 2001; vol 7, no2.
2. Sullivan PF, Neale MC, Silverman MA, Harris-Kerr C, Myakishev MV, Wormley
B, Webb BT, Yunlong M, Kendler KS, Straub RE. An Association Study of DRD5 With
Smoking Initiation and Progression to Nicotine Dependence. American Journal
of Medical Genetics 2001; 105:259-265.
3. Mc Kinney EF, Walton RT, Yudkin P, Fuller A, Haldar NA, Mant D, Murphy M,
Welsh KI, Marshall SE. Association between polymorphisms in dopamine metabolic
enzymes and tobacco consumption in smokers. Pharmacogenetics Aug 2000; 10(6):483-91.
4. Rossing MA. Genetic influence on smoking: candidate genes. Environ Health
Perspect May 1998; 106(5):231-8.
5. Comings DF, Ferry I, Bradshaw-Robinson S, Burchette R, Chin C, Muhleman D.
The dopamine D2 receptor (DRD2) gene: a genetic risk factor in smoking. Pharmacogenetics
Feb 1996; 6(1):73-9.
6. Sabol SZ, Nelson ML, Fisher C, Gunzerath L, Brody CL, Hu S, Sirota LA, Marcus
SE, Greenberg BD, Lucas FR, Benzamin J, Murphy DL, Hamer DH. A genetic association
for cigarette smoking behaviour. Health Psychol Jan 1999; 18(1)7-13.
7. Tyndale RF, Pianezza ML, Seillers EM. A common genetic defect in nicotine
metabolism decreases risk for dependence and lowers cigarette consumption. Nicotine
Tob Res 1999; 1 Suppl2:s63-7.
8. Zabetian CP, Gelernter J, Cubells JF. Functional Variants at CYP2A6: new
genotyping methods, population genetics and relevance to studies of tobacco
dependence. American Journal of Medical Genetics 2000; 96:638-645.
9. Lerman C, Caporaso N, Bush A, Zheng YL, Audrain J, Main D, Shields PG. Tryptophan
Hydroxylase Gene Variant and Smoking Behavior. American Journal of Medical Genetics
2001; 105:518-520.
10. Comings DE, Wu S, Gonzalez N, Iacono WG, McGue M, Peters WW, MacMurray JP.
Cholocystokinin(CCK) Gene as a Possible Risk Factor for Smoking: a Replication
in Two Independent Samples. Molecular Genetics and Metabolism Aug 2001; vol
73-4, p349-353.
11. Hubacek JA, Pitha J, Skodova Z, Poledne R. Is the CD14 receptor gene a marker
for smoking dependence? Med Sci Monit 2002; 8(5):BR172-174.
ΗΟΜΕPAGE

