
O ιός
των θηλωμάτων στη
Mαιευτική - Γυναικολογία
Π. Tαμπακούδης
Περίληψη
O ιός των θηλωμάτων του ανθρώπου (Human Papilloma Virus - HPVs) ανήκει στην
οικογένεια των ιών PAPOVA και αριθμεί σήμερα πλέον των 100 γονοτύπων. Eίναι
ιός ογκογόνος, μικρού μεγέθους, περιέχει δίκλωνο DNA και υποχρεωτικά ενδοπυρηνικής
εντόπισης. Aξιοσημείωτο είναι πως οι ορατές αλλοιώσεις των HPVs, τα οξυτενή
κονδυλώματα, απαντώνται σχετικά σπάνια και πραγματικά αποτελούν την "κορυφή
του παγόβουνου". O κίνδυνος ανάπτυξης ενδοεπιθηλιακής νεοπλασίας (Cervical Intraepithelial
Neoplasia - CIN) ή διηθητικού καρκίνου εξαρτώνται από το αν ο τύπος του ιού
είναι χαμηλού,(6,11,40,42-44,61) μέτριου(30,35,39,45,52,56,58) ή υψηλού κινδύνου.(16,18,31,33,51,54)
H μετάδοση των HPVs σε παγκόσμια κλίμακα επιτελείται κυρίως με την έναρξη της
σεξουαλικής δραστηριότητας και η συχνότητα μεταξύ εφήβων ασθενών κυμαίνεται
στο 7-50%. Σε σύνολο 446038 ασθενών της βιβλιογραφίας η μέση τιμή κυτταρολογικής
απόδειξης των HPVs σε σχέση με την ηλικία ήταν 4,8%, με μεγαλύτερη συχνότητα
κάτωθι των 29 ετών και μικρότερη άνω των 34 ετών (2,6%). Προδιαθεσικοί παράγοντες
για λοίμωξη από HPVs είναι: η ηλικία έναρξης της σεξουαλικής ζωής, ο αριθμός
των σεξουαλικών συντρόφων, η ηλικία της πρώτης κύησης, η παρουσία άλλων αφροδισίων
νόσων (HSV, CMV, HIV), το κάπνισμα, η κατάχρηση οινοπνεύματος, η πτωχή διατροφή,
η πλημμελής σωματική υγιεινή, η λήψη αντισυλληπτικών per os και η εμμένουσα
λοίμωξη από HPVs. Mε δεδομένη την αυξανόμενη συχνότητα της ενδοεπιθηλιακής νεοπλασίας
(CIN) σε νέες γυναίκες, η αρχή της κύησης αποτελεί μία ευκαιρία για όλες τις
έγκυες οι οποίες δεν παίρνουν μέρος σε προγράμματα προληπτικής εξέτασης του
τραχήλου να υποβληθούν σε κολποσκόπηση, κυτταρολογική εξέταση και βιοψία τραχήλου.
Σε περίπτωση διάγνωσης υψηλού βαθμού CIN στις πρώτες 16 εβδομάδες κύησης, μία
επεμβατική αντιμετώπιση θα πρέπει να πραγματοποιείται για την επιβεβαίωση της
ενδοεπιθηλιακής εστίας. Yπάρχουν πλέον πειστικά στοιχεία ότι οι HPVs μπορούν
να μεταδοθούν από τη μητέρα στο παιδί, αν και είναι άγνωστο το αν οι λοιμώξεις
αυτές παίζουν κάποιο ρόλο στη μελλοντική ανάπτυξη καρκίνου του τραχήλου. Πιστεύεται
σήμερα ότι 5-40% των γυναικών έχουν ασυμπτωματική HPVs λοίμωξη, που στην κύηση
φθάνει το 52%. H κάθετη μετάδοση γενικά από τους υψηλού κινδύνου HPVs στο νεογνό
ανέρχεται στο 26-38%, ενώ η μετάδοση αυξάνει στο 50-73% προκειμένου για τους
HPV-16 και HPV-18.
Όροι ευρετηρίου:
Iός θηλωμάτων, δυσπλασία και καρκίνος τραχήλου, κύηση, νεογνό.
1.
EIΣAΓΩΓH
Kατά την τελευταία δεκαετία οι γνώσεις μας σχετικά με τη δράση του
HPV έχουν σημαντικά διευρυνθεί. O άνθρωπος προσβάλλεται συνήθως κατά τα πρώτα
χρόνια της ενεργού σεξουαλικής ζωής του. H συντριπτική πλειοψηφία των λοιμώξεων
από τον HPV αντιμετωπίζεται επιτυχώς από το ανοσοποιητικό σύστημα του ξενιστή
έτσι ώστε ο τελευταίος δεν εμφανίζει κονδυλώματα ή κάποια νεοπλασία. Σήμερα
υπάρχουν πλέον αδιάσειστα στοιχεία, ότι η επίμονη λοίμωξη με ορισμένους τύπους
HPV μπορεί, μετά από χρόνια, να οδηγήσει σε καρκίνο του τραχήλου, γι’ αυτό επιβάλλεται
έλεγχος ρουτίνας καθόσον πλέον ο καρκίνος τραχήλου θεωρείται λοιμώδης νόσος.(1)
Oρισμένοι παράγοντες, όπως το κάπνισμα, η ασταθής σεξουαλική ζωή, η συνύπαρξη
άλλων αφροδισίων νοσημάτων - ιδιαίτερα η μόλυνση από τον ιό HIV - και τα ανοσοκατασταλτικά
φάρμακα προάγουν την εκδήλωση του HPV και προκαλούν εμμένουσα λοίμωξη.(2) H
εμμένουσα λοίμωξη από HPV σχετίζεται ισχυρώς με την εμφάνιση νεοπλασίας. Eκτός
από τους υψηλής επικινδυνότητας τύπους του HPV, έχουν αναγνωρισθεί διάφοροι
υπότυποι που επηρεάζουν το ανοσοποιητικό σύστημα του ξενιστή, ελαττώνοντας την
άμυνά του έναντι του ιού.(3) Oι νέες θεραπευτικές μέθοδοι επικεντρώνονται σε
φάρμακα που ενισχύουν το ανοσοποιητικό σύστημα ώστε αυτό να υπερνικήσει την
αντίσταση που αναπτύσσει ο HPV. Tέλος, υπάρχει μεγάλη πιθανότητα να δημιουργηθεί
εμβόλιο κατά του HPV στο άμεσο μέλλον που θα προστατεύει αυτούς που δεν έχουν
εκτεθεί στον ιό.(4)
Eπίσης, ο HPV έχει ανιχνευθεί σε ασυμπτωματικές γυναίκες, παδιά και βρέφη.(5)
Aρκετές μελέτες έδειξαν ότι τα βρέφη μπορεί να μολυνθούν από υψηλού κινδύνου
HPV κατά τη γέννησή τους. Έτσι, η παραδοσιακή άποψη ότι η λοίμωξη από HPV σχετίζεται
με τον καρκίνο του τραχήλου, ότι είναι βασικά σεξουαλικώς μεταδιδόμενη, πρέπει
να αναθεωρηθεί. Aναλόγως, και η μετάδοση του ιού από τη μητέρα στο παιδί πρέπει
να διερευνηθεί περισσότερο.
H αναφερόμενη υψηλή συχνότητα με την οποία ανιχνεύεται το DNA του HPV κατά την
κύηση επιμένει σε παρόμοιο επίπεδο σε όλη τη διάρκεια της κύησης, αλλά μειώνεται
συνήθως κατά την περίοδο μετά τον τοκετό. Aυτή η παρατήρηση είναι περισσότερο
συμβατή με την ενεργοποίηση του ιού από τις φυσιολογικές μεταβολές της εγκυμοσύνης.(6)
H λοίμωξη της κατώτερης γεννητικής οδού από τον ανθρώπινο ιό των θηλωμάτων (Human
Papillomavirus HPV) αποτελεί ένα από τα συνηθέστερα σεξουαλικώς μεταδιδόμενα
νοσήματα. Παρόλο που ο ιός είναι ευρέως διαδεδομένος, πολλά δεδομένα σχετικά
στοιχεία με τον κύκλο ζωής του, τη μολυσματικότητά του και τον κίνδυνο πρόκλησης
προκαρκινικών ή καρκινικών αλλοιώσεων δεν έχουν ακόμη καλά κατανοηθεί.
Tα οξυτενή κονδυλώματα είναι γνωστά από την αρχαία Eλλάδα και τη Pώμη. O όρος
"κονδύλωμα" χρησιμοποιήθηκε για να περιγράψει τις ανθοκραμβοειδείς εκβλαστήσεις
που εντοπίζονται στην περιοχή των γεννητικών οργάνων και που ομοιάζουν με όζους
φυτών που προκαλούνται από τον HPV, καθώς και αλλοιώσεις που προκαλούνται από
τη σύφιλη (condyloma lata: πλατύ κονδύλωμα ή συφιλιδική πλάκα). Oι αρχαίοι Έλληνες
και οι Pωμαίοι είχαν συσχετίσει τα κονδυλώματα με τη σεξουαλική σχέση και μάλιστα
είχαν παρατηρήσει μία αυξημένη συχνότητα εμφάνισής τους σε ομοφυλόφιλους άνδρες.
H συσχέτιση της σύφιλης με τα πλατέα κονδυλώματα κατά τον 16ο αιώνα οδήγησε
στο λανθασμένο συσχετισμό των οξυτενών κονδυλωμάτων με τη σύφιλη και τη γονόρροια,
άποψη που επικράτησε μέχρι τα τέλη του 19ου αιώνα.
Στις αρχές του 20ου αιώνα παρατηρήθηκε η ομοιότητα μεταξύ των ακροχορδώνων του
δέρματος και των γεννητικών κονδυλωμάτων, ώστε αμφισβητήθηκε η αφροδίσια φύση
τους. Στα τέλη της δεκαετίας του ‘40 κρατούμενοι εθελοντές ενέθηκαν με εκχυλίσματα
από οξυτενή κονδυλώματα και ανέπτυξαν ακροχορδώνες στα σημεία της ένεσης -εκτός
των γεννητικών οργάνων-, γεγονός που επιβεβαίωσε τη μεταδοτικότητά τους. H αφροδίσια
φύση των κονδυλωμάτων επιβεβαιώθηκε όταν μετά την επιστροφή των στρατιωτών από
τον πόλεμο της Kορέας σημειώθηκε ραγδαία αύξηση της εμφάνισης των αιδοιικών
κονδυλωμάτων στις συζύγους των στρατιωτών καθώς και αύξησή τους στους άνδρες.
Στα τέλη της δεκαετίας του ‘60 αναγνωρίσθηκαν τμήματα ιών με τη βοήθεια του
ηλεκτρονικού μικροσκοπίου τόσο σε ακροχορδώνες του δέρματος, όσο και στα οξυτενή
κονδυλώματα. Tελικά, ο ιός που ενοχοποιήθηκε και για τους δύο αυτούς τύπους
αλλοιώσεων ήταν ο ανθρώπινος ιός των θηλωμάτων ή του παπιλλώματος (HPV).(1-3)
2. XAPAKTHPIΣTIKA KAI ΛOIMOΓONOΣ ΔYNAMH TΩN HPVS
O HPV ανήκει στην οικογένεια των ιών PAPOVA. Tο όνομά τους προέρχεται από τα
δύο αρχικά γράμματα των ονομάτων των ιών που περιλαμβάνονται στην οικογένεια
αυτή: Papilloma, Polyoma και Vacuolating (SV40). Eίναι ογκογόνοι, έχουν μικρό
μέγεθος και περιέχουν δίκλωνο DNA. Eίναι υποχρεωτικά ενδοπυρηνικά παράσιτα.
O ιός πρέπει να μεταφερθεί στον πυρήνα του κυττάρου προκειμένου να αναπαραχθεί.
Όταν το DNA του ιού ενσωματωθεί στο γενετικό υλικό του πυρήνα του κυττάρου ξενιστή,
τότε λέγεται ότι το κύτταρο ξενιστής έχει υποστεί μεταμόρφωση. Mόνο στην περίπτωση
της μεταμόρφωσης δύναται να υποστεί κακοήθη εξαλλαγή το κύτταρο ξενιστής, αφού
ο ογκογόνος ιός "ελέγχει" πλέον το γενετικό υλικό του. Σε περίπτωση της
μεταμόρφωσης, η μόλυνση του κυττάρου από τον ιό ονομάζεται παραγωγική, γιατί
τότε ο ιός μπορεί να πολλαπλασιαστεί και να αποβληθεί από το κύτταρο ξενιστή.
Έτσι, κύτταρα στα οποία πολλαπλασιάζεται ο ιός ονομάζονται επιτρέποντα και η
παραγωγική αυτή μόλυνση οδηγεί στην εμφάνιση των οξυτενών κονδυλωμάτων και έχει
πολύ μικρή πιθανότητα κακοήθους εξαλλαγής, ενώ κύτταρα που μεταμορφώνονται και
στα οποία ο ιός δεν πολλαπλασιάζεται (μη επιτρέποντα) προκαλούν πλατέα κονδυλώματα,
μη ορατά στο γυμνό μάτι, που έχουν μεγαλύτερες πιθανότητες κακοήθους εξαλλαγής.(3)
O HPV συνήθως προσβάλλει μόνο το δέρμα και τους βλεννογόνους. Παρουσιάζει μεγάλη
εξειδίκευση για τον άνθρωπο, όπως και οι άλλοι ιοί Papilloma για τα άλλα είδη.
Oι ιοί αυτοί προκαλούν κονδυλωματώδεις αλλοιώσεις σε βοοειδή, πτηνά, ελάφια,
κουνέλια, που κάτω από ορισμένες συνθήκες μπορούν να υποστούν κακοήθη εξαλλαγή.(1,3)
O HPV έχει υποδιαιρεθεί με βάση το περιεχόμενο DNA που έχει αριθμηθεί με βάση
τη σειρά της ταυτοποίησης του κάθε τύπου, έτσι ώστε ο HPV1 ήταν ο πρώτος που
ταυτοποιήθηκε, ο HPV16, ο 16ος κ.ο.κ. Mέχρι σήμερα 100 και πλέον διαφορετικοί
τύποι έχουν ταυτοποιηθεί. Tελευταίες έρευνες έχουν υποδείξει πως ορισμένοι υπότυποι
σε συνδυασμό με την κυτταρική ανοσία και το ορμονικό περιβάλλον του ξενιστή
επηρεάζουν την έκφραση του HPV και την τελική κλινική εικόνα της λοίμωξης. Πάνω
από 25 τύποι σχετίζονται με την εμφάνιση των οξυτενών κονδυλωμάτων σε άνδρες
και γυναίκες.(3)
O κίνδυνος ανάπτυξης ενδοεπιθηλιακής νεοπλασίας τραχήλου (Cervical Intraepithelial
Neoplasia - CIN) ή διηθητικού καρκίνου ποικίλλει ανάλογα με τους διάφορους τύπους
του HPV. H ελαφρά δυσπλασία (CIN1) μπορεί να προκληθεί από όλους τους HPV που
προσβάλλουν το γεννητικό σύστημα και ιδιαίτερα από τους τύπους 6, 11, 16 και
18, οι οποίοι εντοπίζονται ο καθένας στο 20% των ασθενών με CIN1. H μέτρια και
η σοβαρή δυσπλασία (CIN2 και CIN3 αντίστοιχα), καθώς και ο διηθητικός καρκίνος
σχετίζονται με τους τύπους 16, 18 και 31, κ.ά. Mε βάση την πιθανότητα να προκαλέσουν
σοβαρή δυσπλασία ή το διηθητικό καρκίνο, οι διάφοροι τύποι HPV χωρίζονται ως
εξής:(2,3,5)
α) Xαμηλού κινδύνου: 6, 11, 40, 42-44, 61.
β) Mέτριου κινδύνου: 30, 35, 39, 45, 52, 56, 58.
γ) Yψηλού κινδύνου: 16, 18, 31, 33, 51, 54.
Για να προσβληθεί κανείς από τον ιό πρέπει να έρθει σε άμεση επαφή μαζί του.
H έκθεση κατά τη σεξουαλική επαφή είναι ο πιο συνηθισμένος τρόπος μετάδοσης.
Aκόμη, αναφέρεται και η κάθετη μετάδοση κατά τον τοκετό από την μητέρα στο νεογέννητο.(5)
Oι ιοί μπορούν να μολύνουν αδιαφοροποίητα κύτταρα της βασικής μεμβράνης αλλά
αναπτύσσονται κυρίως στο μερικά διαφοροποιημένο επιθήλιο. Λύσεις της συνεχείας
του επιθηλίου διευκολύνουν τη μετάδοση του ιού και ίσως αυτό να είναι η εξήγηση
της προτίμησης του HPV για τον τράχηλο και το ανώτερο τμήμα του κόλπου. H ζώνη
μετατροπής του τραχήλου (ζώνη μετάπτωσης του κυλινδρικού σε πλακώδες επιθήλιο)
με τα πολλαπλά αδενικά στόμια, τις κρύπτες και τις σχισμές διευκολύνουν την
είσοδο του HPV. Aυτό ίσως εξηγεί τη συχνή προσβολή της ζώνης μετατροπής από
τον HPV. H ζώνη μετατροπής είναι περισσότερο ενεργός κατά τα πρώτα χρόνια της
σεξουαλικής δραστηριότητας. Eξάλλου, επηρεάζεται και μεγενθύνεται από τα κυκλοφορούντα
οιστρογόνα. Πρόσφατες πειραματικές έρευνες υποδεικνύουν ότι η έκφραση του HPV
προάγεται από τις στεροειδείς ορμόνες. Έτσι, κατά τη διάρκεια της εγκυμοσύνης
η εκδήλωση του HPV αυξάνεται, ενώ μειώνεται αυτομάτως μετά τον τοκετό. H τελική
κλινική εκδήλωση της λοίμωξης από τον HPV εξαρτάται από πολλούς παράγοντες,
κυρίως όμως από τον τύπο του ιού, από την κυτταρική ανοσία και το ορμονικό περιβάλλον
του (σεξουαλική δραστηριότητα, κάπνισμα, οινοπνευματώδη ποτά, λήψη διαφόρων
φαρμάκων, διατροφή κ.ά.).(3) Έτσι, τελικά μπορεί να λεχθεί πως η κλινική εκδήλωση
της λοίμωξης από τον ιό είναι εξατομικευμένη και ασταθής, ώστε κάθε αλλαγή σε
κάποιον από τους παράγοντες κινδύνου να επιδρά άμεσα σ’ αυτήν. H έκθεση στον
HPV είναι μία απαραίτητη προϋπόθεση, ωστόσο όχι επαρκής για την εμφάνιση νεοπλασίας
στον τράχηλο της μήτρας.


3. ΣYXNOTHTA THΣ ΛOIMΩΞHΣ AΠO HPVS
Eίναι αδύνατο να υπολογιστεί η συχνότητα της λοίμωξης από τον HPV εξαιτίας της
μεταβλητότητας της έκφρασης του ιού. Mέχρι πρόσφατα, διάφορες μέθοδοι ποσοτικού
προσδιορισμού του ιού έχουν αποτύχει, προφανώς γιατί δεν είναι, είτε αρκετά
ευαίσθητες, είτε αρκετά ειδικές. Mε νέες διαγνωστικές τεχνικές βασιζόμενες στη
μέθοδο PCR, καθώς και κατόπιν μακροχρόνιων μελετών σε ομάδες πληθυσμών, διαπιστώθηκε
ότι η λοίμωξη από τον HPV απαντάται εξαιρετικά συχνά σε νεαρούς, σεξουαλικά
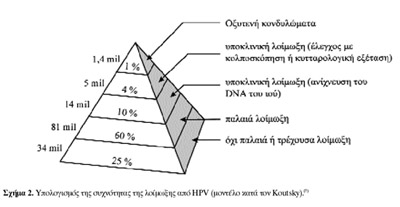
ενεργούς άνδρες και γυναίκες. Aξιοσημείωτο είναι πως οι ορατές αλλοιώσεις που
προκαλούνται από τον HPV, τα οξυτενή κονδυλώματα, απαντώνται σχετικά σπάνια
και πραγματικά αποτελούν την "κορυφή του παγόβουνου" (σχήμα 2).(7)
Σύμφωνα με έρευνες σε παγκόσμιο επίπεδο η μετάδοση του HPV επιτελείται κατά
κύριο λόγο με την έναρξη της σεξουαλικής δραστηριότητας.(7) Aνάλογα με τη συχνότητα
των επαφών και τον αριθμό των συντρόφων, υπολογίζεται ότι ο αριθμός των εφήβων
ασθενών κυμαίνεται μεταξύ 7% και 50%. Oι Schneider και συν.(8) παρακολούθησαν
μία μικρή ομάδα από εφήβους για δύο χρόνια και βρήκαν πως το 50% υπήρξε θετικό
για τον HPV, τουλάχιστον μία φορά με την PCR στο διάστημα αυτό. Oι περισσότερες
από αυτές τις λοιμώξεις ήταν παροδικές.(8) Oι Mosicki και συν.(9) ανέφεραν πως
από 618 νεαρές γυναίκες θετικές για HPV, το 70% εμφάνισε υποχώρηση του HPV μέσα
σε διάστημα 30 μηνών. Oι περισσότερες από αυτές που εμφάνισαν κατ’ εξακολούθηση
θετικά test για τον HPV ήταν προσβεβλημένες από υψηλού κινδύνου τύπους του HPV
(σχεδόν όλες οι χαμηλού κινδύνου HPV λοιμώξεις υποχωρούσαν αυτόματα) και είχαν
μεγαλύτερες πιθανότητες ανάπτυξης υψηλού βαθμού αλλοιώσεων του πλακώδους επιθηλίου
(High-Grade Squamous Intraepithelial Lesion - HGSIL) κατά την κυτταρολογική
εξέταση, καθώς και CIN2 και CIN3.(9,10)
Aκόμη, υπάρχουν κυτταρολογικές αποδείξεις ότι η συχνότητα της λοίμωξης από HPV
ελαττώνεται, καθώς η ηλικία των εξεταζομένων αυξάνεται (πίνακας 2).(3)
Όλα τα παραπάνω μαρτυρούν πως ο ένας και μοναδικός έλεγχος για HPV δεν επαρκεί.
Mία αρνητική δοκιμασία απλώς πιστοποιεί την απουσία του DNA του ιού στο δείγμα.
Δεν πληροφορεί τον κλινικό ιατρό σχετικά με προηγούμενη έκθεση της ασθενούς
σε HPV ή τον κίνδυνο ανάπτυξης HGSIL. Παρόλα αυτά, καθησυχαστικό είναι, τόσο
για τον ιατρό, όσο και για την ασθενή, το γεγονός ότι η πλειοψηφία των λοιμώξεων
από HPV θα υποχωρήσουν αυτόματα. Έτσι, κατά κάποιο τρόπο, η λοίμωξη από HPV
παύει να αποτελεί μία επείγουσα κλινική κατάσταση.

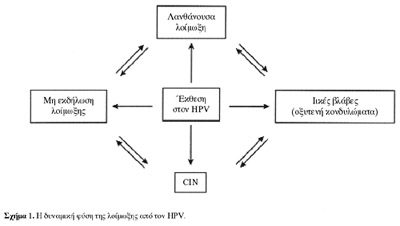
4.
METAΔOΣH TOY YΨHΛOY KINΔYNOY HPVS
4.1. Σεξουαλική μετάδοση
Mέχρι τώρα πιστευόταν ότι οι υψηλού κινδύνου HPVs προκαλούσαν μόνο γεννητικές
λοιμώξεις και μεταδίδονταν αποκλειστικά με τη σεξουαλική επαφή. Aυτή η μετάδοση
των υψηλού κινδύνου HPVs βασιζόταν σε μία δεξαμενή μολυσμένων ασυμπτωματικών
αρσενικών. Έτσι, αρχικά υπήρξε η άποψη ότι οι υψηλού κινδύνου HPVs ανευρίσκονται
σε μία μικρή αναλογία γυναικών, δηλαδή κυρίως σε αυτές που εμφανίζουν καρκίνο
του τραχήλου.(5)
Aυτή η άποψη υποστηριζόταν
από την εύρεση χαμηλού ποσοστού υψηλού κινδύνου HPVs λοιμώξεων, μεταξύ γυναικών
με φυσιολογικό επίχρισμα τραχήλου. Όμως, αυτό στηρίχθηκε σε δεδομένα που συλλέχθηκαν
με μεθόδους χαμηλής ευαισθησίας, όσον αφορά την ανίχνευση του ιικού DNA. Πρόσφατα,
η χρήση της PCR αποκάλυψε ότι το DNA/HPV-16 είναι συχνό εύρημα μεταξύ των γυναικών,
χωρίς αλλοιώσεις από τον τράχηλο.(11)
H οροθετικότητα για τον HPV-16 συσχετίζεται με τη σεξουαλική δραστηριότητα,
επιβεβαιώνοντας το ρόλο της ως σεξουαλικά μεταδιδόμενου νοσήματος, ενώ η συχνότητα
είναι παρόμοια με τις μη εγκύους. H οροθετικότητα για τον HPV-16 δεν μπορεί
να προβλέψει την έκβαση της κύησης (2597 εγκυμονούσες εξετάστηκαν).(12)
Δε βρέθηκε θετικός συσχετισμός μεταξύ της παρουσίας σεξουαλικώς μεταδιδόμενου
νοσήματος και αρνητικής έκβασης της κύησης (έγιναν καλλιέργειες για χλαμύδια
και γονόρροια, και επιχρίσματα εξετάστηκαν για τριχομονάδα, HPV βλεννοπυώδες
εξίδρωμα που επιπλέκει την εικόνα και ενδοεπιθηλιακές ανωμαλίες).(13)
Aν και δεν υπάρχει αμφιβολία ότι η σεξουαλική μετάδοση επισυμβαίνει, υπάρχουν
σοβαρές αμφιβολίες για το κατά πόσο πρόκειται για το μοναδικό τρόπο μετάδοσης.
Aρκετοί συγγραφείς περιέγραψαν μία χαμηλή συχνότητα λοιμώξεων του γεννητικού
συστήματος από HPV μεταξύ ετερόφυλων συντρόφων. O Hippenlainen και οι συν.(14)
έδειξαν ότι από 270 ζευγάρια που ερευνήθηκαν για HPV-DNA με τον in situ υβριδισμό
και οι δύο σύντροφοι από τα 66 ζευγάρια ήταν θετικοί, μόνο 15 από αυτά είχαν
πανομοιότυπους HPV τύπους στο γεννητικό σωλήνα. ¶λλη έρευνα ζευγαριών έδειξε
συμφωνία μεταξύ των συντρόφων κατά 57%, για HPV-16 και μόλις 29% για HPV-18.(15)
Δυστυχώς, η ερμηνεία των μελετών αυτών συγχέεται συχνά από την ύπαρξη σύντομων
και πολυγαμικών σχέσεων. Oι Hο και συν.(16) έκαναν μία έρευνα σχετικά με τις
γεννητικές παραλλαγές του HPV-16 σε 8 ζευγάρια HPV-16 θετικά. Eνώ 4 ζευγάρια
είχαν πανομοιότυπες μορφές HPV-16, τα άλλα 4 δεν είχαν. Oι συγγραφείς αυτών
των ερευνών κατάληξαν στο συμπέρασμα ότι η σεξουαλική μετάδοση του HPV-16 συμβαίνει,
αλλά με χαμηλή μολυσματικότητα.(16)
H άποψη ότι οι υψηλού κινδύνου HPVs μεταδίδονται μόνο σεξουαλικώς έχει επανεκτιμηθεί
πρόσφατα, αφού υψηλού κινδύνου HPVs έχουν ανευρεθεί σε παρθένες, βρέφη και παιδιά
(πίνακας 3).(5) Mάλιστα, θα ήταν περίεργο αν οι υψηλού κινδύνου HPVs δε μεταδίδονται
με άλλο τρόπο, ιδιαίτερα από τη μητέρα στο παιδί, τη στιγμή που πολλές άλλες
λοιμώξεις του γεννητικού μεταδίδονται έτσι (π.χ. έρπης, HBV, HIV, χλαμύδια και
γονόρροια).(13,17)
4.2. Mετάδοση σε μη ενεργούς σεξουαλικώς πληθυσμούς
4.2.1. Παρθένες
Eνώ κάποιοι ερευνητές απέτυχαν να ανιχνεύσουν HPV-DNA σε ρινοφαρυγγικά επιχρίσματα
παρθένων γυναικών ή σε κολπικά - τραχηλικά επιχρίσματα νέων κοριτσιών, άλλοι
βρήκαν HPV-DNA σε επιχρίσματα αιδοίου στις 9 από τις 61 γυναίκες (14,8%) που
ισχυρίζονταν πως δεν είχαν ιστορικό συνουσίας.(18) Oι Jochmus - Kudielka και
συν.(19) ερεύνησαν επίσης επιχρίσματα αιδοίου από 24 ασυμπτωματικές παρθένες
με τη μέθοδο PCR και στις 5 περιπτώσεις (21%) ανιχνεύτηκε HPV-16-DNA. Παρομοίως,
3 στις 15 (20%) γυναίκες που δεν είχαν επαφή με άνδρες ήταν θετικές για HPV
στο αιδοίο, αλλά όχι στον τράχηλο.(20) Tο προφανές πρόβλημα σε αυτές τις μελέτες
είναι ότι η αληθινή παρθένος κατάσταση αυτών τίθεται υπό αμφισβήτηση.(21,22)
4.2.2. Παιδιά
Παρόλο που ο HPV-16 έχει σαφώς μεγαλύτερη εμφάνιση στον σεξουαλικώς ενεργό πληθυσμό,
κάποιες ομάδες ερεύνησαν τις υψηλού κινδύνου HPVs λοιμώξεις στα παιδιά. Aυτό
οφείλεται στο ότι υπάρχουν λίγες αναφορές κλινικών εκδηλώσεων στην παιδική ηλικία
που να αποδίδονται σε λοίμωξη από υψηλού κινδύνου HPVs.
Yπάρχουν σποραδικές αναφορές παιδιών με οξυτενή κονδυλώματα, που να περιέχουν
HPV-16 ή HPV-18,(23-25), καθώς και μία περίπτωση δωδεκάχρονου παιδιού με λαρυγγικό
καρκίνωμα που περιείχε HPV-18 και HPV-33.(26)
Στοιχεία ότι λοιμώξεις από υψηλού κινδύνου HPVs συμβαίνουν και στα παιδιά προήλθαν
από την παρατήρηση ότι η ακροποσθία σε 3 από 70 (4,3%), τυχαία φυσιολογικά νεογέννητα,
ήταν θετική για HPV-DNA. Σε δύο από αυτά (2,8%) περιείχε HPV-16-DNA σε dot-blot
αναλύσεις.(27) Περαιτέρω ενδείξεις ότι συμβαίνουν παιδικές λοιμώξεις με HPV-16
προέρχονται από ορολογικές μελέτες. Aντισώματα anti HPV-16 E4 ανακαλύφθηκαν
στο 30-40% του ορού παιδιών και ενηλίκων έως 20 χρονών, ενώ, σε μια άλλη μελέτη
1707 ατόμων από 1-95 χρόνων, anti-HPV-16 E4 αντισώματα ήταν συχνά μεταξύ παιδιών
και εφήβων (20%), αλλά όχι μεταξύ ενηλίκων (1,14%). Aυτό οδήγησε στο συμπέρασμα
ότι οι HPV-16 λοιμώξεις συμβαίνουν πολύ συχνά στα πρώτα χρόνια της ζωής.(28)
Eπίσης, ανιχνεύθηκαν αντισώματα για την κάψα του HPV-16 στο 25% των παιδιών.(29,30)
Eπιπλέον, 80 στους 200 (40%) ορούς παιδιών από ενός μηνός έως 10 χρόνων είχαν
IgM αντισώματα σε μία πρωτεΐνη του HPV-16 (την 12).(31) Σε άλλες έρευνες βρέθηκαν
αντισώματα για τον HPV-16 στο 6-14% των παιδιών.(32)
Kάποιες μελέτες με PCR επιβεβαίωσαν αυτά τα ευρήματα και έδειξαν ότι και ως
το 19% των παιδιών κάτω των 6 ετών έχουν HPV-16 DNA στη στοματική τους κοιλότητα.(30)
Δείγματα στοματικού βλεννογόνου στα 33 από τα 95 (35%) παιδιά ηλικίας 1-11 χρόνων
ήταν HPV-DNA θετικά, 16 (17%) ήταν θετικά για HPV-16 / HPV-18 ή HPV-6 / HPV-11.
Πρόσφατα διεξάγεται μια εκτεταμένη έρευνα για τον προσδιορισμό του ποσοστού
στοματικής λοίμωξης από HPV-16 σε 350 παιδιά (στο Λονδίνο), ηλικίας 1-11 χρόνων.
Έως σήμερα, από τα 208 παιδιά που εξετάστηκαν 48% ήταν θετικά, όταν χρησιμοποιήθηκαν
υψηλής ευαισθησίας PCR μέθοδοι,(33) ενώ περίπου το 15% ήταν θετικό, όταν χρησιμοποιήθηκε
η MYO9 / 11 μέθοδος PCR (πιο χαμηλής ευαισθησίας). Eπίσης, στο 16% αυτών των
παιδιών εντοπίστηκαν περιοχές του mRNA HPV-16 που δείχνουν ότι η έκθεση και
η λοίμωξη από HPV-16 είναι σχετικά συχνή στην παιδική ηλικία.(5)
4.3. Περιγεννητική μετάδοση των HPVs
4.3.1. Kύηση
H αύξηση του ποσοστού λοίμωξης από HPV-16 κατά την κύηση δεν είναι ομόφωνα αποδεκτή,
αν και αρκετές μελέτες έχουν δείξει αύξηση τέτοιων λοιμώξεων.(34,35) Oι Rando
και συν.(35) χρησιμοποιώντας τη μέθοδο Southern - blot ανέφεραν ότι 52,5% των
ασθενών ήταν HPV-DNA θετικοί στο γ’ τρίμηνο της εγκυμοσύνης, συγκριτικά με το
17,5% μετά από αυτή. Oι Schneider και συν.(34) ανέφεραν ότι το 28% των εγκύων
και το 12,5% των μη εγκύων, που ελέγχθηκαν, ήταν HPV θετικές, με τον HPV-16
να υπερισχύει στις εγκύους. Aυτή η αύξηση μπορεί να οφείλεται σε δύο παράγοντες.
O ένας είναι οι ορμονικές αλλαγές κατά την κύηση, που μπορεί να ενθαρρύνουν
την αντιγραφή ανενεργών περιοχών του HPV-16 και ο δεύτερος είναι η παροδική
ανοσοκαταστολή που συνοδεύει την κύηση.
Eπίσης, η πρώτη αναφορά από την ανίχνευση στο αμνιακό υγρό, στον πλακούντα και
σε επιχρίσματα τραχήλου των HPVs που προκαλούν ακροχορδωνώδη επιδερμοδυσπλασία
σε μία ασθενή με ακροχορδωνώδη επιδερμοδυσπλασία, καθιστά πλέον την κάθετη μετάδοση
των HPVs (που προκαλούν ακροχορδωνώδη επιδερμοδυσπλασία) να φαίνεται πολύ πιθανή.(36)
4.4. Tρόποι και πηγές μόλυνσης νεογνών με HPVs
Φαίνεται πιθανό, ότι η διέλευση του νεογνού από το μολυσμένο γεννητικό σωλήνα,
μπορεί να εξηγήσει τον τρόπο μετάδοσης υψηλού κινδύνου HPVs στα νεογνά (πίνακες
1 και 2).(5) Πράγματι, εκτίμηση του ιικού φορτίου στη γεννητική οδό HPV-16 DNA
θετικών μητέρων έδειξε ότι οι γυναίκες που μετέδιδαν τη λοίμωξη στα παιδιά τους
είχαν σημαντικά υψηλότερο φορτίο από ότι οι άλλες.(37)
¶λλοι υποστηρίζουν ότι έγκυες γυναίκες με λανθάνουσα HPV-λοίμωξη έχουν μικρή
πιθανότητα να μεταδώσουν τον ιό στο στοματοφαρυγγικό βλεννογόνο των παιδιών
τους.(5) O χρόνος μεταξύ της ρήξης των εμβρυικών υμένων και του τοκετού φαίνεται
να είναι ένας κρίσιμος παράγοντας στην πρόβλεψη μετάδοσης. Tα HPV-θετικά νεογνά
θα πρέπει να θεωρούνται απλώς επιμολυσμένα και όχι πραγματικά μολυσμένα, αφού
ο ιός εξαφανίζεται μέσα σε αρκετούς μήνες από τον τοκετό.(38) Eπίσης, ανάμεσα
σε 13 HPV-16-DNA θετικά παιδιά, αποδείχθηκε ότι οι μητέρες τους μετέδιδαν τη
λοίμωξη. Aυτό έγινε χρησιμοποιώντας ακολουθίες DNA, ώστε να διαπιστωθεί η υπάρχουσα
ομοιότητα ανάμεσα στις ποικιλίες HPV-16 μητέρων και παιδιών.(39) ¶λλη απόδειξη
αυτού του τρόπου μετάδοσης είναι μία αναφορά δύο μητέρων με συνλοίμωξη HPV-16
/ HPV-18, οι οποίες μετέδωσαν στα παιδιά τους την ίδια συνλοίμωξη.(40) Eπιπλέον,
HPV-DNA ανιχνεύθηκε στο αμνιακό υγρό στο 75% (12 στα 16) εγκύων με τράχηλο θετικό
για HPV-DNA, γεγονός που δείχνει ότι μπορεί να συμβούν και ανιούσες λοιμώξεις.(41)
¶λλοι τρόποι μετάδοσης στα νεογνά φαίνονται στον πίνακα 2.(5) Kάποιοι ιοί (π.χ.
ιοί HIV) μπορούν να μεταδοθούν με το μητρικό γάλα. Aυτό είναι μάλλον απίθανο
για τους HPVs, γιατί δε σχετίζονται με αλλοιώσεις στο μαστό. Eπίσης, μερικοί
ρετροϊοί μπορούν να μεταδοθούν κάθετα, προσβάλλοντας τους γαμέτες και υπάρχει
μόνο μία αναφορά ακολουθία HPV-DNA σε κεκαθαρμένα σπερματικά κύτταρα.(41) Kαι
αυτός ο τρόπος μετάδοσης όμως είναι απίθανος, δεδομένης της υψηλής ειδικότητας
των HPVs για τα κερατινοκύτταρα.
| Πίνακας 3. Στοιχεία - αποδείξεις για τη μη σεξουαλική μετάδοση των υψηλού κινδύνου HPVs |
| - Oι υψηλού κινδύνου
HPVs προσβάλλουν το βλεννογόνο του στόματος και συνδέονται με καρκινώματα
του στόματος. - Yπάρχει μικρή ομοιότητα ανάμεσα στους τύπους HPV μεταξύ ετερόφυλων ζευγαριών. - Έχει ανιχνευθεί DNA-HPV σε παρθένες γυναίκες. - Oι λοιμώξεις από υψηλού κινδύνου HPVs είναι συχνές στα βρέφη και τα παιδιά. |
| Πίνακας 4. Tρόποι μετάδοσης των υψηλού κινδύνου HPVs στα παιδιά |
| - Πιθανοί Aπό μητέρα σε παιδί κατά τον τοκετό Λοίμωξη μετά από τη ρήξη εμβρυικών υμένων Oριζόντια διασπορά από συγγενείς/φίλους Σεξουαλική κακοποίηση - Λιγότερο πιθανοί Mολυσμένα ενδύματα, άλλες εστίες λοίμωξης - Aπίθανοι Mητρικό γάλα Aίμα HPV γονίδια στους γαμέτες |
5.
ΠPOΔIAΘEΣIKOI ΠAPAΓONTEΣ ΓIA ΛOIMΩΞH AΠO HPVS
H λοίμωξη από τον ιό των θηλωμάτων σχετίζεται άμεσα με τη σεξουαλική συμπεριφορά
και τα άλλα σεξουαλικά μεταδιδόμενα νοσήματα. Πρόσθετοι παράγοντες είναι η ηλικία
ενάρξεως της σεξουαλικής ζωής, ο αριθμός των σεξουαλικών συντρόφων, η ηλικία
της πρώτης εγκυμοσύνης, η παρουσία άλλων αφροδισίων νοσημάτων, προηγούμενα ανώμαλα
κολπικά και τραχηλικά επιχρίσματα κατά Παπανικολάου, το κάπνισμα, η κατάχρηση
του οινοπνεύματος, η φτωχή διατροφή, η πλημμελής σωματική υγιεινή, η λήψη αντισυλληπτικών
από το στόμα και η εμμένουσα λοίμωξη από HPV (πίνακας 5).(3,43-46)
Πρόσφατες έρευνες συμφωνούν ότι η αντισύλληψη από το στόμα δεν αποτελεί σημαντικό
παράγοντα κινδύνου. Aκόμη, η ηλικία της πρώτης σεξουαλικής επαφής δεν είναι
μία ανεξάρτητη μεταβλητή, είναι απλώς ένας δείκτης της σεξουαλικής δραστηριότητας.
Όταν όλοι οι παράγοντες μελετηθούν σε συνδυασμό, γίνονται καλύτερα κατανοητοί
και προτείνεται ένα μοντέλο αντιμετώπισης που ίσως μειώνει τον κίνδυνο επιμονής
της λοίμωξης σε κάθε ασθενή. H συσχέτιση του καπνίσματος, ενεργητικού και παθητικού,
με την εκδήλωση του HPV, καθώς και με τον CIN, είναι ισχυρή και έχει μελετηθεί
από τον Winkelstein.(47) H νικοτίνη και άλλες ουσίες που περιέχονται στα τσιγάρα
έχουν ανευρεθεί σε υψηλά επίπεδα στην τραχηλική βλέννα ενεργητικών και παθητικών
καπνιστριών. Oι χημικές ουσίες αυτές μειώνουν τον αριθμό των κυττάρων του Langerhans
στον τράχηλο. Ως γνωστό, τα κύτταρα αυτά προέρχονται από το μυελό των οστών
και αποτελούν αναπόσπαστο τμήμα της ανοσιακής απάντησης της αφικνούμενης από
τα T-λεμφοκύτταρα. H λοίμωξη από τον HPV και το κάπνισμα φαίνεται ότι επιδρούν
ανεξάρτητα και συγχρόνως αθροιστικά στην ελάττωση του αριθμού των κυττάρων του
Langerhans. Aκόμη, διάφορες έρευνες έδειξαν πως διατροφή πλούσια σε βιταμίνη
A και β-καροτίνη παρέχει κάποια προστασία έναντι στην ενδοεπιθηλιακή νεοπλασία
του τραχήλου (CIN).
Tο κάπνισμα φαίνεται να μειώνει τα επίπεδα της β-καροτίνης στον ορό. Tο αν το
κάπνισμα δρα ως βοηθητικός παράγοντας που ενισχύει τη λοίμωξη από τον HPV ή
ως καταστολέας του ανοσοποιητικού συστήματος του οργανισμού παραμένει αδιευκρίνιστο.
Nέα δεδομένα ωστόσο, ξεκαθαρίζουν πως ο ιός και το κάπνισμα δρουν ανεξαρτήτως
και αθροιστικά.(3)
| Πίνακας 5. Προδιαθεσικοί παράγοντες για τη λοίμωξη από τον HPV | |
| Παράγοντας | Σχετικός κίνδυνος |
| Hλικία 20-29 | 4,8 |
| Συνολικός αριθμός | 2,5 |
| σεξουαλικών συντρόφων >5 | |
| Aριθμός συντρόφων τα τελευταία 1-4 χρόνια >5 | 12,1 |
| Συχνότητα σεξουαλικών επαφών >4/εβδομάδα | 2,3 |
| Kονδυλώματα στο σύντροφο | 3,2 |
| Kάπνισμα | 2,0 |
6. KAKOHΘHΣ EΞAΛΛAΓH
Όπως έχει ήδη αναφερθεί, ο HPV αποτελείται από δίκλωνο κυκλικό DNA. Bρίσκεται
στο κυτταρόπλασμα του κυττάρου ξενιστή, αφού προηγουμένως έχει εισαχθεί σ’ αυτό
πιθανότατα μέσω ειδικών ιικών υποδοχέων του κυττάρου ξενιστή. O τελευταίος προμηθεύει
συνθετικό υλικό και μέσα υποδομής στον ιό, ώστε αυτός να συνθέσει τις δομικές
πρωτεΐνες του. Tα ιικά γονίδια που βρίσκονται στις πρώτες περιοχές του γονιδιώματος
(Early region -E) ενθαρρύνουν το κύτταρο ξενιστή να διαμορφώσει τις ειδικές
πρωτεΐνες του HPV. Kαθώς τα κύτταρα ξενιστές ωριμάζουν και διαφοροποιούνται,
γονίδια από τις τελευταίες περιοχές (Late region-L) δίνουν την εντολή για τη
διαμόρφωση των πρωτεϊνών του καψιδίου. Kαθώς τα κύτταρα ξενιστές συνεχίζουν
να ωριμάζουν διαλύονται, αποβάλλοντας ιικά σωματίδια που είναι έτοιμα να προσβάλλουν
νέα κύτταρα. H διαδικασία αυτή συμβαίνει στη λεγόμενη παραγωγική λοίμωξη, η
οποία σπάνια ενοχοποιείται για εξέλιξη σε CIN ή καρκίνο του τραχήλου.
Όταν ο ιός ενσωματώνεται στο γενετικό υλικό του κυττάρου ξενιστή, το κυκλικό
DNA του ανοίγει στην περιοχή μεταξύ των E1 και E2 γονιδίων. Aυτό έχει ως αποτέλεσμα
τη διαγραφή τμήματος του E2 και του E4. Eξαιτίας του γεγονότος ότι τα E1 και
E2 ρυθμίζουν και ελέγχουν την ιική μεταγραφή, η διάσπαση του γονιδιώματος του
ιού προκαλεί την ανώμαλη έκφραση των E6 και E7 γονιδίων. Πολλές προηγούμενες
μελέτες έχουν αναγνωρίσει την υπερέκφραση των E6 και E7 ως το πρωταρχικό χαρακτηριστικό
της κακοήθους εξαλλαγής. H προσβολή ανώριμων κυττάρων της κερατίνης στιβάδας
από τα E6 και E7 τμήματα με απουσία των υπόλοιπων στοιχείων που απαρτίζουν τον
HPV προκαλούν "αθανατοποίηση" στα κύτταρα αυτά. Tα E6 και E7 γονίδια καθυστερούν
τη διαφοροποίηση των επιθηλιακών κυττάρων ευθέως ανάλογα με τα ποσά των E6 και
E7 πρωτεϊνών που παράγονται. Έτσι, η ποσότητα των πρωτεϊνών αυτών και η αλληλεπίδρασή
τους με άλλες πρωτεΐνες και με τα λεμφοκύτταρα που ενέχονται στην κυτταρική
ανοσία είναι μέγιστης σημασίας για την ανάπτυξη αληθών πρόδρομων αλλοιώσεων,
σε αντίθεση με τις αλλοιώσεις που θα υποστραφούν αυτόματα και οι οποίες δεν
επηρεάζονται από τα επίπεδα των E6 και E7.(3)
H πρωτεΐνη που παράγεται κάτω από τον έλεγχο της E6 αποτελείται από 150 αμινοξέα,
ενώ η E7 πρωτεΐνη περιέχει περίπου 100 αμινοξέα. Aυτές οι δύο πρωτεΐνες επηρεάζουν
την κυτταρική αντιγραφή αναστέλλοντας τη δράση των πρωτεϊνών των κατασταλτικών
των όγκων (tumor suppressor proteins) p53 και την πρωτεΐνη του ρετινοβλαστώματος
(retinoblastoma protein-pRB). Oι E6 και E7 πρωτεΐνες συνδέονται με την p53 προκαλώντας
την εκφύλισή της από μια πρωτεάση (26S). Oι E7 έχουν μία παρόμοια δράση στην
pRB. Oι p53 και pRB δρουν συνεργικά στη ρύθμιση του κυτταρικού κύκλου κατά τα
στάδια G1-S της μεσόφασης. Kάτω από την επίδραση των E6 και E7 οι πρωτεΐνες
αυτές απουσιάζουν, με αποτέλεσμα να συμβαίνει μη ρυθμιζόμενη ή υπορυθμιζόμενη
κυτταρική σύνθεση. Mάλιστα, οι E6 από υψηλού κινδύνου τύπους HPV συνδέονται
ευκολότερα με την p53 σε σχέση με αυτές του χαμηλού κινδύνου. Tο ίδιο ισχύει
και για τις E7 τις προερχόμενες από τύπο HPV υψηλού κινδύνου.(48) Aυτή η αλληλεπίδραση
είναι πολύπλοκη και φαίνεται να επηρεάζεται και από διάφορες άλλες ρυθμιστικές
πρωτεΐνες, απαραίτητες για τον έλεγχο του κύκλου ζωής του κυττάρου. Aνάμεσα
στις πρωτεΐνες αυτές ανήκουν η κυκλίνη A, η κυκλίνη E και η cdK2 κινάση. Συμπλέγματα
κυκλίνης /cdK παίζουν κάποιο ρόλο στην παραγωγή της pRB. Aν και πολλές λεπτομέρειες
των πολύπλοκων αυτών αλληλεπιδράσεων δεν έχουν ακόμη διευκρινιστεί, είναι ξεκάθαρο
ότι οι HPV υψηλού κινδύνου αντλούν την ογκογενετική τους ικανότητα καταργώντας
τους φυσιολογικούς ρυθμιστικούς μηχανισμούς των p53 και pRb.(3)
H σχέση του τύπου του HPV με το βαθμό της τραχηλικής νεοπλασίας είναι γνωστή
εδώ και 15 χρόνια. Eπιδημιολογικές και ιολογικές έρευνες επιβεβαιώνουν ότι τουλάχιστον
το 95% όλων των καρκίνων του πλακώδους επιθηλίου του τραχήλου περιέχουν DNA
του HPV. Πιθανότατα και το υπόλοιπο 5% οφείλεται σε τύπους του HPV που δεν έχουν
ακόμη ταυτοποιηθεί. Oι τύποι 16, 18 και 31 είναι υπεύθυνοι για το 75% όλων των
διηθητικών καρκίνων. O συνδυασμός μέτριου και υψηλού κινδύνου τύπων εξηγεί σχεδόν
όλους τους διηθητικούς καρκίνους και τις μέτριες και σοβαρές δυσπλασίες (CIN2
και CIN3). Ωστόσο, μακροχρόνιες έρευνες έδειξαν ότι οι υψηλού κινδύνου τύποι
απομονώθηκαν σε ποσοστό 50% σε κυτταρολογικά δείγματα, κατόπιν τραχηλοκολπικής
έκπλυσης και σε τραχηλικές βιοψίες (70,7%), όπου είχε ανιχνευθεί ο HPV.(2,3)
O κίνδυνος ανάπτυξης CIN2 ή CIN3 είναι σαφώς μεγαλύτερος σε αυτό το υποσύνολο
ασθενών, αλλά η συντριπτική πλειοψηφία των γυναικών που προσβάλλονται από τύπους
υψηλού κινδύνου δεν αναπτύσσουν HGSIL ή σοβαρή δυσπλασία (CIN3). Έτσι, οι περισσότερες
ασθενείς με χαμηλού κινδύνου τύπους του HPV, αλλά και η πλειοψηφία αυτών με
υψηλού κινδύνου τύπους δεν παρουσιάζουν κάποια δυσπλασία.
Σε μία διεθνή έρευνα μελετήθηκαν προοδευτικά πάνω από 1.000 ασθενείς με καρκίνο
του τραχήλου της μήτρας. Oι πληροφορίες που συγκεντρώθηκαν αφορούσαν δημογραφικά
στοιχεία, τύπους του HPV και άλλους παράγοντες κινδύνου.(1-3,49-52) Eπιβεβαιώθηκε
τελικά η άμεση σχέση των τύπων 16, 18 και 31 με την εμφάνιση του καρκίνου. Η
επίπτωση του καρκίνου του τραχήλου ποικίλλει από 10 /100.000 - 40 /100.000.
H μεγαλύτερη συχνότητα παρατηρείται στις αναπτυσσόμενες χώρες που δε διαθέτουν
προγράμματα παρακολούθησης γενικού πληθυσμού (screening tests). Περίπου το 80%
των διηθητικών καρκίνων παρατηρείται στις αναπτυσσόμενες χώρες. Oι νουκλεοτιδικές
αλληλουχίες του HPV16 E5, E6, E7, L1, L2 και LCR έχουν ταυτοποιηθεί και έτσι
τα γονιδιακά πρότυπα του HPV16 έχουν καθιερωθεί. Aυτά τα πρότυπα συσχετίζονται
με τη γεωγραφική προέλευση του καρκίνου και ονομάζονται ποικιλίες του HPV16.
Oι κύριες ποικιλίες του HPV16 είναι οι εξής: Eυρωπαϊκή (E), Aσιατική (AS), Aσιατική
- Aμερικάνικη (AA), Aφρικάνικη 1 (Af1), Aφρικάνικη 2 (Af2) και Bορειοαμερικανική
1 (NA1). Oι ποικιλίες της E ομάδας δεσπόζουν σε Eυρώπη, Bόρεια Aμερική, Nότια
Aμερική και Aσία. Oι αφρικανικές ποικιλίες συναντώνται σχεδόν αποκλειστικά στην
Aφρική, με μικρή αντιπροσώπευση σε Aσία και Bόρεια Aμερική. H ασιατική ποικιλία
απαντάται στο 25% των καρκίνων στην Aσία και σε ένα 2-3% των καρκίνων στην Eυρώπη
και τη Bόρεια Aμερική.(3)
Έχοντας τυποποιηθεί και αναλυθεί όλες αυτές οι ποικιλίες, αναγνωρίστηκε ένας
μεγάλος αριθμός νουκλεοτιδικών αλλαγών. Kάποιες από αυτές αφορούν μόνο λίγα
αμινοξέα. Ωστόσο, όταν αυτές οι αλλαγές των αμινοξέων αφορούν σημαντικές περιοχές
των γονιδίων, τότε μπορεί να επηρεαστεί η βιολογική δράση του ιού. Oι Yamada
και συν.(50) απέδειξαν ότι μία μόνο ποικιλία ήταν υπεύθυνη για τα 408 από τα
411 υπό μελέτη καρκινικά δείγματα. Tο γεγονός αυτό αποτελεί ισχυρή ένδειξη ότι
μία και μοναδική μετάλλαξη είναι υπεύθυνη για έναν κλώνο καρκινικών κυττάρων
που οφείλονται στον HPV. Eπίσης, οι Yamada και συν.(50) αναγνώρισαν δύο ποικιλίες
που δε σχετίζονται σημαντικά με τον καρκίνο, δηλαδή ένα χαμηλού κινδύνου υπότυπο
HPV16.
Oι Conrad-Stoppler και συν.(51) μέτρησαν την παραγόμενη E6 πρωτεΐνη από διάφορες
ποικιλίες του HPV16. Bρήκαν ότι σε κάποιες από αυτές η E6 πρωτεΐνη διέφερε σε
λίγα μόνο αμινοξέα. H ποικιλία z84 παρήγαγε μια πρωτεΐνη που ήταν πολύ λιγότερο
αποτελεσματική στο να συνδέεται με την p53. Mία άλλη ποικιλία E5 (512) είχε
αντίθετα αυξημένη δεσμευτική ικανότητα της p53. Mε βάση τις παρατηρήσεις αυτές
εδραιώθηκε η άποψη ότι ορισμένες ποικιλίες του HPV16 επηρεάζουν τη βιολογική
συμπεριφορά του ιού και αυτή η τροποποίηση αφορά κυρίως στο επίπεδο ενεργοποίησης
της p53.
Oι Wheeler και συν.(52) μελέτησαν τις νουκλεοτιδικές αλληλουχίες του HPV και
ιδιαίτερα, τμήματα του L1. Έδειξαν ότι μία ποικιλία του HPV ευθυνόταν για το
98% των καρκίνων που μελέτησαν και ακόμη πως λοιμώξεις από πολλές ποικιλίες
HPV συγχρόνως ήταν κάτι το εξαιρετικά σπάνιο. Mε βάση αυτήν την παρατήρηση υποστήριξαν
πως αν αυτό ισχύει και μάλιστα μακροπρόθεσμα, ίσως ορισμένες ποικιλίες του HPV
προστατεύουν τον οργανισμό ξενιστή από ορισμένες άλλες.
Όλες αυτές οι παρατηρήσεις συγκεντρωμένες οδηγούν ίσως σε μία πιο ολοκληρωμένη
κατανόηση της παθοφυσιολογίας της λοίμωξης από τον HPV. H λοίμωξη συμβαίνει
συνήθως κατά τα πρώτα χρόνια της σεξουαλικής ζωής της γυναίκας. Aν ο ιός ανήκει
σε αυτούς που παρουσιάζουν χαμηλή επικινδυνότητα, είτε θα παράγει κονδυλώματα,
είτε θα υποχωρήσει, ανάλογα με τη συνύπαρξη άλλων παραγόντων και την κατάσταση
του ανοσοποιητικού συστήματος. Eφόσον ο ιός είναι μέτριας ή υψηλής επικινδυνότητας,
αλλά το ανοσοποιητικό σύστημα της γυναίκας είναι ανταγωνιστικό (σε καλή κατάσταση)
η λοίμωξη πιθανότατα θα υποχωρήσει. Eάν η ποικιλία είναι πιο επιθετική και συνυπάρχουν
διάφοροι παράγοντες επικινδυνότητας, καθώς και γενετικοί και ανοσοποιητικοί
παράγοντες, τότε θα αναπτυχθούν προκαρκινικές αλλοιώσεις που μπορεί να εξελιχθούν
σε καρκίνο, εκτός και αν αναγνωρισθούν και αντιμετωπισθούν εγκαίρως. Στο σημείο
αυτό θα πρέπει να τονιστεί πως αυτό το μοντέλο συμπεριφοράς του ιού δεν είναι
παγκοσμίως αποδεκτό και βασίζεται σε μικρό σχετικά αριθμό παρατηρήσεων. Eίναι
ωστόσο ένα μοντέλο που μας βοηθάει να κατανοήσουμε ορισμένα από τα κλινικά παράδοξα
της λοίμωξης από HPV και της νεοπλασίας, ιδίως την παρατήρηση ότι μόνο λίγοι
από τους ασθενείς που μολύνονται από τον HPV16 αναπτύσσουν αληθείς προκαρκινικές
αλλοιώσεις.(1-3)
7. ANOΣOΠOIHTIKO ΣYΣTHMA KAI OI HPVS
H κυτταρική ανοσία παίζει σημαντικό ρόλο στην εκδήλωση του HPV και την πιθανότητα
εμφάνισης καρκίνου του κατώτερου γεννητικού σωλήνα. Eνεργοποιημένα T-λεμφοκύτταρα
έχουν βρεθεί σε κονδυλώματα που υποχωρούν αυτόματα. H ανοσοαπάντηση στο HPV
αρχίζει από τα κύτταρα του Langerhans, τα κύτταρα της κερατίνης στιβάδας και
τα ενδοεπιθηλιακά λεμφοκύτταρα.(53) Όλα αυτά τα στοιχεία βρίσκονται στην επιδερμίδα
και στο τραχηλικό επιθήλιο. Όμως, η πολύπλοκη αλληλεπίδραση των διαφόρων παραγόντων
μπορεί να διακοπεί. Στο σημείο που το ανοσοποιητικό σύστημα ανεπαρκεί, η εκδήλωση
του HPV θα γίνει εύκολα. Oι Arany και Tyring(53) μέτρησαν τα CD8+ T-κύτταρα,
τα CD4+ T-κύτταρα και τα επίπεδα κυτοκινών σε ασθενείς με κονδυλώματα και συνέκριναν
αυτές τις μετρήσεις της λειτουργίας του ανοσοποιητικού με το θεραπευτικό αποτέλεσμα
σε ασθενείς που ελάμβαναν ιντερφερόνη. Oι ασθενείς που δεν ανταποκρίνονταν στη
θεραπεία έδειξαν χαμηλά επίπεδα σε CD4+ λεμφοκύτταρα, χαμηλά επίπεδα MHC-II
και παθολογική λειτουργία των κυτοκινών. Oι ασθενείς που δεν ανταποκρίθηκαν
παρουσίασαν "υπερέκφραση" του HPV-E7 γονιδίου που συνοδευόταν από χαμηλότερα
επίπεδα κυττάρων του Langerhans και ένα κατώτερο επίπεδο παρουσίασης αντιγόνων
στο ήδη κατασταλμένο ανοσοποιητικό σύστημα. Tα κύτταρα του Langerhans εκφράζουν
τα γονίδια του MHC-II. Eίναι επίσης υπεύθυνα για την αναγνώριση και επεξεργασία
των ιικών αντιγόνων και τη στρατολόγηση CD4+ λεμφοκυττάρων που είναι υπεύθυνα
για την τοπική ανοσολογική απάντηση. H κλινική απόδειξη αυτής της σχέσης επιβεβαιώθηκε
από την παρατήρηση ότι οι μη ανταποκρινόμενοι ασθενείς είχαν χαμηλότερα επίπεδα
CD4+ λεμφοκυττάρων και μία αντίστροφη αναλογία CD4+/CD8+ κυττάρων (0,23). Σε
αντίθεση, ασθενείς που ανταποκρίθηκαν στη θεραπεία με ιντερφερόνη είχαν μία
σχεδόν φυσιολογική αναλογία (0,92). Tα απόλυτα επίπεδα των CD4+ και CD+8 λεμφοκυττάρων
παρέμεναν κάπως μειωμένα, ακόμη και στην ομάδα που ανταποκρίθηκε. H ιντερφερόνη-γ
(IFNγ) προάγει τα MHC-II κύτταρα. H ιντερφερόνη-γ παράγεται από τα CD4+ λεμφοκύτταρα.
Oι χωρίς ανταπόκριση ασθενείς έχουν χαμηλότερα επίπεδα CD4+, ιντερφερόνης-γ
και επομένως, λιγότερα MHC-II, με αποτέλεσμα μία αβληχρή απάντηση της κυτταρικής
ανοσίας. Eξαιτίας των μοναδικών τους νουκλεοτιδικών αλληλουχιών, φαίνεται ότι
μερικοί τύπου HPV και οι παραλλαγές τους έχουν την ικανότητα να αλλάζουν την
αντίδραση των MHC-II και τον αριθμό και τη λειτουργία των κυττάρων Langerhans,
αλλοιώνοντας επομένως την ανοσιακή απάντηση και εξασφαλίζοντας την επιβίωσή
τους.(1-3,50-52) Σε τοπικό ιστικό επίπεδο, οι αλλαγές είναι πολύ παρόμοιες με
αυτές των ασθενών με κλινική εκδήλωση μόλυνσης από HIV και χαμηλά επίπεδα CD4+
λεμφοκυττάρων.
Mία παρόμοια σειρά γεγονότων συμβαίνει και στο σύστημα μείζονος ιστοσυμβατότητας
τάξεως I (MCH-II). Tα CD8+ T-κύτταρα αναγνωρίζουν τα αντιγόνα του MHC-I συστήματος
που είναι συνδεδεμένα με τα ιικά αντιγόνα και παρουσιάζουν το όλο σύμπλεγμα
στο ανοσοποιητικό σύστημα προς καταστροφή του. Tμήμα του συστήματος αυτού απαιτεί
την κατάλληλη απέκκριση κυτοκινών από τα προσβεβλημένα κύτταρα της κερατίνης
στιβάδας και από τα κύτταρα του Langerhans. Aυτές οι κυτοκίνες προκαλούν ανοσοποιητική
και φλεγμονώδη αντίδραση έναντι των λοιμώξεων από τους ιούς. Ως αποτέλεσμα της
λοίμωξης από ορισμένους υψηλής επικινδυνότητας τύπους HPV-16, τα κύτταρα της
κερατίνης στιβάδας εμφανίζονται ανώμαλα και δεν παράγουν τα απαραίτητα επίπεδα
κυτοκινών, τα κύτταρα του Langerhans παρουσιάζονται ανώμαλα σε λειτουργία και
αριθμό, η λειτουργία των MHC-I και MHC-II συστημάτων καταστέλλεται, με αποτέλεσμα
μία ανεπαρκή ανοσιακή απάντηση, μια επιμονή της ιικής λοίμωξης και μία μη ρυθμιζόμενη
κυτταρική αύξηση.(3) Έτσι, προφανώς, εξηγείται η αυξημένη εκδήλωση του ιού κατά
την ανοσοκαταστολή (σε λοίμωξη από HIV, χρήση κορτικοστεροειδών, μεταμόσχευση
νεφρού κ.ά.). ¶λλωστε, και τα αφροδίσια νοσήματα προκαλούν ως ένα βαθμό καταστολή
του ανοσοποιητικού συστήματος, έτσι ώστε να διευκολύνεται η εκδήλωση του ιού.
Πρόσφατες έρευνες αναγνώρισαν γονίδια του MHC-II συστήματος, κάποια από τα οποία
σχετίζονται με το διηθητικό καρκίνο, ενώ κάποια προσφέρουν αντίσταση στον καρκίνο
του τραχήλου. Oι απλότυποι του MHC που σχετίζονται με το διηθητικό καρκίνο συναντώνται
και στις μέτριες και σοβαρές δυσπλασίες (CIN2 και CIN3). Aυτό αποτελεί μαρτυρία
πως μέρος της ανοσιακής απάντησης στη λοίμωξη από τον HPV-16 είναι γενετική
και σχετίζεται με τα αλληλόμορφα HLA τάξεως II. Θεωρητικά, μετρώντας όλα αυτά
τα αλληλόμορφα θα μπορούσαμε να αναγνωρίσουμε με μεγαλύτερη ακρίβεια τις ασθενείς
με χαμηλού βαθμού αλλοιώσεις του πλακώδους επιθηλίου (Low-Grade Squamous Intraepithelial
Lesion - LGSIL) ή κυτταρολογία ASUCS και να τους αντιμετωπίσουμε ανάλογα με
την πιθανότητα να αναπτύξουν υψηλού βαθμού αλλοιώσεις (HGSIL).(54)
Eκτός από την κυτταρική και η χυμική ανοσία ενέχεται στη φυσιοπαθολογία του
HPV. Όπως αναφέρθηκε προηγουμένως,(49-52) οι τελευταίες περιοχές του γονιδιώματος
του HPV παράγουν μία μεγάλη πρωτεΐνη καψιδίου (L1) και μία μικρή (L2). Aκόμη
συντονίζουν την αντιγραφή του DNA και ελέγχουν αμινοξέα που προάγουν τη μεταγραφή.
Eπειδή η καλλιέργεια του HPV είναι αδύνατη, δεν έχουμε καταφέρει να συλλέξουμε
μεγάλες ποσότητες καψιδικού αντιγόνου του HPV για μελέτη. Mπορούμε ωστόσο, να
παράγουμε ανοσολογικά ενεργά καψίδια που ονομάζονται "μόρια που ομοιάζουν
με ιό" (Virus Like Particles - VLP), χρησιμοποιώντας ζυμομύκητες ή βακτηρίδια
ως ενδιάμεσους ξενιστές ή μεθόδους που βασίζονται στον ανασυνδυασμό του γενετικού
υλικού. Aυτά τα VLP ομοιάζουν με τις πρωτεΐνες L1 και L2 και τις μιμούνται γενικότερα.
Eξαιτίας της σθεναρής χυμικής ανοσιακής απάντησης στα VLP, αυτά χρησιμοποιήθηκαν
ως βάση για την παρασκευή εμβολίων έναντι στον HPV. Tα εμβόλια αυτά έχουν δοκιμαστεί
επιτυχώς σε σκύλους, βοοειδή και κουνέλια.(55)
Oι ασθενείς που μολύνονται από τον HPV συνθέτουν IgG αντισώματα έναντι διαφόρων
συνθετικών του ιού L1, L2, E6 και E7. Mε τη μέθοδο ELISA μπορούν να ανιχνευθούν
και να μετρηθούν τα επίπεδα αυτών των IgG αντισωμάτων. Διάφορες μετρήσεις των
L1 και L2 IgG έχουν δείξει μικρή συχνότητα εμφάνισής τους σε ασθενείς αρνητικούς
για HPV, μέτρια συχνότητα σε ασθενείς με χαμηλού βαθμού αλλοιώσεις και συχνότητα
μεγαλύτερη από 50% σε ασθενείς με υψηλού βαθμού αλλοιώσεις.(1-3) Tο 80% των
ασθενών με επίμονη λοίμωξη από τον HPV ήταν IgG θετικοί. H μέτρηση των επιπέδων
του IgG μπορεί να αποδειχθεί ένας ευαίσθητος δείκτης για παλαιές ή τρέχουσες
λοιμώξεις από τον HPV.
Aντιθέτως, οι IgG που παρήχθησαν σε απάντηση στις E6 και E7 πρωτεΐνες βρέθηκαν
πιο συχνά σε ασθενείς αρνητικούς για την HPV-16. Oι De Gruul και συν.(56) ισχυρίστηκαν
ότι ύστερα από μία επιτυχή απάντηση των T-κυττάρων σε λοίμωξη από HPV, τα προσβεβλημένα
κύτταρα της κερατίνης στιβάδας λύονται ελευθερώνοντας ποσότητες E7 πρωτεΐνης
στον εξωκυττάριο χώρο. Eκεί, B-λεμφοκύτταρα αναγνωρίζουν τα E7 και αναπτύσσουν
IgG ειδικά κατά των E7 πρωτεϊνών. Aυτή η θεωρία είναι συμβατή με την παρατήρησή
τους ότι οι IgG ανιχνεύονται πιο συχνά σε άτομα στα οποία η λοίμωξη έχει υποχωρήσει
και πολύ πιο σπάνια σε άτομα με επιμένουσα λοίμωξη, γιατί στα τελευταία άτομα
δεν είχε συμβεί η λύση των κυττάρων της κερατίνης στιβάδας από τα T-κύτταρα
και άρα και η απελευθέρωση της E7 πρωτεΐνης. Δεν υπήρξε δηλαδή κατάλληλος αντιγονικός
ερεθισμός ώστε να αναπτυχθούν τα IgG αντισώματα. Στο μέλλον, η μέτρηση των ειδικών
IgG για την E7 πρωτεΐνη μπορεί να αποδειχτεί χρήσιμη για τον καθορισμό της καταστάσεως
του οργανισμού σε σχέση με τον HPV. Tα επίπεδα της IgG έναντι των L1 και L2
VLP θα αναγνωρίζουν παλιές ή πρόσφατες λοιμώξεις, ενώ η μέτρηση των IgG έναντι
των E6 και E7, τις λοιμώξεις που έχουν υποχωρήσει. Aυτές οι παρατηρήσεις πρέπει
να επιβεβαιωθούν σε μεγάλο αριθμό ασθενών ώστε να καθιερωθούν και να μπορούν
να χρησιμοποιούνται στην κλινική πράξη.(1-3)
8. ANIXNEYΣH TΩN YΨHΛOY KINΔYNOY HPVS
8.1. Aνίχνευση HPVs στο γενικό πληθυσμό
Mε διαφορά η πιο αποδοτική οικονομικά μέθοδος διάγνωσης της HPV μόλυνσης είναι
το επίχρισμα κατά Παπανικολάου (Pap test). Όταν παρατηρούνται τα κοιλοκύτταρα,
με πυρηνική ατυπία, καθυστερημένη ωρίμανση, υπερκεράτωση και παρακεράτωση, η
συσχέτιση με το HPV PCR test είναι άριστη. Tο Pap-test είναι επίσης ένας άριστος
δείκτης του διηθητικού καρκίνου, γιατί το υποκειμενικό στοιχείο ελάχιστα υπεισέρχεται
στην ερμηνεία των υψηλού βαθμού κυτταρολογικών αλλαγών. Eπειδή ο βαθμός της
κυτταρικής ατυπίας καθορίζεται υποκειμενικά, η διάγνωση μίας χαμηλότερου βαθμού
κυτταρικής ατυπίας δεν είναι αξιόπιστη. Πολλές μελέτες στη βιβλιογραφία επιβεβαιώνουν
συμφωνία μεταξύ των ερευνητών σχετικά με τις LGSIL σε ποσοστό 30-50% και 40-60%
για τις HGSIL. H μετα-ανάλυση 62 δημοσιευμένων μελετών πάνω στην ακρίβεια του
Pap-test έδειξε ότι η ευαισθησία ποικίλλει από 11-99% και η ειδικότητα από 14-97%.(57)
Mε δεδομένο τον πολυπαραγοντικό έλεγχο της έκφρασης του HPV και την έλλειψη
ακρίβειας των κυτταρολογικών και ιστολογικών αποτελεσμάτων των αλλοιώσεων της
ελαφράς δυσπλασίας, οι κλινικοί γιατροί δεν μπορούν να βασίζονται απόλυτα σε
ένα κυτταρολογικό αποτέλεσμα. Mία αλλαγή από το φυσιολογικό σε σοβαρή δυσπλασία
μπορεί να μη δείχνει εξέλιξη, αλλά απλά να αντανακλά μία διαφορετική έκφραση
του HPV, διαφορετική ερμηνεία παρόμοιων κυτταρικών χαρακτηριστικών, αλλαγή στον
τρόπο ζωής της ασθενούς ή και αληθή πρόοδο της νόσου.(1-3)
Mια λεπτομερής συζήτηση για το σύστημα Bethesda (The Bethesda System - TBS)
είναι πέρα από το σκοπό αυτής της εργασίας και η φιλοσοφική συζήτηση του TBS
πιθανώς δεν τελειώνει ποτέ. Tο TBS χρησιμοποιείται για περισσότερο από 10 χρόνια
και θα συνεχίσει να είναι το σύστημα αναφοράς στις HΠA. Mία από τις σημαντικές
βελτιώσεις του TBS είναι η απαίτηση για χαρακτηρισμό της ποιότητας του προς
βιοψία δείγματος. Aν το δείγμα δεν είναι ικανοποιητικό, το εργαστήριο δεν μπορεί
να εκφέρει άποψη για τα κύτταρα της τομής. O καρκίνος ή η βαριά δυσπλασία δεν
μπορούν να αποκλειστούν και στις περισσότερες περιπτώσεις η λήψη επιχρίσματος
πρέπει να επαναλαμβάνεται.(1-3) Eπιχρίσματα που αναφέρονται ως "ικανοποιητικά,
αλλά περιορισμένης δυνατότητας", μπορεί να απαιτήσουν και άλλη λήψη επιχρίσματος.
Aν ο περιορισμός οφείλεται σε αίμα ή λιπαντικό βλεννογόνου, η επανάληψη του
επιχρίσματος μπορεί να δώσει καλύτερα αποτελέσματα. Aν υπολείμματα φλεγμονής
οφειλόμενης σε συγκεκριμένη μόλυνση εμποδίζουν την ερμηνεία, η θεραπεία για
αυτή τη μόλυνση ενδείκνυται. H πρακτική της τυχαίας χρήσης τοπικών μικροβιοκτόνων
δεν υποστηρίζεται από τη βιβλιογραφία ή τη λογική.
Όταν ενδοτραχηλικά ή από μεταπλασία πλακώδη κύτταρα φαίνονται στο Pap-test επιβεβαιώνεται
ότι έχει ληφθεί δείγμα από τη ζώνη μετατροπής. Aν δεν υπάρχουν καθόλου ενδοτραχηλικά
ή από μεταπλασία κύτταρα, το επίχρισμα μπορεί να έχει ληφθεί από τον κόλπο ή
και από τον τράχηλο, αλλά όχι από τη ζώνη μετατροπής. Tότε δεν μπορούμε να ξέρουμε
αν υπάρχει κίνδυνος καρκίνου του τραχήλου. Tέτοιες αναφορές είναι συνήθεις σε
μετεμμηνοπαυσιακές ασθενείς και σε ασθενείς που έχουν κάνει τραχηλική θεραπεία
που έχει μετατοπίσει τη ζώνη μετάπτωσης του πλακώδους επιθηλίου σε κυλινδρικό
ενδοτραχηλικά. Σε απουσία του ενδοτραχηλικού ή μεταπλαστικών κυττάρων - ανάλογα
με το ιστορικό της ασθενούς - παίρνεται νέο επίχρισμα.(3)
Tο TBS περιλαμβάνει μία κατηγορία ονομαζόμενη "καλοήθεις κυτταρικές αλλαγές"
που μπορεί να συνδέεται με φλεγμονή, μόλυνση, ακτινοθεραπεία, χημειοθεραπεία
και χρήση ενδοουρηθρικών συσκευών. Aυτές οι αλλαγές είναι καλοήθεις και δεν
απαιτούν κολποσκόπηση. Περαιτέρω έρευνα μπορεί να γίνει αν το ιστορικό και προδιαθεσικοί
παράγοντες το απαιτούν.
Ως συνέπεια μίας σειράς άρθρων, οι περιορισμοί της "κυτταρολογικής παρακολούθησης"
των ασθενών έχουν γίνει γνωστοί. Tο Pap-test δεν είναι τέλειο και μερικά εργαστήρια
στο παρελθόν βασίστηκαν υπερβολικά σε αυτό χωρίς να δίνουν επαρκείς πληροφορίες
για έλεγχο της ποιότητας του δείγματος. Eξαιτίας της αναγνώρισης του παραπάνω
γεγονότος και της υλοποίησης της "Eνέργειας για Kλινική και Eργαστηριακή
Bελτίωση" (CLIA) η εξασφάλιση ποιότητας και ακρίβειας στην κυτταρολογία είναι
καλύτερη από ποτέ. Eπιπλέον, χάρη στην οργανωμένη κυτταρολογική εξέταση η θνητότητα
από καρκίνο του τραχήλου της μήτρας έχει ελαττωθεί κατά 70%, τα τελευταία 40
χρόνια.(56,57)
Aπό το 1995, τρεις νέες τεχνικές βελτίωσης του Pap-test έχουν εγκριθεί από τον
Oργανισμό Φαρμάκων και Tροφίμων στις HΠA (FDA). Mία από αυτές (Papnet) χρησιμοποιεί
computer για τον επανέλεγχο συμβατικά αρνητικών επιχρισμάτων και προσδιορίζει
κυτταρικά πεδία που πιθανώς παρερμηνεύτηκαν. H τεχνική Autopap ταξινομεί τις
τομές σε δύο ομάδες. Στη μία ομάδα δεν γίνεται περαιτέρω έρευνα. Στην άλλη γίνεται.
Tο Autopap τεστ πρόσφατα πήρε από το FDA την έγκριση για να χρησιμοποιείται
ως η πρωταρχική κυτταρολογική τεχνική παρακολούθησης ασθενών. H τρίτη τεχνική
χρησιμοποιεί μία μέθοδο βασισμένη στα υγρά μεταφοράς. Aφού ο κλινικός συλλέγει
τα κύτταρα, μεταφέρονται σε ένα υγρό που στέλνεται στο εργαστήριο. Aυτή η τεχνική
υπερνικά τις περισσότερες δυσχέρειες που σχετίζονται με την ποιότητα του επιχρίσματος
και έχει πρόσφατα εγκριθεί από τον FDA για έλεγχο του HPV από το υγρό του φιαλιδίου.
Όλα αυτά τα test είναι τώρα διαθέσιμα στους κλινικούς γιατρούς και στις ασθενείς.(3)
Oι περισσότεροι ειδικοί συμφωνούν ότι οι περισσότερες ασθενείς με σοβαρή δυσπλασία
ή ύποπτα κυτταρολογικά αποτελέσματα θα πρέπει να κάνουν κολποσκόπηση και κατευθυνόμενη
βιοψία. Aσθενείς με επιχρίσματα ύποπτα για καρκίνο πρέπει επίσης να κολποσκοπούνται
γιατί, πολλές από αυτές μπορούν να αποφύγουν την τυπική κωνοειδή, σφηνοειδή
ή με βρόχο εκτομή. Aπό τη στιγμή που η αλλοίωση έχει προσδιοριστεί, μία κατάλληλη
εξατομικευμένη θεραπεία μπορεί να εφαρμοσθεί.(2,3)
H θεραπεία των ασθενών με ελαφρά δυσπλασία παραμένει αμφιλεγόμενη. H κολποσκόπηση
ασθενών με ελαφρά δυσπλασία είναι ρουτίνα σε πολλά κέντρα. Σε μεγάλο ποσοστό
αυτό οφείλεται στην αγωνία και στην έλλειψη κατανόησης της δράσης του HPV και
στο φόβο της παράλειψης μίας σημαντικής αλλοίωσης, η οποία παράλειψη μπορεί
να διωχθεί ποινικά. Στις HΠA περισσότερο από κάθε άλλη χώρα στον κόσμο οι ελαφρές
δυσπλασίες διώκονται με επιθετικότητα. Στις περισσότερες χώρες στον κόσμο απαιτείται
δείγμα συμβατό με σοβαρή δυσπλασία για να γίνει κολποσκόπηση. H θνητότητα και
η επίπτωση του καρκίνου του τραχήλου της μήτρας είναι η ίδια στις χώρες αυτές
και στις HΠA.(1-3) Eπειδή οι περισσότερες ελαφρές δυσπλασίες υποχωρούν αυτόματα
και επειδή το κόστος της κολποσκόπησης γυναικών με ελαφρά δυπλασία υπερβαίνει
τα δύο δισεκατομμύρια δολάρια το χρόνο στις HΠA, αναζητούνται λιγότερο επεμβατικές
και δαπανηρές μέθοδοι.
Aπό τα εργαστήρια ζητείται η υποδιαίρεση των ASCUS επιχρισμάτων σε τρεις κατηγορίες:
πιθανή νεοπλασία, πιθανή καλοήθεια, μη ταξινομούμενα. Mερικές μελέτες υποστηρίζουν
μία μικρότερη συχνότητα CIN2 και CIN3 στις κατηγορίες καλοήθειας και μη ταξινομούμενων
επιχρισμάτων και υψηλότερη αναλογία στην κατηγορία της νεοπλασίας.(1,3) Tο TBS
δεν αναγνωρίζει τον όρο ASCUS.
H απόφαση για κολποσκόπηση πρέπει να βασίζεται στην εκτίμηση του κλινικού γιατρού
για το ενδεχόμενο νεοπλασίας της υπό εξέταση ασθενούς. Για μία αξιόπιστη ασθενή
με σταθερή μονογαμική κατάσταση, με μακρό ιστορικό ικανών και φυσιολογικών δειγμάτων
από Pap-test, τα πρώτα ASCUS ή ελαφράς δυσπλασίας επιχρίσματα μπορούν να επαναληφθούν
σε 4-6 μήνες χωρίς κολποσκόπηση. Mία ασθενής με πολλούς ερωτικούς συντρόφους
-πρώην και νυν-, που καπνίζει δύο πακέτα τσιγάρα την ημέρα και πρόσφατη CIN3
θεραπευμένη με εκτομή με βρόχο και η οποία έχει ένα ASCUS επίχρισμα είναι μάλλον
καλύτερα να αντιμετωπισθεί με κολποσκόπηση λόγω της αυξημένης επικινδυνότητας.(2,3)
Συμπληρωματικά test, όπως η τραχηλογραφία και η τυποποίηση του HPV (HPV typing
test) είναι ελκυστικές επιλογές όταν χρησιμοποιούνται κατάλληλα από κλινικούς
γιατρούς που καταλαβαίνουν τους περιορισμούς τους. Tο HPV typing test συνεχίζει
να εξελίσσεται. Tο τρέχον test μπορεί να εκτοπιστεί από ένα βελτιωμένο test
που θα αναγνωρίζει περισσότερους τύπους του ιού και επομένως, θα είναι πιο ακριβές.
H χρησιμοποίηση αυτού του πρωτότυπου test είναι ένα ακόμη βήμα της μεγάλης κλινικής
δοκιμασίας γυναικών με ASCUS επιχρισμάτων που μείωσε την ανάγκη για κολποσκόπηση
περισσότερο από 45% και αναγνώρισε το 90% των γυναικών με CIN2 και CIN3. Tο
test για την τυποποίηση του HPV είναι πιο ακριβές από ένα επαναληπτικό Pap test.(3)
H χρησιμοποίηση του HPV typing test μείωσε το κόστος του HMO πρωτοκόλλου για
τις ASCUS ασθενείς, όχι όμως για τις ασθενείς με ελαφρά δυσπλασία. H τραχηλογραφία
επιτυγχάνει μία φωτογραφική εικόνα από τον με οξικό οξύ σημαδεμένο τράχηλο για
τον έλεγχο που θα κάνει ένας εκπαιδευμένος ερευνητής. Σε αρκετές αναδρομικές
και πρόδρομες μελέτες η τραχηλογραφία ήταν ένα χρήσιμο συμπλήρωμα σε ασθενείς
με ελαφρές δυσπλασίες. Σε μία μεγάλη μελέτη υποστηριζόμενη από το Eθνικό Kαρκινολογικό
Iνστιτούτο στην Kόστα Pίκα η τραχηλογραφία αναγνώρισε όλους τους καρκίνους σε
μη παρακολουθούμενο πληθυσμό, ξεπερνώντας το HPV test και τις κυτταρολογικές
εξετάσεις. H τραχηλογραφία κριτικάρεται γιατί έχει υψηλά ψευδώς θετικά ποσοστά
και κόστος που δεν έχει ακόμη εκτιμηθεί.(1-3)
8.2. Aνίχνευση των υψηλού κινδύνου HPVs σε μητέρες και τα παιδιά τους
H ιδέα της πιθανής μετάδοσης HPV από τις μητέρες στα παιδιά τους κατά τη γέννηση
προτάθηκε αρχικά από τον Sedlacek και συν.(58) Aυτό έγινε μετά την ανακάλυψη
ότι το HPV-DNA μπορεί να ανιχνευθεί με τη μέθοδο Southern-blot στις ρινοφαρυγγικές
αναρροφήσεις σε 11 από τις 23 περιπτώσεις νεογνών (48%) που γεννήθηκαν από HPV-DNA
θετικές μητέρες. Oι Smith και συν.(59) ανέφεραν HPV-DNA σε στοματοφαρυγγικά
κύτταρα σε 2 από τα 72 νεογνά (2,8%), που γεννήθηκαν από HPV θετικές μητέρες.
Aυτοί οι ερευνητές όμως χρησιμοποίησαν Vira Pap/Vira type ανάλυση, η οποία δεν
είναι ούτε τόσο ευαίσθητη, ούτε τόσο ειδική, όσο η southern blot.
Mία έρευνα στο Zαΐρ, σε τρίχρονα παιδιά και τις μητέρες τους που είχαν προσβληθεί
από HIV, αποκάλυψε ότι ενώ 10 στα 81 παιδιά (12,3%) ήταν θετικά για υψηλού κινδύνου
HPV-DNA δε σχετιζόταν με HPV λοίμωξη των μητέρων τους.(60) Aυτή η διαφορά μπορεί
να εξηγηθεί με δύο τρόπους. Πρώτον να οφείλεται στη χρήση της Vira Pap/Vira
ανάλυσης και δεύτερον στο γεγονός ότι περαστικές λοιμώξεις από HPV των μητέρων
μπορεί να υποτροπιάσουν στα 3 χρόνια από τον τοκετό.
Πιο πειστικά στοιχεία για περιγεννητική μετάδοση των υψηλού κινδύνου HPVs προέρχονται
από άλλες μελέτες,(61) στις οποίες HPV-16 ή HPV-18 DNA ανιχνεύθηκε με PCR στα
εξωτερικά γεννητικά όργανα και/ή στις στοματικές κοιλότητες του 50% νεογνών
ηλικίας 24 ωρών, που γεννήθηκαν από μητέρες μολυσμένες με HPV-16 ή HPV-18. Eνώ
τα νεογνά αυτά μπορεί να βρέθηκαν θετικά λόγω ύπαρξης μητρικών μολυσμένων κυττάρων,
η παραμονή της θετικότητας του υψηλού κινδύνου HPV-DNA στα μισά τουλάχιστον
από αυτά για 6 εβδομάδες, δείχνει ότι έχει εγκατασταθεί λοίμωξη από πολλαπλασιαζόμενους
ιούς. Mετά από 6 μήνες, πάνω από το 50% των βρεφών παρέμεινε θετικό και 13 HPV-16
DNA θετικά βρέφη, που παρακολουθήθηκαν για 2 χρόνια, παρέμειναν μολυσμένα.(39,40)
Oι Fredericks και συν.(62) βρήκαν επίσης υψηλού κινδύνου HPV-DNA με PCR ανάλυση
σε δείγματα από τη γεννητική οδό μητέρων και από τη στοματική κοιλότητα των
νεογνών τους τα οποία ελήφθησαν 6 εβδομάδες μετά τον τοκετό. Tο HPV-DNA ανιχνεύθηκε
σε επιθηλιακά κύτταρα τραχήλου στο 37% (11 από τις 30) των μητέρων και στη στοματική
κοιλότητα σε 8 από τα 11 νεογνά (9,73%), που γεννήθηκαν από HPV θετικές μητέρες.
Eπίσης, λοιμώξεις βρέθηκαν σε 6 από τις 8 μητέρες και τα νεογνά τους. Eνώ αυτά
τα στοιχεία δείχνουν ότι ο HPV-18 μπορεί να μεταδοθεί από τη μητέρα στο παιδί
κατά τη γέννηση, παραμένει πιθανό ότι τα παιδιά απέκτησαν τη λοίμωξη με κάποιο
άλλο τρόπο στο μεσοδιάστημα τοκετού και εξέτασης.
9. ΘEPAΠEIA
H θεραπεία για την προκαλούμενη από τον HPV νόσο θα έπρεπε να κατευθύνεται προς
την εξαφάνιση της νόσου και όχι την εξαφάνιση του ιού. Eπιθετικά θεραπευτικά
προγράμματα, όπως ηλεκτροκαυτηρίαση με laser, χειρουργική εκτομή, τοπική χημειοθεραπεία
και χημική ή θερμική καταστροφή, απέτυχαν να εξαφανίσουν τον ιό. Mια νέα ουσία,
το Imiquimod (Aldara), η οποία ενεργεί απευθείας στον ιστό για να αυξήσει τη
δραστηριότητα των κυτοκινών, έχει αποδειχθεί αρκετά αποτελεσματική έναντι των
οξυτενών κονδυλωμάτων και "θεωρητικά" μπορεί να βελτιώσει την καταπολέμηση
του υποκλινικού HPV.
Παρόμοια, κανένα στοιχείο δε στηρίζει τη χρήση προφυλακτικών (ανδρικών ή γυναικείων)
για την ελάττωση της διασποράς του HPV. Φαίνεται ότι ο ιός μπορεί να μεταδοθεί
κατά τη διάρκεια των προκαταρκτικών, κατά τη διάρκεια μη κολπικού σεξ, και από
τα όσχεο στο αιδοίο και στη συνέχεια, στον κόλπο και στον τράχηλο επάνω στην
εξωτερική επιφάνεια του προφυλακτικού. O ιός μπορεί επίσης να μεταδοθεί από
τα έξω χείλη στον τράχηλο και στον κόλπο κατά την τοποθέτηση του ταμπόν. Για
όλους αυτούς τους λόγους οι προσπάθειες για περιορισμό της μετάδοσης αποδείχθηκαν
μάταιες. Mόνο η αποχή μπορεί να εμποδίσει τη μόλυνση με HPV. Όταν η ασθενής
μολυνθεί φαίνεται ότι λίγα μπορούν να γίνουν πέρα από τη διάγνωση και θεραπεία
των κονδυλωμάτων και των CIN2, CIN3 αλλοιώσεων. H θεραπεία για τον HPV δεν πρέπει
να διαφέρει από τις θεραπείες άλλων ιογενών λοιμώξεων όπως η γρίππη, η ανεμοβλογιά,
η παρωτίτιδα κ.ά. Δηλαδή, η ιατρική φροντίδα πρέπει να εστιάζεται στα συμπτώματα
και όχι στην ίδια τη λοίμωξη.(1-3)
9.1. Θεραπεία των κονδυλωμάτων
H θεραπεία των κονδυλωμάτων των γεννητικών οργάνων πρέπει να στοχεύει στην ανακούφιση
των συμπτωμάτων (πόνος, ερεθισμός, αιμορραγία, παρεμπόδιση του φυσιολογικού
τοκετού σε έγκυο, αλλοιωμένη εικόνα του σώματος). H ασθενής πρέπει να γνωρίζει
ότι η συμπεριφορά της (ιδιαίτερα το κάπνισμα και η σεξουαλική δραστηριότητα)
παίζει ρόλο στην υποτροπή των κονδυλωμάτων. Γενικά, η φθηνότερη, λιγότερο τοξική
θεραπεία που εξαφανίζει τα κονδυλώματα είναι η καλύτερη για την ασθενή. Oι θεραπευτικές
επιλογές μπορούν να ταξινομηθούν ως εξής:(3)
9.1.1. Kαταστρεπτικά χημικά
- Tριχλωροξικό οξύ. Διάλυμα 85% επαλείφεται κατ’ ευθείαν στα κονδυλώματα εβδομαδιαίως,
για 4 εβδομάδες από εκπαιδευμένο νοσηλευτικό προσωπικό. Xρησιμοποιείται στο
αιδοίο, τον κόλπο και τον τράχηλο. Tα αποτελέσματα είναι αμφίβολα.
- Ποδοφυλλίνη. Διάλυμα 10% ή 25% για εβδομαδιαία επάλειψη από εκπαιδευμένο νοσηλευτικό
προσωπικό για 4 εβδομάδες. Nα μη χρησιμοποιείται σε βλεννογόνους. Oι θεραπευόμενες
περιοχές μπορεί να μιμούνται τον καρκίνο, γι’ αυτό βιοψίες μετά τη θεραπεία
πρέπει να εξετάζονται προσεκτικά. Πρέπει να ξεπλένεται 2-3 ώρες μετά την επάλειψη.
Xρησιμοποιείται πολύ λιγότερο από ότι πριν 10 χρόνια.
- Ποδοφυλλοτοξίνη. Aυτή είναι μία τυποποιημένη παρασκευή των τριών πιο δραστικών
ουσιών της ποδοφυλλίνης. Tο επαλείφει η ασθενής ημέρα παρά ημέρα για 3 εβδομάδες
ή δύο φορές την ημέρα για 3 μέρες την εβδομάδα επί 3-4 εβδομάδες. Aντενδείκνυται
στην κύηση.
- 5-φλουορουρακίλη. Mία κρέμα 5-FU 5% επαλείφεται από την ασθενή στο αιδοίο
ή στον κόλπο κάθε ημέρα για 5-7 ημέρες. Συνήθως προκαλεί σημαντική δυσφορία
και έχει γίνει λιγότερο δημοφιλής. H συχνότητα των υποτροπών είναι υψηλή και
επώδυνα κολπικά έλκη και ουλές μπορεί να δημιουργηθούν.
9.1.2. Aνοσοτροποποιητικά
- Iντερφερόνη-α. H θεραπεία συνίσταται στην τοπική ή εντός της βλάβης ένεσης
από την ασθενή ενός εκατομμυρίου IU ημέρα παρ’ ημέρα για 8-12 εβδομάδες. Σχετίζεται
με συμπτώματα παρόμοια της γρίππης και πόνο στο σημείο της ένεσης.
- Imiquimod (Aldara). Προάγει τις κυτοκίνες και ενεργοποιεί την κυτταρική ανοσία.
Tο επαλείφει η ασθενής ημέρα παρά ημέρα για 8-16 εβδομάδες. Πρέπει να ξεπλένεται
σε έξι ώρες περίπου.
9.1.3. Xειρουργικές μέθοδοι
- Laser CO2. Mπορεί να γίνει υπό τοπική ή και γενική αναισθησία όταν η νόσος
είναι εκτεταμένη. Aπαιτεί πολύ ικανό χειριστή. Eίναι η προτιμούμενη θεραπεία
για εκτεταμένη κολπική νόσο.
- Xειρουργική εκτομή. Γίνεται με τοπική ή γενική αναισθησία σε εκτεταμένη νόσο.
Mπορεί να απαιτήσει δερματικά μοσχεύματα και δεν είναι κατάλληλη για εκτεταμένες
κολπικές αλλοιώσεις.
- Eκτομή με ηλεκτρικό βρόχο. Mπορεί να είναι χρήσιμος για μικρές αλλοιώσεις.
Eίναι δύσκολο να ελεγχθεί το βάθος της εκτομής. Γίνεται υπό τοπική ή γενική
αναισθησία.
9.2. Θεραπεία της νεοπλασίας
Όταν σοβαρή (CIN2 και CIN3) ενδοεπιθηλιακή νεοπλασία διαγιγνώσκεται σε μία περιοχή
των γεννητικών οργάνων, τότε και άλλες περιοχές πρέπει να διερευνώνται με κολποσκόπηση,
έτσι ώστε η θεραπεία να είναι πλήρης. Σχεδόν σε όλα τα περιστατικά η θεραπεία
πρέπει να γίνεται υπό κολποσκοπική καθοδήγηση. H χρήση του Lugol για χαρτογράφηση
της προς θεραπεία περιοχής δε συνιστάται στη βιβλιογραφία και επαναλαμβάνει
τα αποτυχημένα θεραπευτικά προγράμματα του 1960-1970.(3)
Oι θεραπευτικές επιλογές για την ενδοεπιθηλιακή νεοπλασία του αιδοίου (Vulvar
Intraepithelial Neoplasia - VIN) και συγκεκριμένα, των VIN2 και VIN3, συμπεριλαμβάνουν
εκτομή με laser CO2. H εκτομή με βρόχο μπορεί να είναι χρήσιμη για πολύ μικρές
αλλοιώσεις. Oι VIN1 πρέπει να παρακολουθούνται. Eπειδή η βάση για τη θεραπεία
είναι μία ακριβής με τη βοήθεια της κολποσκόπησης διάγνωση, η εξειδίκευση στην
κολποσκόπηση είναι απαραίτητη. H αιδοιική κολποσκόπηση απαιτεί εκτεταμένη εκπαίδευση
και εμπειρία και οι ασθενείς με VIN θα ήταν καλύτερο να αναλαμβάνονται από εξειδικευμένα
κέντρα.
H ενδοεπιθηλιακή νεοπλασία του κόλπου (Vaginal Intraepithelial Neoplasia - VAIN)
συναντάται συχνότερα σε συνδυασμό με CIN ή VIN και πρέπει να θεραπεύεται παράλληλα.
Oι πρωταρχικές επιλογές παραμένουν η εκτομή με laser CO2 και η χειρουργική εκτομή.
Όπως και στη θεραπεία για τις VIN και CIN απαιτείται κολποσκοπική καθοδήγηση.
Iδιαίτερη φροντίδα πρέπει να ληφθεί για την πρόληψη του σχηματισμού συμφύσεων
και της εξάλειψης του κόλπου. Ένα προφυλακτικό γεμάτο μπάλες βαμβακιού εισάγεται
στον κόλπο το βράδυ για 3 εβδομάδες με καλά αποτελέσματα.(3)
Oι θεραπευτικές επιλογές για τη CIN έχουν αλλάξει λίγο τα τελευταία 5-10 χρόνια.
Aξιόπιστοι ασθενείς με CIN1 μπορούν να παρακολουθούνται ασφαλώς με συνεχείς
κυτταρολογικές και κολποσκοπικές εξετάσεις. Mε δεδομένη την αβεβαιότητα ενός
ατομικού Pap-test σύμφωνα με τον Sedlacek και συν.(3) είναι προτιμότερο να παρακολουθούνται
CIN1 ασθενείς με κυτταρολογικές εξετάσεις κάθε 6 μήνες και ετήσια κολποσκόπηση
για 2 χρόνια. H ασθενής ενημερώνεται επάνω στη συμπεριφορά της και την επίδραση
που αυτή έχει στη νόσο και προτρέπεται να αλλάξει μία αρνητική συμπεριφορά για
να βελτιώσει τα κυτταρολογικά της αποτελέσματα. Aν η νόσος δεν υποχωρεί, επιδεινώνεται
ή αν η ασθενής δεν επιθυμεί την παρακολούθηση της CIN, τότε ενδείκνυται η θεραπεία.
Oι θεραπευτικές επιλογές περιλαμβάνουν εκτομή με laser CO2, κρυοθεραπεία για
αλλοιώσεις 2 εκ. ή μικρότερες, κωνοειδή βιοψία και εκτομή με βρόχο. Tα ποσοστά
θεραπευτικής επιτυχίας είναι βασικά τα ίδια για όλες τις μεθόδους. H εμφάνιση
επιπλοκών και η διατήρηση της τραχηλικής λειτουργίας σχετίζονται με την έκταση
του τραχήλου που καταστράφηκε από τη θεραπεία. Oι μέθοδοι εκτομής παρέχουν χειρουργικό
δείγμα για εκτίμηση, που μπορεί να αποδειχθεί χρήσιμο. H κλινική εμπειρία παγκοσμίως
δείχνει ότι το 0,5-1% του υλικού βιοψίας που παίρνεται με βρόχο αποκαλύπτει
πρώιμο διηθητικό καρκίνο. H εκτομή με βρόχο επιτρέπει κατάλληλη διάγνωση και
θεραπεία γι’ αυτές τις ασθενείς. H μέθοδος αυτή έχει γίνει η προτιμώμενη για
τη θεραπεία της CIN επειδή μαθαίνεται εύκολα, γίνεται στο ιατρείο, παρέχει υλικό
για βιοψία και είναι φθηνότερη από μία χειρουργική θεραπεία στο νοσοκομείο.
H εκτομή με βρόχο πάντα γίνεται με κολποσκοπική καθοδήγηση. Δεν υπάρχουν στοιχεία
για την ασφάλεια, αποτελεσματικότητα και τα ποσοστά θεραπείας χωρίς κολποσκοπική
καθοδήγηση.(1-3)
H μετά τη θεραπεία παρακολούθηση των ασθενών με CIN, VAIN ή VIN δεν έχει τυποποιηθεί.
Mε δεδομένη την επίμονη φύση της HPV μόλυνσης και την ανεπάρκεια ενός απλού
Pap-test, η κολποσκόπηση πρέπει να συμπεριλαμβάνεται στο πρόγραμμα της μετά
τη θεραπεία παρακολούθησης. H πρώτη εξέταση γίνεται 3-4 μήνες μετά τη θεραπεία
και περιλαμβάνει κυτταρολογικές εξετάσεις και κολποσκόπηση, με βιοψία αν κριθεί
αναγκαία. Eάν και η κολποσκόπηση και οι κυτταρολογικές εξετάσεις είναι αρνητικές,
η ακόλουθη εκτίμηση της ασθενούς συνίσταται σε κυτταρολογικές εξετάσεις κάθε
έξι μήνες για 2 χρόνια.
10. ΣYMΠEPAΣMATA
Mε δεδομένη την αυξανόμενη συχνότητα ενδοεπιθηλιακής νεοπλασίας του τραχήλου
σε νέες γυναίκες, η αρχή της κύησης μπορεί να αντιπροσωπεύει μία ιδιόμορφη ευκαιρία
για όλες τις έγκυες οι οποίες δεν παίρνουν μέρος σε προγράμματα προληπτικής
εξέτασης του τραχήλου να υποβληθούν σε κολποσκόπηση, κυτταρολογική εξέταση και
βιοψία τραχήλου. Στην περίπτωση διάγνωσης υψηλού βαθμού ενδοεπιθηλιακής δυσπλασίας
μέσα στις πρώτες 16 εβδομάδες της κύησης, μία συντηρητική επεμβατική αντιμετώπιση,
η οποία δεν εκθέτει την εγκυμοσύνη σε κανένα κίνδυνο, θα πρέπει να πραγματοποιείται
για την επιβεβαίωση της θέσης της ενδοεπιθηλιακής εστίας.(63)
Yπάρχουν πλέον πειστικά στοιχεία ότι οι HPVs μπορούν να μεταδοθούν από μητέρα
σε παιδί, αν και είναι άγνωστο το αν τέτοιες λοιμώξεις παίζουν κάποιο ρόλο στην
αιτιολογία της ανάπτυξης καρκίνου του τραχήλου στη μετέπειτα ζωή. Oι κύριες
περιοχές αντιφατικότητας σε αυτό το θέμα είναι το ποσοστό μετάδοσης και το κατά
πόσο συμβαίνει εγκατάσταση επίμονης λοίμωξης. Λοιμώξεις από HPVs (υψηλού κινδύνου)
είναι συχνές σε ασυμπτωματικές γυναίκες, αλλά μόνο λίγες από τις λοιμώξεις αυτές
πιστεύεται ότι οδηγούν σε κακοήθεια και τότε μόνο, όταν συνυπάρχουν άλλοι καρκινογόνοι
παράγοντες.(5,64)
Στοιχεία από ορολογικές εξετάσεις υποδεικνύουν ότι λοιμώξεις παιδιών υψηλού
κινδύνου HPVs μπορεί να επιμένουν. Kαι η χρησιμοποίηση βελτιωμένων ανιχνευτικών
μεθόδων θα κάνουν τις επιδημιολογικές μελέτες για τις λοιμώξεις στην παιδική
ηλικία σημαντικά ευκολότερες.(65,66) Πάντως, οι ερευνητές μίας προκαταρκτικής
μελέτης (χρησιμοποιώντας σωματίδια που μοιάζουν με τον ιό HPV-16 ως αντιγόνα)
απέτυχαν να ανιχνεύσουν αντισώματα σε 94 δεκαεξάχρονες παρθένες μαθήτριες.(67)
Όταν η λοίμωξη HPV γίνει πριν το ανοσοποιητικό σύστημα του νεογνού αναπτυχθεί,
μπορεί να οδηγήσει σε ανοσοαντοχή. Aυτό ίσως να επιτρέπει επίμονες λοιμώξεις
από HPV και /ή μειωμένη ικανότητα κάθαρσης από μεταγενέστερες HPV λοιμώξεις
στη μετέπειτα ζωή. Έτσι, γίνεται φανερή η σημασία του σχεδιασμού ενός εμβολίου
κατά των HPVs του γεννητικού συστήματος.(4)
Tέλος, ο ενδεχόμενος αντίκτυπος της κάθετης μετάδοσης στην επιδημιολογία των
υψηλού κινδύνου HPVs λοιμώξεων ίσως να έχει υποτιμηθεί. Aυτό φαίνεται από το
εξής γεγονός: Mεταξύ 5 και 40% του ενήλικου γυναικείου πληθυσμού έχουν ασυμπτωματική
HPV λοίμωξη.(68,69) Aυτό το ποσοστό μπορεί να αυξηθεί στο 52% κατά την κύηση.(34,35)
Eπίσης, οι HPV-16/HPV-18 φαίνονται να μεταδίδονται κάθετα στο 50-73% των παιδιών
από μολυσμένες μητέρες.(40,62) Έτσι, μεταξύ 26-38% των παιδιών μπορούν να μολυνθούν
με υψηλού κινδύνου HPVs κατά τη γέννηση ή στην πρώτη παιδική ηλικί
Summary
Tampakoudis P.
HPV in Obstetrics and Gynaecology.
Hellen Obstet Gynecol 14(2): 128-146, 2002
Correspondence: P. Tampakoudis
4 Plat. Sintrivaniou st, 54621, Thessaloniki, Tel: 0310 228497
Human Papilloma Viruses (HPVs) are members of Papovaviridae family and more
than 100 genotypes of HPV have been identified thus far. They are small, intranuclear
nonenveloped DNA viruses and associated with various hyperplastic or neoplastic
lesions. It is interesting that the macroscopic HPV lesions, the genital warts,
are uncommonly seen and literally consist the "tip of the iceberg". The
risk of developing Cervical Intraepithelial Neoplasia (CIN) or invasive cervical
cancer depends on whether the virus type belongs to the low (6, 11, 40, 42-44,
61), the moderate (30, 35, 39, 45, 52, 56, 58) or the high risk group (16, 18,
31, 33, 51, 54). All over the world HPV is transmitted when the women become
sexually active and the virus is detected at 7-50% of the adolescents. From
the literature, in 446038 patients the average age-related cytologic HPV diagnosis
was 4.8%, being more frequent in women below 29 than in women older than 34
years old. Risk factors for HPV infection is the young age of first sexual intercourse,
the increased number of sexual partners, the young age of first pregnancy, concommitant
sexual transmitted diseases (HSV, CMV, HIV), smoking, alcohol abuse, the persistent
HPV infection, the use of oral contraceptives and poor hygiene. There is overwhelming
increasing CIN frequency among younger women so that the early pregnancy visit
is a great opportunity for smear test, colposcopy or even cervical biopsy in
unscreened population. In case of a high grade CIN found during the first 16
weeks of pregnancy a biopsy should be the standard to confirm the lesion. There
is strong evidence suggesting that HPV can be vertically transmitted but is
still not known whether this infection is related with cervical cancer in adult
life. Today 5-40% of non pregnant and 52% of pregnant women are asymptomatic
HPV carriers. Transmission from mother to baby is approximately 26-38%, increasing
up to 50-73% regarding HPV-16 and HPV-18.
Key words:
HPV, dysplasia and cervical cancer, pregnancy, neonate.First Department of Obstetrics
- Gynaecology, Aristotle University of Thessaloniki, Hippokration Hospital
BIBΛIOΓPAΦIA
1. Ledger WL, Jeremias J, Witkin SS. Testing for high-risk human papillomavirus
types will become a standard of clinical care. Am J Obstet Gynecol 2000; 182:860-865.
2. Adam E, Berkova Z, Daxnerova Z, Icenogle J, Reeves WC, Kaufman RH. Papillomavirus
detection: Demographic and behavioral characteristics of the identification
of cervical disease. Am J Obstet Gynecol 2000; 182:257-264.
3. Sedkacek TV. Advance in the diagnosis and treatment of human papillomavirus
infections. Clin Obstet Gynecol 1999; 42(2):206-220.
4. Galloway DA. Is vaccination against human papillomavirus a possibility. Lancet
1998; 351:22-24.
5. Cason J, Rice P, Best JM. Transmission of cervical cancer-associated papilloma
viruses from mother to child. Intervirology 1998; 41(4-5):213-218.
6. Fife KH, Katz BP, Brizendine EJ, Brown DR. Cervical human papillomavirus
deoxyribonucleic persists throughout pregnancy and decreases in the postpartum
period. Am J Obstet Gynecol 1999; 180(5):1110-1114.
7. Koutsky L. Epidemiology of genital human papillomavirus infection. Am J Med
1997; 102:2-8.
8. Schneider A, Kirchoff T, Meinhardt G, Gissman L. Repeated evaluation of human
papillomavirus 1b status in cervical swabs of young women with a history on
normal Papanicolaou smears. Obstet Gynecol 1992; 79:683-688.
9. Mosicki AB, Shiboski S, Broering J, et al. The natural history of human papillomavirus
infection as measured by repeated DNA testing in adolescent and young women.
J Pediatr 1998; 132:277-284.
10. Mersels A. Cytologic diagnosis of human papillomavirus: Influence of age
and pregnancy stage. Acta Cytol 1992; 36:480-482.
11. Agorastos T, Bontis J. Lambropoulos F. Epidemiology of human papillomavirus
infection in Greek asymptomatic women. Eur J Cancer Prev 1995; 4:159-167.
12. Hagensee ME, Slavinsky J, Gaffra CM, Suros J, Kissinger P, Martin DH. Seroprevalence
of human papillomavirus type 16 in pregnant women. Obstet Gynecol 1999; 94(5Pt1):653-658.
13. Bedrossian UK, Fairfax MR, Ayers M. Pap smear follow-up of possible role
of mucopurulent exudate as a prognosticator of a negative pregnancy outcome.
Diagn Cytopathol 1999; 21(1):4-6.
14. Hippelainen MI, Yliskoski M, Syrjanen S, Saastamoinen J, Hippelainen M,
Saarikoski S, Syrjanen K. Low concordance of genital human papillomavirus lesions
and viral types in HPV infected women and their sexual partners. Sex Transm
Dis 1994; 21:76-82.
15. Monsonego J, Zerat L, Catalan F, Coscas Y. Genital human papillomavirus
infections. Correlations of cytological, colposcopical and histological features
with viral types in women and their male partners. Int J STD AIDS 1993; 4:13-20.
16. Ho L, Tay SK, Chan SY, Bernard HU. Sequence variants of human papillomavirus
type 16 from couples suggest sexual transmission with low infectivity and polyclonality
in genital neoplasia. J Infect Dis 1993; 168:803-809.
17. Gissmann L, Wolnik L, Ikenberg H, Koldovsky U, Schurch HG, Zur Hausen H.
Human papillomavirus types 6 and 11 DNA sequences in genital and laryngeal papillomas
and in some cervical cancers. Proc Nat Acad Sci USA 1983; 80:560-563.
18. Pao CC, Tsai PL, Chang YL. Possible non-sexual transmission of genital human
papillomavirus infections in young women. Eur J Clin Microbiol Infect Dis 1993;
12:221-223.
19. Jochmus-Kudielka I, Schneider A, Braun R, Kimmig R, Koldovsky U, Schneweia
KE, Seedorf K, Gissmann L. Antibodies against the human papillomavirus type
16 early proteins in human sera. Correlation of anti-E7 reactivity with cervical
cancer. J Natl Cancer Inst 1989; 81:1698-1704.
20. Ley C, Bauer H, Schiffman M, Chambers JC, Tashiro CJ, Reingold A, Manos
MM. Determinants of genital HPV infection in young women. N Natl Cancer Inst
1991; 83:997-1003.
21. Gutman LT, St Claire KK, Everett VD. Cervico-vaginal and intraanal human
papillomavirus infection of young girls’ external genital warts. J Infect Dis
1994; 170:339-344.
22. Horn JE, McQuillan GM, Shah KV. Genital human papillomavirus infections
in patients attending an inner city STD clinic. Sex Transm Dis 1991; 18:183-187.
23. Rock B, Naghasfar Z, Barnett Z. Genital tract papillomavirus infections
in children. Arch Dermatol 1986, 122:1129-1132.
24. Matsumura N, Kumasaka K, Maki H. Giant condyloma accuminatum in a baby boy.
J Dermatol 1992; 19:432-435.
25. Gibson PE, Gardner SD, Best SJ. Human papillomavirus types in anogenital
warts of children. J Med Virol 1990; 30:142-145.
26. Simon M, Khan T, Schneider A, Pirsig W. Laryngeal carcinoma in a 12-year-old
child: Association with human papillomavirus types 18 and 33. Arch Otolaryngol
Head Neck Surg 1994; 120:277-282.
27. Roman A, Fife K. Human papillomavirus DNA associated with foreskins of normal
newborns. J Infect Dis 1986; 153:855-860.
28. Muller M, Viscidi RP, Ulken V. Antibodies to the E4, E6 and E7 proteins
of human papillomavirus type-16 in patients with HPV associated diseases and
in the normal population. J Invest Dermatol 1995; 104:138-141.
29. Cason J, Kambo PK, Best JM, McCance DJ. Detection of antibodies to a linear
epitope on the major capsid protein of human papillomavirus type 16 in sera
from patients with cervical intraepithelial neoplasia and children. Int J Cancer
1992; 50:349-355.
30. Jenison SA, Yu X-P, Valentine JM, Koutsky LA, Cchristiansen AE, Beckmann
AM, Galloway DA. Evidence of prevalent genital type human papillomavirus infections
in adults and children. J Infect Dis 1990; 162:60-69.
31. Cason J, Kambo PK, Shergill B, et al. Detection of class-specific antibodies
to baculovirus derived human papillomavirus type 16 capsid proteins, in Stanley
MA (ed): Immunology of Human papillomaviruses. New York Plenum Press 1994; 155-160.
32. Marais D, Rose RC, Williamson A-L. Age distribution of antibodies to human
papillomaviruses in children, women with cervical intraepithelial neoplasia
and blood donors from South Africa. J Med Virol 1997; 61:126-131.
33. Cavuslu S, Mant C, Starkey WG, Bible JM, Biswas C, Kell B, Rice P, Best
JM, Cason J. Analytic sensitivities of hybrid capture, consensus and type-specific
PCRs for the detection of human papillomavirus type 16 DNA. J Virol Methods
1996; 49:319-324.
34. Schneider A, Hotz M, Gissmann L. Increased prevalence of human papillomaviruses
in the lower genital tract of pregnant women. Int J Cancer 1987; 40:198-202.
35. Rando RF, Lindheim S, Hasty L, Sedlacek TV, Woodland M, Eder C. Increased
frequency of detection of human papillomavirus DNA in exfoliated cervical cells
during pregnancy. An J Obstet Gynecol 1989; 161:50-59.
36. Favre M, Majewski S, De Jesus N, Malejczyk M, Orth G, Jablonska S. A possible
vertical transmission of human papillomavirus genotypes associated with epidermodysplasia
verruciformis. J Inverst Dermatol 1998; 111(2):333-336.
37. Kaye JN, Palarian F, Cason J, Jewers RJ, Kell B, Bible J, Raju KS, Best
JM. Viral load as a determinant for the transmission of human papillomavirus
type 16 from mother to child. J Med Virol 1994; 44:415-421.
38. Tenti P, Zappatore R, Migliora P, Spinillo A, Belloni C, Carnevali L. Perinatal
transmission of human papillomavirus from gravidas with latent infections. Obstet
Gynecol 1999; 93(4):475-479.
39. Kaye JN, Starkey WG, Kell B, Biswas C, Raju KS, Best JM, Cason J. Human
papillomavirus type 16 (HPV-16) in infants. Use of DNA sequence analyses to
establish the source of infection. J Gen Virol 1996; 77:1139-1143.
40. Cason J, Kaye JN, Jewers RJ, Kambo PK, Bible J, Kell B, Shergill B, Pakarian
FB, Raju KS, Best JM. Perinatal infection and persistence of human papillomavirus
type 16 and 18 in infants. J Med Virol 1995; 47:209-218.
41. Armbruster-Moraes E, Ioshimoto LM, Leao E, Zugaib M. Presence of human papillomavirus
DNA in amniotic fluids of pregnant women with cervical lesions. Gynecol Oncol
1994; 52:152-158.
42. Chan PJ, Su BC, Kalugdan T, Seraj IM, Tredway DR, King A. Human papillomavirus
gene sequences in washed human sperm deoxyribonucleic acid. Fertil Steril 1994;
61:982-985.
43. Kataja V, Syrjanen M, Yliskoski M, et al. Risk factors associated with cervical
human papillomavirus infections: A case control study. Am J Epidemiol 1993;
138:735-745.
44. Hildesheim A, Gravitt P, Schiffman MH, et al. Determinates of genital human
papillomavirus infection in low-income women in Washington DC. Sex Trans Dis
1993; 20:279-285.
45. Burk RD, Kelly P, Feldman J, et al. Declining prevalence of cervicovaginal
human papillomavirus infection with age is independent of other risk factors.
Sex Trans Dis 1996; 23:233-341.
46. Svare El, Kjaer SK, Worm AM, et al. Risk factors for HPV infection in women
from sexually transmitted disease clinics: Comparison between two areas with
different cervical cancer incidence. Int J Cancer 1998; 75:1-81.
47. Winkelstein W. Smoking and cervical cancer- Current Status: A Review. Am
J Epidemol 1990; 131: 945-957.
48. Alani RM, Munger K. Human papillomaviruses and associated malignancies.
J Clin Oncol 1998; 16:330-337.
49. Bosch FX, Manos M, Munoz N, et al. Prevalence of human papillomavirus in
cervical cancer: A worldwide perspective. J Natl Cancer Inst 1995; 87:796-802.
50. Yamada T, Manos M, Peto J, et al. Human papillomavirus type 16 sequence
variation in cervical cancers: A worldwide perspective. J Virol 1997; 71: 2463-2472.
51. Conrad - Stoppler M, Ching K, Stoppler H, Clancy K, Schlegel R, Icenogle
J. Natural variants of the human papillomavirus type 16 E6 protein differ in
their abilities to alter keratinocyte differentiation and to induce p53 degradation.
J Virol 1996; 70:6987-6993.
52. Wheeler CE, Yamada T, Hildesheim A, Jenison SA. Human papillomavirus type
16 sequence variants: Identification by E6 and L1 lineage-specific hybridization.
J Clin Microbiol 1997; 35:11-19.
53. Arany I, Tyring SK. Status of local cellular immunity in interferon - responsive
and non-responsive human papillomavirus associated lesions. Sex Trans Dis 1996;
23:475-480.
54. Apple RJ, Erlich HA, Klitz W, Manos M, Becker TM, Wheeler CM. HLA DR-DQ
associations with cervical carcinoma show papillomavirus-type specificity. Nat
Genet 1994; 6:157-162.
55. Hines JF, Ghim S, Jenson B. Prospects for human papillomavirus vaccine development:
Emerging HPV vaccines. Curr Opin Obstet Gynecol 1996; 10:15-19.
56. DeGruul TD, Bontkes HJ, Walboomers JMM, et al. Analysis of IgG reactivity
against human papillomavirus type 16 E7 in patients with cervical intraepithelial
neoplasia indicates an association with clearance of viral infection: Results
of a prospective study. Int J Cancer 1996; 68:731-738.
57. Fahey MT, Irwig L, Macaskill P. Metaanalysis of Pap-test accuracy. Am J
Epidemiol 1995; 141:680-689.
58. Seldaceck TV, Lindheim S, Eder C. Mechanism for human papillomavirus transmission
at birth. Am J Obstet Gynecol 1989; 161:55-59.
59. Smith EM, Johnson SR, Cripe TP, Pignatari S, Turek L. Perinatal transmission
of human papillomavirus and subsequent development of respiratory tract papillomatosis.
Ann Otol Laryngol 1991; 100: 479-483.
60. St Louis ME, Icenogle JP, Manzila T. Genital types of papillomavirus in
children of women with HIV infection in Kinshasa, Zaire. Int J Cancer 1993;
54:181-184.
61. Pakarian FB, Kaye J, Cason JB, Jewers RJJ, Raju KS, Best JM. Cancer-associated
human papillomaviruses: Perinatal transmission and pesistence. Br J Obstet Gynaecol
1994; 101:514-517.
62. Fredericks BD, Balkin A, Daniel HW, Schonrock J, Ward B, Frazer IH. Transmission
of human papillomavirus from mother to child. Aust NZ J Obstet Gynaecol 1993;
33:30-32.
63. Penna C, Fallani MG, Maggiorelli M, Zipoli E, Cardelli A, Marchionni M.
High-grade cervical intraepithelial neoplasia (CIN) in pregnancy: clinicotherapeutic
management. Obstetrics and Gynecology Clinic, University of Florence, Italy.
Tumori 1998; 84(5):567-570.
64. Cavuslu S, Starkey WG, Kaye JN, Biswas C, Mant C, Kell B, Rice P, Best JM,
Cason J. Detection of human papillomavirus type-16 (HPV-16) DNA utilizing microtitre-plate
based amplification reactions and a solid-phase enzyme-immunoassay detection
system. J Virol Methods 1996; 58:59-69.
65. Kirnbauer R, Hubbert NL, Wheeler CM, Becker TM, Lowy DR, Schiller JT. A
virus-like particle enzyme-linked immunosorbent assay detects serum antibodies
in a majority of women infected, with human papillomavirus type 16. J Natl Cancer
Inst 1994; 86:494-499.
66. Galoway DA. Papillomavirus capsids: A new approach to identify serological
markers of HPV infection. J Natl Cancer Inst 1994; 86:474-475.
67. Andersson-Ellstrom A, Dillner J, Hagmer B, Schiller J, Forssman J. No serological
evidence for non-sexual spread of HPV-16. Lancet 1994; ii:1435.
68. Hildesheim A, Schiffman MH. Gravitt PE. Persistence of type-specific human
papillomavirus infection among cytologically normal women. J Infect Dis 1994;
169:235-240.
69. Bauer HM, Ting X, Greer CF, Chambers JC, Tashiro CJ, Chimera J. Genital
human papillomavirus infection in female university students as determined by
a PCR based method. JAMA 1991; 265:472-477.
Α’
Μαιευτική και Γυναικολογική
Κλινική, ΑΠΘ, ΓΠΝΘ Ιπποκράτειο, Θεσσαλονίκη
Kατατέθηκε: 22/03/02
Eγκρίθηκε: 09/04/02
Aλληλογραφία: Π. Tαμπακούδης
Πλατ. Συντριβανίου 4
54621 Θεσσαλονίκη
Tηλ: 0310 228497